| Issue |
Med Sci (Paris)
Volume 21, Number 11, Novembre 2005
|
|
|---|---|---|
| Page(s) | 903 - 904 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20052111903 | |
| Published online | 15 November 2005 | |
Structure du cofacteur GUN4 du complexe Mg-chélatase : Une nouvelle conformation pour la fixation de la porphyrine
Structure of the Mg-chelatase cofactor GUN4 reveals a novel hand-shaped fold for porphyrin binding
1
Chemical Biology and Proteomics Laboratory, Salk Institute for Biological Studies, La Jolla, California, États-Unis.
2
Department of Neurobiology and Behavior, State University of New York, Stony Brook, New York,États-Unis
3
MSU-DOE Plant Research Laboratory, Michigan State University, East Lansing, Michigan, États-Unis
4
Howard Hughes Medical Institute, Plant Molecular and Cellular Biology Laboratory, Salk Institute for Biological Studies, La Jolla, California, États-Unis
5
Institut de Biologie structurale CEA-CNRS-UJF, Grenoble, France
Le fonctionnement des organites au sein de la cellule est commandé principalement par la régulation de l’expression de gènes nucléaires en réponse à des signaux engendrés par le développement normal ou en provenance de l’environnement. Parallèlement, les organites produisent des signaux en direction du noyau, dans un processus nommé signalisation rétrograde, afin de coordonner les activités biologiques des deux compartiments cellulaires. Par exemple, chez les animaux et les levures, la signalisation de la mitochondrie et du réticulum endoplasmique vers le noyau ont un impact majeur sur des activités cellulaires dans un grand nombre de situations [1, 2]. Chez les plantes, la signalisation du plastide vers le noyau modifie de manière significative l’expression des gènes nucléaires qui codent les protéines localisées dans le chloroplaste et impliquées dans la photosynthèse, ainsi que dans la morphogenèse des feuilles [3–6]. Par conséquent, les signaux provenant des plastides jouent un rôle majeur dans la croissance photo-autotrophe.
Plus spécifiquement, l’accumulation dans le plastide de la magnésium-protoporphyrine IX (Mg-proto), précurseur de la chlorophylle, régule l’expression d’un certain nombre de gènes nucléaires dont la fonction est liée à la photosynthèse. L’analyse, chez Arabidopsis thaliana, de l’activité de la signalisation du plastide vers le noyau liée à Mg-proto a conduit à la découverte de GUN4, une nouvelle protéine se liant à la porphyrine et qui augmente également de façon significative l’activité de la Mg-chélatase, l’enzyme qui synthétise Mg-proto. GUN4 semble également jouer un rôle à la fois dans la photo-protection et dans le transport cellulaire des tétrapyrroles.
Nous avons résolu la structure cristallographique de GUN4 chez la cyanobactérie modèle Synechocystis (SynGUN4, homologue de GUN4 chez la plante) à 1,78Å de résolution [7]. Dans cette structure, le domaine se liant à la porphyrine adopte une forme tridimensionnelle unique avec un aspect évasé qui rappelle une main. Cette structure présente deux domaines liés par une boucle à 12 résidus (Figure 1A). Le domaine carboxy-terminal (domaine «noyau» de GUN4), est le domaine conservé parmi tous les membres de la famille GUN4. Le domaine amino-terminal de SynGUN4 comprend les cinq premières hélices. Les hélices α1’ à α4’ se replient de façon compacte et de haut en bas, et l’ajout de l’hélice α5’ donne au domaine une section transversale allongée. De façon générale, ce domaine amino-terminal compact rappelle l’aspect d’autres domaines entièrement composés d’hélices, tels que le domaine TPR (tretratricopeptid repeats) [8] ou le domaine 14-3-3 [9]. L’ensemble du domaine amino-terminal est maintenu par un noyau hydrophobe consistant entièrement en un entrelacement de leucines, d’isoleucines et de valines provenant des différentes hélices. Contrairement au domaine amino-terminal, la surface du domaine carboxy-terminal est fortement chargée (Figure 1B). Les hélices α2’ et α3’ consolident structurellement cette architecture en reliant une extrémité du domaine à l’autre.
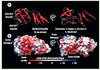 |
Figure 1. Structure de GUN4 de Synechocystis. A. Vues orthogonales de la structure cristallographique de l’ensemble de la protéine GUN4 de Synechocystis (résidus 1-233) (SynGUN4). Les hélices sont représentées par des cylindres rouges et les boucles en gris clair. SynGUN4 contient deux domaines distincts liés par une boucle flexible. Les hélices du domaine amino-terminal sont notées avec des apostrophes pour les distinguer des hélices du domaine carboxy-terminal. Helical bundle: signifie paquet d’hélices (intraduisible). Les figures ont été préparées avec MOLSCRIPT [10] et POV-Ray (http://www.povray.org). B. Vues orthogonales préparées avec GRASP [11] représentant la surface de SynGUN4 et colorée afin de refléter approximativement le potentiel électrostatique, bleu pour les zones chargées positivement, rouge pour les zones négatives, et blanc pour les zones neutres. |
L’analyse biophysique et biochimique a mis en évidence le site d’interaction entre GUN4 et Mg-proto et a établi les caractéristiques énergétiques de l’interaction GUN4-Mg-proto. En effet, afin de déterminer le site de fixation de la porphyrine dans SynGUN4, nous avons utilisé la RMN pour une analyse de la protéine entière, en l’absence et en présence d’un analogue de la protoporphyine, le deutéroporphyrine IX. La grande majorité des résidus dont l’environnement change significativement se sont révélés être localisés dans le domaine «noyau» de GUN4 (Figure 2).
 |
Figure 2. Analyse de SynGUN4 par la RMN. Représentation en ruban du domaine noyau de Gun4. Le codage par couleur indique l’amplitude du décalage chimique des pics 1H-15N (barre de couleur du bas). Brièvement, les décalages de plus de 2,5 parties par million (ppm) sont représentés en rouge, les décalages entre 2 et 2,5 ppm en orange, les décalages entre 1,5 et 2 ppm en jaune, et les décalages de 1,5 ppm et moins en vert. |
L’utilisation combinée de la RMN et de la cristallographie aux rayons X nous a donc permis de proposer un mécanisme pour la séquestration de la porphyrine par GUN4 et par les protéines similaires à GUN4. Ensemble, ces analyses structurales et énergétiques forment une base pour la compréhension de l’activité de GUN4, introduisant un rôle de protection de GUN4 dans le transport du tétrapyrrole. Ces résultats viennent compléter notre compréhension du rôle de GUN4 dans la stimulation de l’activité Mg-chélatase, aussi bien que dans la signalisation Mg-protorétrograde.
Remerciements
Ce travail a été soutenu par la bourse CA54418 du National Institutes of Health/National Cancer Institute, USA, ainsi que par la bourse 0236027 du United States Department of Energy.
Les coordonnées de SynGUN4 (code PDB: 1Y6I) ont été déposées dans la Protein Data Bank (http://www.rcsb.org).
Références
- Butow RA, Avadhani NG. Mitochondrial signaling: the retrograde response. Mol Cell 2004; 14 : 1–15. [Google Scholar]
- Zhang K, Kaufman RJ. Signaling the unfolded protein response from the endoplasmic reticulum. J Biol Chem 2004; 279 : 25935–8. [Google Scholar]
- Rodermel S. Pathways of plastid-to-nucleus signaling. Trends Plant Sci 2001; 6 : 471–8. [Google Scholar]
- Richly E, Dietzmann A, Biehl A, et al. Covariations in the nuclear chloroplast transcriptome reveal a regulatory master-switch. EMBO Rep 2003; 4 : 491–8. [Google Scholar]
- Rodermel S, Park S. Pathways of intracellular communication: Tetrapyrroles and plastid-to-nucleus signaling. Bioessays 2003; 25 : 631–6. [Google Scholar]
- Strand A, Asami T, Alonso J, et al. Chloroplast to nucleus communication triggered by accumulation of Mg-protoporphyrin IX. Nature 2003; 421 : 79–83. [Google Scholar]
- Verdecia MA, Larkin R, Ferrer JL, Riek R, Chory J, Noel JP. Structure of the Mg-chelatase cofactor GUN4 reveals a novel hand-shaped fold for porphyrin binding. PloS Biol 2005; 3 : e151. [Google Scholar]
- D’Andrea LD, Regan L. TPR proteins: the versatile helix. Trends Biochem Sci 2003; 12 : 655–62. [Google Scholar]
- Yaffe MB, Elia AE. Phosphoserine/threonine-binding domains. Curr Opin Cell Biol 2001; 2 : 131–8. [Google Scholar]
- Kraulis PJ. MOLSCRIPT. A program to produce both detailed and schematic plots of protein structures. JAppl Crystallogr 1991; 24 : 946–50. [Google Scholar]
- Nicholls A, Sharp KA, Honig B. Protein folding and association: insights from the interfacial and thermodynamic properties of hydrocarbons. Proteins 1991; 11 : 281–96. [Google Scholar]
© 2005 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Structure de GUN4 de Synechocystis. A. Vues orthogonales de la structure cristallographique de l’ensemble de la protéine GUN4 de Synechocystis (résidus 1-233) (SynGUN4). Les hélices sont représentées par des cylindres rouges et les boucles en gris clair. SynGUN4 contient deux domaines distincts liés par une boucle flexible. Les hélices du domaine amino-terminal sont notées avec des apostrophes pour les distinguer des hélices du domaine carboxy-terminal. Helical bundle: signifie paquet d’hélices (intraduisible). Les figures ont été préparées avec MOLSCRIPT [10] et POV-Ray (http://www.povray.org). B. Vues orthogonales préparées avec GRASP [11] représentant la surface de SynGUN4 et colorée afin de refléter approximativement le potentiel électrostatique, bleu pour les zones chargées positivement, rouge pour les zones négatives, et blanc pour les zones neutres. |
| Dans le texte | |
 |
Figure 2. Analyse de SynGUN4 par la RMN. Représentation en ruban du domaine noyau de Gun4. Le codage par couleur indique l’amplitude du décalage chimique des pics 1H-15N (barre de couleur du bas). Brièvement, les décalages de plus de 2,5 parties par million (ppm) sont représentés en rouge, les décalages entre 2 et 2,5 ppm en orange, les décalages entre 1,5 et 2 ppm en jaune, et les décalages de 1,5 ppm et moins en vert. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




