| Issue |
Med Sci (Paris)
Volume 19, Number 1, Janvier 2003
|
|
|---|---|---|
| Page(s) | 25 - 26 | |
| Section | Le Magazine : Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/200319125 | |
| Published online | 15 January 2003 | |
Détermination du sexe des mammifères : la mise à jour d’un trafic?
Mammals sex determination: uncovering new trades
Groupe de génétique moleculaire humaine, Institut de Génétique Humaine, UPR1142 Cnrs, 141, rue de la Cardonille, 34396 Montpellier Cedex 5, France
Les dix ans de la découverte du facteur de détermination testiculaire des mammifères SRY (sex determining region Y chromosome) ont été célébrés en 2001 lors d’un symposium organisé par la Fondation Novartis [1]. Cette réunion internationale des principaux acteurs du domaine a permis de mesurer le chemin parcouru depuis le clonage de ce gène, mais aussi le chemin restant à parcourir pour comprendre comment un même tissu embryonnaire simple peut donner naissance à deux organes aussi différents que le testicule et l’ovaire. Dans les deux sexes, la gonade est constituée par l’excroissance de la crête génitale, phénomène détectable dès 10,5 jours postcoïtum chez la souris. Elle constitue alors une ébauche de gonade bi-potente, c’est-à-dire capable de former une gonade mâle ou femelle, qui s’oriente vers un destin testiculaire après expression du gène Sry localisé sur le bras court du chromosome Y. Très tôt, il fut proposé que la protéine SRY pourrait agir comme un facteur de transcription liant et courbant l’ADN par l’intermédiaire d’un domaine protéique caractéristique de la superfamille des protéines de forte mobilité ou famille HMG [2]. L’expression du gène Sry induit un ensemble d’événements morphogénétiques incluant la prolifération et la délamination des cellules de l’épithélium coelomique de la crête neurale, la migration de cellules issues du mésonéphros, l’induction d’une vascularisation spécifique et enfin l’organisation de cordons sexuels entourant les cellules germinales primordiales [3]. Toutefois, SRY n’est retrouvé que chez les mammifères et, sur le plan moléculaire, aucune cible directe n’a pu être décrite à ce jour.
Dans le même temps, d’autres facteurs de transcription à domaine HMG similaire à celui de SRY ont été isolés et caractérisés [4]. En particulier, Sox9, un gène autosomique conservé chez l’ensemble des vertébrés, s’est révélé constituer un autre facteur de détermination testiculaire. Des mutations hétérozygotes de Sox9 engendrent chez l’homme, outre le syndrome campomélique (→), une inversion de sexe chez 75 % des individus XY. Sox9 est également capable d’induire la formation de testicules en l’absence de SRY chez des souris transgéniques de génotype XX (→→). SOX9 contribue à l’activation transcriptionnelle du gène codant pour l’hormone anti-müllérienne (AMH) dans la cellule de Sertoli, conduisant à la régression des conduits müllériens femelles et clôturant ainsi les étapes regroupées sous le terme de détermination du sexe [5, 6]. Sox9 constitue un candidat cible plausible pour SRY car il est surexprimé spécifiquement chez le mâle durant une fenêtre temporelle compatible avec un contrôle direct par SRY [7]. Cependant, SOX9 est déjà exprimé dans les gonades mâles et femelles juste avant l’étape de détermination sexuelle. À ce stade, et malgré la présence de signaux de localisation nucléaire (NLS) [8], la localisation subcellulaire du facteur SOX9 est uniquement cytoplasmique, l’entrée dans le noyau s’opérant dans la seule gonade mâle après l’expression du gène Sry [9]. Une étude récente démontre la présence, dans le domaine de liaison à l’ADN de SOX9, d’un signal d’export nucléaire (NES) fonctionnel [10] et permet d’établir de nouvelles hypothèses sur le mécanisme d’induction de la différenciation testiculaire. L’export nucléaire de SOX9 est dépendant de la protéine d’export CRM1 et peut donc être inhibé par la leptomycine B (LMB). L’inhibition de l’export par la LMB, dans des gonades de souris de génotype XX cultivées in vitro, conduit au maintien de SOX9 dans le noyau et à l’induction d’une détermination mâle attestée par la mise en place de cordons sexuels sécréteurs d’hormone anti-müllérienne (Figure 1). Cette observation suggère que c’est la localisation subcellulaire de SOX9, elle-même dépendante des séquences NLS et NES, qui contrôlerait le mécanisme de détermination du sexe: l’entrée de SOX9 dans le noyau conduirait à la différenciation mâle et son maintien dans le cytoplasme à la différenciation femelle (Figure 2). Ces observations devront être confirmées in vivo, en particulier par des études visant à comprendre dans quelle mesure une altération d’origine génétique ou environnementale de ce transport pourrait expliquer certaines pathologies du développement de l’appareil reproducteur. Quoi qu’il en soit, SOX9 s’ajoute à la longue liste des facteurs de transcription dont la localisation cytoplasmique ou nucléaire permet de moduler des processus fondamentaux de la différenciation et du développement.
(→) m/s 2001, n° 10, p. 1242
(→→) m/s 2002, n° 2, p. 149
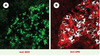 |
Figure 1. Différenciation testiculaire dans des gonades XX cultivées en présence de leptomycine B. Cryo-sections adjacentes d’une gonade femelle cultivée in vitro en présence de 5 ng/ml de leptomycine B. Marquage par immunofluorescence avec les anticorps anti-SOX9 (vert) et anti-AMH (rouge). Les cellules germinales primitives sont révélées par l’activité de la phosphatase alkaline (en blanc, montré dans B seulement). Le maintien de la protéine SOX9 dans le noyau des cellules de gonades XX les conduit, après développement in vitro, vers un phénotype de cellule de Sertoli. La protéine SOX9 est maintenue dans le noyau de cellules organisées en structures ressemblant aux cordons sexuels (A). La sécrétion d’AMH est induite dans ces mêmes cellules, autour des cellules germinales (B). |
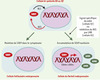 |
Figure 2. Modèle de régulation de la détermination sexuelle par la localisation subcellulaire de SOX9. Avant la différenciation sexuelle, dans les cellules bi-potentes précurseurs des cellules folliculaires chez la femelle ou des cellules de Sertoli chez le mâle, la protéine SOX9 est maintenue dans le cytoplasme. Chez la femelle, SOX9 demeure cytoplasmique et disparaît avec la formation des cellules folliculaires embryonnaires. Chez le mâle, l’expression du gène Sry est suivie de l’entrée de SOX9 dans le noyau, ce qui déclenche le programme de différenciation mâle. Dans des cellules précurseurs femelles, la leptomycine B (LMB) provoque la rétention de la protéine SOX9 dans le noyau et provoque ainsi l’induction du programme mâle. L’entrée de SOX9 dans le noyau agirait comme un interrupteur déclenchant la voie de différenciation mâle, nécessaire pour prendre le relais du signal induit par SRY, mais également suffisant pour s’y substituer. AMH: anti-mullerian hormone; NES: nuclear export signal; NLS: nuclear localization signal. |
Références
- The genetics and biology of sex determination. In: Chadwick D, Goode J, eds. Novartis found symposium 244. London: John Wiley and Sons Ltd, 2002 : 266 p. [Google Scholar]
- Sinclair AH, Berta P, Palmer MS, et al. A gene from the human sex-determining region encodes a protein with homology to a conserved DNA-binding motif. Nature 1990; 346: 240–4. [Google Scholar]
- Schmahl J, Eicher EM, Washburn LL, Capel B. Sry induces cell proliferation in the mouse gonad. Development 2000; 127: 65–73. [Google Scholar]
- Bowles J, Schepers G, Koopman P. Phylogeny of the SOX family of developmental transcription factors based on sequence and structural indicators. Dev Biol 2000; 227: 239–55. [Google Scholar]
- De Santa Barbara P, Bonneaud N, Boizet B, et al. Direct interaction of SRYrelated protein SOX9 and steroidogenic factor 1 regulates transcription of the human anti-Mullerian hormone gene. Mol Cell Biol 1998; 18: 6653–65. [Google Scholar]
- Arango NA, Lovell-Badge R, Behringer RR. Targeted mutagenesis of the endogenous mouse Mis gene promoter: in vivo definition of genetic pathways of vertebrate sexual development. Cell 1999; 99: 409–19. [Google Scholar]
- Morais da Silva S, Hacker A, Harley V, Goodfellow P, Swain A, Lovell-Badge R. Sox9 expression during gonadal development implies a conserved role for the gene in testis differentiation in mammals and birds. Nat Genet 1996; 14: 62–8. [Google Scholar]
- Sudbeck P, Scherer G. Two independent nuclear localization signals are present in the DNA- binding high-mobility group domains of SRY and SOX9. J Biol Chem 1997; 272: 27848–52. [Google Scholar]
- De Santa Barbara P, Moniot B, Poulat F, Berta P. Expression and subcellular localization of SF-1, SOX9, WT1, and AMH proteins during early human testicular development. Dev Dyn 2000; 217: 293–8. [Google Scholar]
- Gasca S, Cañizares J, de Santa Barbara P, et al. A nuclear export signal within the HMG domain regulates the nucleocytoplasmic translocation of SOX9 during sexual determination. Proc Natl Acad Sci USA 2002; 99: 11199–204. [Google Scholar]
© 2003 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Différenciation testiculaire dans des gonades XX cultivées en présence de leptomycine B. Cryo-sections adjacentes d’une gonade femelle cultivée in vitro en présence de 5 ng/ml de leptomycine B. Marquage par immunofluorescence avec les anticorps anti-SOX9 (vert) et anti-AMH (rouge). Les cellules germinales primitives sont révélées par l’activité de la phosphatase alkaline (en blanc, montré dans B seulement). Le maintien de la protéine SOX9 dans le noyau des cellules de gonades XX les conduit, après développement in vitro, vers un phénotype de cellule de Sertoli. La protéine SOX9 est maintenue dans le noyau de cellules organisées en structures ressemblant aux cordons sexuels (A). La sécrétion d’AMH est induite dans ces mêmes cellules, autour des cellules germinales (B). |
| Dans le texte | |
 |
Figure 2. Modèle de régulation de la détermination sexuelle par la localisation subcellulaire de SOX9. Avant la différenciation sexuelle, dans les cellules bi-potentes précurseurs des cellules folliculaires chez la femelle ou des cellules de Sertoli chez le mâle, la protéine SOX9 est maintenue dans le cytoplasme. Chez la femelle, SOX9 demeure cytoplasmique et disparaît avec la formation des cellules folliculaires embryonnaires. Chez le mâle, l’expression du gène Sry est suivie de l’entrée de SOX9 dans le noyau, ce qui déclenche le programme de différenciation mâle. Dans des cellules précurseurs femelles, la leptomycine B (LMB) provoque la rétention de la protéine SOX9 dans le noyau et provoque ainsi l’induction du programme mâle. L’entrée de SOX9 dans le noyau agirait comme un interrupteur déclenchant la voie de différenciation mâle, nécessaire pour prendre le relais du signal induit par SRY, mais également suffisant pour s’y substituer. AMH: anti-mullerian hormone; NES: nuclear export signal; NLS: nuclear localization signal. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




