| Issue |
Med Sci (Paris)
Volume 17, Number 11, Novembre 2001
|
|
|---|---|---|
| Page(s) | 1226 - 1229 | |
| Section | Prix Nobel 2001 | |
| DOI | https://doi.org/10.1051/medsci/200117111226 | |
| Published online | 15 November 2001 | |
Prix nobel de médecine 2001 : Leland H. Hartwell, R. Thimothy Hunt, Paul M. Nurse
Le cycle cellulaire couronné
CRBM-UPR 1086 Cnrs, 1919, route de Mende, 34293 Montpellier, France
Leland H. Hartwell, Américain, est né le 30 octobre 1939 à Los Angeles (Californie, États-Unis). Entré en 1996 au Fred Hutchinson Cancer Research de Seattle (États-Unis), il en est depuis 1997 le Président directeur général et l’administrateur. Membre de l’académie américaine des sciences depuis 1987, il a rejoint en 1968 l’Université de l’État de Washington où il enseigne la génétique depuis 1973. En novembre 2000, il a reçu à Paris le Prix Leopold Griffuel décerné par l’Association française pour la recherche sur le cancer.
R. Timothy Hunt, Britannique, né le 19 février 1943, a obtenu son PhD de biologie à l’Université de Cambridge (Grande-Bretagne), il a ensuite poursuivi ses études post-doctorales à l’École de médecine Albert-Einstein de New York (États-Unis), avant de revenir au département de biochimie de l’Université de Cambridge, puis a rejoint en 1990 l’Imperial Cancer Research Fund, à Londres (Grande-Bretagne) où il exerce encore aujourd’hui. Paul M. Nurse, Britannique, né le 25 janvier 1949, est depuis septembre 1996 le Directeur général de l’Imperial Cancer Research Fund de Londres (Grande-Bretagne). Titulaire d’un PhD de biologie de l’Université d’East Anglia, il a travaillé au département de zoologie de l’Université d’Edinburgh (de 1974 à 1980), à l’École de biologie de l’Université du Sussex (de 1980 à 1987), puis à l’Imperial Cancer Research Fund, non sans être passé par l’Université d’Oxford (de 1987 à 1996). Lauréat du Prix Lasker en 1998, il est membre de l’académie américaine des sciences.
© 2001 médecine/sciences - Inserm / SRMS
Au cours du XIXe siècle, il a été établi que toutes les cellules d’un organisme, quel qu’il soit, proviennent d’autres cellules par le processus de division cellulaire (Omni cellula e cellula). Jusqu’aux années 1970, cytologistes et embryologistes ont décrit les phases de la division cellulaire en détail, mais ils ne purent que spéculer sur les mécanismes contrôlant la progression du cycle cellulaire. A la fin des années 1980, notre conception du cycle cellulaire a été bouleversée par la démonstration que les transitions (par exemple l’entrée en mitose ou l’initiation de la réplication de l’ADN des chromosomes) sont universellement contrôlées par les variations d’activité de protéines kinases spécialisées. Celles-ci sont constituées de deux sous-unités : une sous-unité catalytique appartenant à la famille des CDK (cyclin dependent kinases) et une sous-unité régulatrice, appartenant à la famille des cyclines (figure 1). Les variations d’activité des complexes CDK/cycline sont parfois dépendantes de mécanismes de surveillance (checkpoint) qui empêchent la cellule d’avancer au stade suivant du cycle si un défaut est constaté. Ces mécanismes de checkpoint introduisent ainsi des délais que la cellule utilise pour réparer les défauts avant que le cycle ne progresse à un stade où ils seraient irréversibles. Les cancers résultent souvent d’une dérégulation de ces mécanismes de checkpoint.
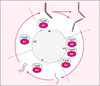 |
Figure 1. Représentation schématique du cycle cellulaire. Le cycle cellulaire est représenté de façon symbolique par une roue qui souligne son caractère périodique. Les deux événements majeurs du cycle, la duplication des chromosomes en chromatides-sœurs qui restent associées au cours de la phase S, et la ségrégation des chromatides-sœurs condensées au cours de la phase M, sont figurés sur le cycle extérieur. Les principaux complexes CDK/cycline qui contrôlent la progression du cycle cellulaire sont indiqués sur le cercle. |
Le prix Nobel 2001 de physiologie et de médecine vient d’être décerné à Leland Hartwell, Tim Hunt et Paul Nurse pour leurs découvertes sur le mécanisme de contrôle du cycle cellulaire. Ces découvertes séminales, réalisées dans les années 1970 et 1980, jouèrent un rôle tout à fait essentiel dans l’émergence de notre conception actuelle du cycle cellulaire. Comme il est indiqué dans le communiqué du comité Nobel, Leland Hartwell est récompensé pour la découverte d’une catégorie de gènes qui commandent le cycle cellulaire, et pour avoir introduit la notion de checkpoint, conduisant à une approche novatrice du cycle cellulaire.
Tim Hunt est récompensé pour la découverte des cyclines et la mise en évidence de leur dégradation lors de la division des cellules, mécanisme qui s’est avéré essentiel pour la régulation du cycle cellulaire.
Enfin, Paul Nurse est crédité pour avoir identifié par des méthodes de génétique et de biologie moléculaire les CDK, et montré que leur fonction dans le contrôle du cycle cellulaire est conservée tout au long de l’évolution. Dans cet article, ces découvertes fondamentales sont brièvement analysées en les replaçant dans leur contexte historique.
Mutants du cycle cellulaire et checkpoints (L.H. Hartwell)
Les mutations qui inactivent les produits de gènes essentiels pour le cycle cellulaire sont naturellement létales.
Les seuls mutants du cycle cellulaire sur lesquels les généticiens puissent travailler sont donc des mutants conditionnels.
Dès les années 1970, Hartwell s’attacha à constituer chez la levure Saccharomyces cerevisiae une collection de mutants thermosensibles chez lesquels le passage d’un stade défini du cycle cellulaire est spécifiquement compromis (mutants cdc, cell division cycle), cette définition excluant donc les mutants de gènes dont les produits contrôlent les processus continus de la croissance et du métabolisme. Hartwell s’attacha à ordonner ces gènes dans le temps et à établir leur relation de causalité. Il détermina pour les différents mutants le point de transition en deçà duquel les cellules sont incapables de se diviser à température restrictive, et audelà duquel elles se divisent, notant que certaines mutations arrêtent la synthèse du produit d’un gène tandis que d’autres compromettent sa fonction, le point de transition ne définissant l’exécution de la fonction que dans ce dernier cas. Il réussit ainsi à ordonner plusieurs dizaines de gènes et à réaliser en particulier une analyse génétique très fine du point start, qui correspond au point de transition du gène cdc28, début du cycle cellulaire chez S. cerevisiae. Sa réflexion sur la logique du cycle l’amena (ainsi que Mitchison chez la levure Schizosaccharomyces pombe) à considérer deux mécanismes possibles pour rendre compte d’une séquence temporelle. Dans le premier, il existe une connexion causale directe entre un événement et le suivant. Dans le second, il n’y a aucune relation causale directe entre les deux événements, mais ils sont ordonnés par l’intermédiaire d’un oscillateur central : dans ce dernier modèle, il n’est pas nécessaire que le premier événement soit achevé pour que le suivant ait lieu, bien que cet ordre soit normalement respecté en raison de l’activité de l’oscillateur central (figure 2). Cette dernière conception [1] s’est avérée particulièrement fructueuse dans l’évolution des idées sur le cycle cellulaire.
Enfin, Hartwell montra l’existence de mécanismes de surveillance qui arrêtent la progression du cycle cellulaire quand des événements tels que des dommages causés au génome ou au fuseau de division sont constatés. Il proposa une définition opérationnelle de ces mécanismes de surveillance appelés checkpoints : si la réalisation d’un événement B est dépendante de l’achèvement d’un événement A antérieur, cette dépendance est due à un checkpoint s’il peut être trouvé une mutation perte de fonction qui fait disparaître cette dépendance [2]. L’analyse des mécanismes de checkpoint reste un objectif majeur des recherches actuelles sur le cycle cellulaire.
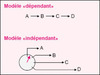 |
Figure 2. Deux modèles rendant compte de Yordre temporel des événements du cycle cellulaire. |
Les cyclines (R.T. Hunt)
Pour la plupart des cellules, la croissance est superposée au cycle cellulaire, la règle étant qu’une cellule doit doubler de taille avant de se diviser. Il n’est pas aisé de faire la distinction entre les facteurs qui contrôlent la croissance cellulaire et ceux qui contrôlent la progression et les transitions du cycle cellulaire, surtout dans les espèces dans lesquelles l’approche génétique n’est pas possible.
Après la fécondation, les premiers cycles embryonnaires se font en l’absence de croissance. Cela pourrait laisser supposer que ces phases du développement peuvent avoir lieu en l’absence de synthèse protéique. Or, il n’en est rien : il n’est pas possible d’enchaîner deux cycles cellulaires successifs en l’absence de synthèse protéique, et dans ce cas l’arrêt se produit avant la mitose.
Ce paradoxe intrigua Tim Hunt, biologiste moléculaire spécialiste du contrôle de la synthèse protéique, qui décida de réaliser une analyse détaillée de la cinétique de traduction de l’ensemble des protéines au cours des deux premiers cycles mitotiques parfaitement synchrones qui suivent la fécondation des œufs de deux invertébrés marins, l’oursin et la palourde.
Cela le conduisit à identifier deux protéines qu’il appela cyclines (A et B) en raison de leur loi d’accumulation en dents de scie au cours des cycles cellulaires successifs (figure 3) [3]. Il montra que ces protéines sont détruites par protéolyse à un moment précis de la mitose (transition metaphase/anaphase pour la cycline B) et identifia chez les vertébrés les homologues de ces cyclines mitotiques.
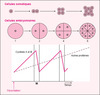 |
Figure 3. Mise en évidence des cyclines au cours du développement embryonnaire précoce. Alors que les cellules somatiques doublent leur taille entre deux divisions successives, les cellules de l’embryon subissent au cours du développement précoce une série de divisions sans croissance. L’analyse des protéines radiomarquées au cours des premiers cycles cellulaires qui suivent la fécondation montre l’existence de deux protéines (cyclines A et B) dont l’accumulation en fonction du temps suit une loi en dents de scie, alors que le radiomarquage des autres protéines croît linéairement avec le temps. |
Des extraits concentrés d’ovocytes mûrs activés parthénogénétiquement «cyclent» in vitro, en ce sens qu’ils sont capables d’effectuer en alternance la réplication de l’ADN et la plupart des événements de la mitose. Utilisant de tels extraits, Hunt montra que la destruction des deux ARN messagers codant pour les cyclines B1 et B2 par des oligonucléotides antisens bloque l’entrée en mitose, alors que l’entrée en mitose n’est pas supprimée si l’un ou l’autre de ces deux ARN messagers est laissé intact [4], des résultats équivalents étant d’ailleurs obtenus parallèlement par Murray et Kirschner sur de tels extraits. Ces derniers auteurs montraient également que la dégradation périodique des cyclines B découvertes par Hunt était nécessaire à la sortie de mitose [5, 6].
Cdc2 et son rôle universel dans le contrôle du cycle cellulaire (P.M. Nurse)
Comme son aîné Hartwell, Nurse développa une approche génétique du cycle cellulaire, mais chez la levure Schizosacharomyces pombe. Dans cette espèce, contrairement à celle étudiée par Hartwell, l’essentiel de la croissance a lieu pendant la phase G2. Cette circonstance favorable lui permit de rassembler une collection de mutants thermosensibles, certains incapables d’entrer en mitose et s’arrêtant donc en G2 (mutants cdc), d’autres au contraire entrant prématurément (à taille réduite : mutants wee) en mitose. Il montra que les allèles du gène cdc2 (homologue du gène cdc28 de S. cerevisiae) sont associés à l’un ou à l’autre de ces phénotypes, que le produit de ce gène est le lieu d’intégration de voies contrôlant négativement ou positivement la transition G2/M et que ce gène conservé au cours de l’évolution et interchangeable avec son homologue humain code pour une protéine kinase effectivement active dans les cellules en mitose [7].
Parallèlement à ce travail, d’autres groupes s’efforçaient de caractériser par une approche biochimique un facteur dominant présent dans les cellules en phase M et suffisant pour provoquer par micro-injection l’entrée en phase M d’ovocytes naturellement arrêtés en phase G2 du cycle cellulaire. La découverte de ce facteur (MPF : maturation promoting factor) valut d’ailleurs à son auteur Yoshio Masui le prix Lasker, qu’il partagea (en 1998) avec Hartwell et Nurse [8]. Plusieurs groupes, dont certains en collaboration avec Paul Nurse, réussiront à montrer en 1988 que les homologues de cdc2 chez les vertébrés et les invertébrés sont des constituants essentiels de MPF (figure 4).
 |
Figure 4. Les deux stratégies ayant conduit à l’identification de la protéine kinase cdc2 comme constituant essentiel et universel de l’oscillateur central contrôlant l’entrée en phase M (mitose ou méiose) du cycle cellulaire. Agauche, de haut en bas, sont indiquées les tailles standard que doit avoir atteint (au cours de la phase G2) la cellule-mère de la levure Schizosacharomyces pombe pour entrer en mitose chez la forme sauvage (WT, wild-type), un mutant cdc ou un mutant wee. A droite est décrit le test d’activité MPF dans des ovocytes en cours de maturation méiotique : si du cytoplasme est prélevé dans un tel ovocyte libéré du bloc G2 (par exemple par stimulation hormonale) et transféré dans un ovocyte arrêté en G2, le receveur sort de l’arrêt G2 et entre lui-même en phase M du cycle cellulaire. |
De cdc2 à CDK1
L’approche de reconstitution du cycle cellulaire dans des extraits dœceufs de xénopes suggéraient fortement que les cyclines mitotiques de Hunt étaient des activateurs de MPF. Par ailleurs, cdc2 était un constituant de MPF. Restait à comprendre comment les cyclines activent cdc2. A l’époque, on ne connaissait pas de protéine kinase activée par une sous-unité régulatrice. En 1989, néanmoins, il fut possible d’établir, au terme d’une purification à homogénéité de cette protéine kinase, que le MPF d’ovocyte d’étoile de mer est un hétérodimère constitué d’une molécule de Cdc2 et d’une molécule de cycline B [9], résultat retrouvé plus tard sur d’autres sources de MPF. Cdc2 devenait la première kinase activée par une cycline, et le sigle CDK fut adopté en 1991 lors du colloque de Cold Spring Harbor dédié au cycle cellulaire pour désigner les kinases homologues de cdc2 ayant pour sous-unité régulatrice une cycline. Cette famille compte maintenant 9 membres, en majorité impliqués dans le contrôle du cycle cellulaire.
En résumé, le comité Nobel reconnaît cette année que la découverte du rôle central joué par les complexes CDK/cyclines dans la régulation du cycle cellulaire a constitué l’une des avancées majeures des dernières décennies dans le domaine de la biologie. Au terme d’une large consultation des scientifiques, il couronne trois chercheurs prestigieux, dont les travaux vont de la génétique de la levure à une approche originale s’appuyant sur les modèles marins et la reconstitution in vitro des événements du cycle cellulaire. Situées dans le domaine fondamental de la recherche, les découvertes séminales des trois lauréats ont sans nul doute jeté les bases de notre conception actuelle du cycle cellulaire, dont dériveront dans le domaine de la médecine les applications thérapeutiques de demain
Références
- Hartwell LH, Culotti J, Pringle JR, Reid BJ. Genetic cotrol of the cell division cycle in yeast. Science 1974; 183 : 46–51. [Google Scholar]
- Hartwell LH, Weinert TA. Checkpoints : controls that ensure the order of cell cycle events. Science 1989 ; 246 : 629–34. [Google Scholar]
- Evans R, Rosenthal EY, YoungblomJ, Distel D, Hunt T. Cyclin ; a protein specified by maternal mRNA in sea urchin eggs that is destroyed at each cleavage division. Cell 1983; 33 : 389–96. [Google Scholar]
- Minshull J, Blow JJ, Hunt T. Translation of cyclin mRNA is necessary for extracts of activated Xenopus eggs to enter mitosis. Cell 1989; 56 : 947–56. [Google Scholar]
- Murray AW, Kirschner MW. Cyclin drives the early embryonic cell cycle. Nature 1989; 339 : 275–80. [Google Scholar]
- Murray AW, Kirschner MW. The role of cyclin synthesis and degradation in the control of maturation promoting factor activity. Nature 1989; 339 : 280–6. [Google Scholar]
- Nurse P. Universal control mechanisms regulating onset of M-phase. Nature 1990; 344 : 503–8. [Google Scholar]
- Masui Y. Learning from the history of cellcycle research. Nat Med 1998; 4 : 1104–5. [Google Scholar]
- Labbé JC, Capony JP, Caput D, et al. MPF from starfish oocytes at first meiotic metaphase is a heterodimer comprising one molecule of cdc2 and one molecule of cyclin B. EMBO J 1989; 8 : 3053–8. [Google Scholar]
Liste des figures
 |
Figure 1. Représentation schématique du cycle cellulaire. Le cycle cellulaire est représenté de façon symbolique par une roue qui souligne son caractère périodique. Les deux événements majeurs du cycle, la duplication des chromosomes en chromatides-sœurs qui restent associées au cours de la phase S, et la ségrégation des chromatides-sœurs condensées au cours de la phase M, sont figurés sur le cycle extérieur. Les principaux complexes CDK/cycline qui contrôlent la progression du cycle cellulaire sont indiqués sur le cercle. |
| Dans le texte | |
 |
Figure 2. Deux modèles rendant compte de Yordre temporel des événements du cycle cellulaire. |
| Dans le texte | |
 |
Figure 3. Mise en évidence des cyclines au cours du développement embryonnaire précoce. Alors que les cellules somatiques doublent leur taille entre deux divisions successives, les cellules de l’embryon subissent au cours du développement précoce une série de divisions sans croissance. L’analyse des protéines radiomarquées au cours des premiers cycles cellulaires qui suivent la fécondation montre l’existence de deux protéines (cyclines A et B) dont l’accumulation en fonction du temps suit une loi en dents de scie, alors que le radiomarquage des autres protéines croît linéairement avec le temps. |
| Dans le texte | |
 |
Figure 4. Les deux stratégies ayant conduit à l’identification de la protéine kinase cdc2 comme constituant essentiel et universel de l’oscillateur central contrôlant l’entrée en phase M (mitose ou méiose) du cycle cellulaire. Agauche, de haut en bas, sont indiquées les tailles standard que doit avoir atteint (au cours de la phase G2) la cellule-mère de la levure Schizosacharomyces pombe pour entrer en mitose chez la forme sauvage (WT, wild-type), un mutant cdc ou un mutant wee. A droite est décrit le test d’activité MPF dans des ovocytes en cours de maturation méiotique : si du cytoplasme est prélevé dans un tel ovocyte libéré du bloc G2 (par exemple par stimulation hormonale) et transféré dans un ovocyte arrêté en G2, le receveur sort de l’arrêt G2 et entre lui-même en phase M du cycle cellulaire. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




