| Numéro |
Med Sci (Paris)
Volume 41, Numéro 6-7, Juin-Juillet 2025
|
|
|---|---|---|
| Page(s) | 558 - 560 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2025093 | |
| Publié en ligne | 7 juillet 2025 | |
La cavéoline-1 rigidifie la membrane plasmique et limite l’expansion de tunnels transcellulaires
Caveolin-1 stiffens the plasma membrane and limits transcellular tunnel expansion
1
Unité des toxines bactériennes, Département de microbiologie, Institut Pasteur, Université Paris Cité, CNRS UMR6047, Inserm U1306, Paris, France
2
CNRS UMR7592, Institut Jacques Monod, Université Paris Cité, Paris, France
3
Physique des cellules et cancer, CNRS UMR168, Institut Curie, Université Paris Sciences et Lettres, Paris, France
Les exoenzymes de la famille EDIN (epidermal cell differentiation inhibitors), que sécrètent certaines souches de Staphylococcus aureus, provoquent l’ouverture de tunnels transcellulaires, de plusieurs micromètres de diamètre, dans les revêtements endothéliaux de la paroi des vaisseaux (Figure 1). Ces toxines sont des mono-ADP-ribosyltransférases, qui pénètrent dans le cytoplasme des cellules hôtes pour inhiber la petite GTPase RhoA [1]. L’ouverture des tunnels à travers les cellules endothéliales est associée à une perte de la fonction de barrière de l’endothélium, qui se manifeste par des fuites vasculaires et une translocation accrue de S. aureus entre le compartiment sanguin et les tissus [1]. Des régulateurs cellulaires clés de la dynamique de ces tunnels transcellulaires, notamment l’ezrine et la protéine à domaine inverse-BAR MIM (missing in metastasis), ont précédemment été identifiés [1, 2]. Les résultats d’une nouvelle étude établissent que la cavéoline-1, une protéine en forme d’épingle à cheveux enchâssée dans la bicouche lipidique, contrôle la rigidité de courbure de la membrane plasmique, et influe ainsi sur le diamètre des tunnels transcellulaires endothéliaux [3].
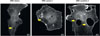 |
Figure 1 La cavéoline-1 contrôle le nombre et le diamètre des tunnels transcellulaires endothéliaux. Image de tunnels transcellulaires (flèches jaunes) se formant après inhibition de la GTPase RhoA au sein de cellules endothéliales intoxinées. Les cellules expriment la protéine fluorescente GFP-LifeAct, qui marque l’actine filamentaire (signal blanc). De gauche à droite : cellules transfectées avec des ARN interférents (ARNi) témoins ou ciblant la cavine-1 ou la cavéoline-1. Barre d’échelle = 10 µm. Figure adaptée de [3]. |
Dépléter la cavéoline-1 augmente le nombre et la largeur des tunnels transcellulaires endothéliaux
Les cavéoles sont des nanoinvaginations de la membrane plasmique, dont le diamètre est compris entre 60 et 90 nm [4]. Elles sont particulièrement nombreuses dans les cellules exposées à d’importantes contraintes mécaniques d’étirement, telles que les cellules endothéliales. En réponse à une augmentation soudaine de la tension membranaire, les cavéoles se déplient immédiatement pour libérer un réservoir de membrane plasmique et limiter ainsi les déchirements membranaires susceptibles de provoquer la mort cellulaire [5]. Les cavéoles se forment au feuillet interne de la bicouche lipidique à partir de l’assemblage de disques composés de 11 monomères de cavéoline. La formation des cavéoles résulte de l’effet combiné de l’association de molécules de cavine-1 aux disques de cavéoline-1 et d’un enrichissement membranaire local en cholestérol et sphingolipides, qui sont des lipides connus pour influer sur la rigidité membranaire [6].
Les tunnels transcellulaires endothéliaux sont des structures dynamiques transitoires à travers les cellules endothéliales intoxinées [1]. L’étape de nucléation de ces tunnels repose sur l’apposition des membranes basale et apicale [7]. Elle est facilitée par un désassemblage du cytosquelette d’actomyosine, dont l’organisation dépend notamment de la GTPase RhoA, et par la diminution de l’épaisseur cellulaire en réponse à l’étalement de la cellule (Figure 2). L’analyse fine et complète du réseau formé par les filaments d’actine dans les cellules endothéliales intoxinées, par microscopie superrésolutive 2D (microscopie à reconstruction optique stochastique, STORM), a révélé l’existence d’un réseau lâche et peu structuré, et l’apparition de larges zones dépourvues de ces filaments d’actine. Par ailleurs, l’observation, par microscopie électronique à transmission, de la face interne de la membrane plasmique de cellules intoxinées a mis en évidence une diminution de la densité des cavéoles. Une telle diminution est cohérente avec l’augmentation de la tension membranaire attendue en réponse à l’étalement des cellules endothéliales qu’induit l’inhibition de la GTPase RhoA par cette famille de toxines. Les différents rôles de la cavéoline-1 dans la formation des tunnels transcellulaires endothéliaux, qu’ils soient dépendants ou indépendants de la structuration des cavéoles, ont été déterminés grâce à une analyse comparée des effets d’une déplétion en cavéoline-1 ou en cavine-1. L’épaisseur cellulaire moyenne, c’est-à-dire le rapport entre le volume et la surface d’adhérence des cellules à la matrice, et la nucléation des tunnels transcellulaires endothéliaux sont contrôlées par la structuration de cavéoles (dépendant de la cavine-1 et de la cavéoline-1), alors que l’élargissement de ces tunnels est uniquement sous contrôle de la cavéoline-1. Ainsi, un défaut d’expression de la cavéoline-1 conduit à une augmentation de la densité et de la largeur des tunnels transcellulaires endothéliaux (Figure 1).
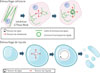 |
Figure 2 Principes du démouillage de liquides visqueux et du démouillage cellulaire. En haut : démouillage cellulaire. De gauche à droite : une cellule endothéliale intoxinée perd ses câbles d’actomyosine et s’étale, entraînant ainsi une diminution de l’épaisseur cellulaire avec ouverture d’un tunnel transcellulaire endothélial, puis son élargissement. La nucléation et l’ouverture des tunnels transcellulaires endothéliaux sont induites par l’augmentation de la tension membranaire (flèches rouges) et limitées par la tension de ligne (flèches noires). Un câble d’actomyosine encercle progressivement ces tunnels (cercle vert) pour bloquer leur élargissement. En bas : démouillage d’un liquide visqueux. Le démouillage de liquide correspond à la rupture d’un film visqueux étiré sur une surface non mouillable jusqu’à la formation de gouttelettes. Figure réalisée avec BioRender. |
La cavéoline-1 contrôle la rigidité de la membrane plasmique
Les mécanismes qui sous-tendent l’effet de la cavéoline-1 sur l’expansion des tunnels transcellulaires endothéliaux ont pu être établis grâce à une approche combinant une mesure de la vitesse d’ouverture de ces tunnels et une modélisation biophysique. La durée de la phase d’élargissement des tunnels transcellulaires endothéliaux est constante : elle correspond au temps nécessaire à la construction d’un câble d’actomyosine ceinturant les tunnels, de rigidité suffisante pour contrebalancer la tension membranaire qui gouverne leur élargissement [8] (Figure 2). Ainsi, le diamètre maximal atteint par les tunnels transcellulaires endothéliaux est fonction de leur vitesse d’expansion. La perte de la cavéoline-1 dans les cellules intoxinées, contrairement à celle de la cavine-1, induit un doublement de la vitesse d’expansion des tunnels transcellulaires, ce qui est responsable de l’augmentation de leur diamètre (Figure 1). Il existe une analogie remarquable entre le phénomène de nucléation et d’ouverture des tunnels transcellulaires endothéliaux et le phénomène physique de « démouillage de liquides visqueux », que l’on rencontre fréquemment dans la vie courante [9] (Figure 2). Dans ce phénomène physique, un liquide visqueux étalé sur une surface non-mouillante (par exemple la pâte à crêpe étalée sur une poêle non-adhésive) forme des zones sèches par rétraction du liquide au sein du film. Le concept de « démouillage cellulaire » postule ainsi que l’augmentation de l’étalement cellulaire induit une tension membranaire capable de nucléer des tunnels transcellulaires endothéliaux. Dans ce modèle, la tension membranaire est contrebalancée par la tension de ligne au bord de ces tunnels, une force qui rend compte de la résistance intrinsèque de la membrane à se courber. Contrairement au phénomène physique de démouillage, qui se poursuit jusqu’à la formation de gouttelettes, la construction du câble d’actomyosine autour des tunnels transcellulaires permet de stopper leur expansion [8] (Figure 2). Le modèle de démouillage cellulaire offre la possibilité, connaissant la densité de tunnels transcellulaires et leur vitesse d’expansion dans différentes conditions expérimentales, de calculer les variations de tension et de rigidité membranaires correspondantes. Dans cette étude, le modèle prédit que l’absence de structuration des cavéoles (par déplétion en cavine-1 en utilisant l’interférence ARN) se traduit par une réduction modeste de la rigidité membranaire de 15 %, alors que la perte d’expression de la cavéoline-1 entraîne une réduction beaucoup plus marquée de la rigidité membranaire, d’environ 55 %. L’hypothèse d’un rôle majeur de la cavéoline-1 dans le contrôle de la rigidité membranaire a pu être confirmée par une mesure physique réalisée sur des liposomes géants produits à partir des cellules étudiées (« sphères de membrane plasmique »). En effet, la valeur de la rigidité membranaire peut être déduite de la mesure de la force nécessaire pour étirer un nanotube de membrane à partir d’un tel liposome, dont la tension de membrane est imposée. Ainsi, on mesure une rigidité membranaire relativement constante entre les cellules témoins et celles qui sont dépourvues de cavéoles (par déplétion en cavine-1). En revanche, l’absence de cavéoline-1 entraîne une diminution de 30 % de la rigidité membranaire, en accord avec les prédictions du modèle théorique.
La cavéoline-1 protège les souris contre l’effet létal de la toxine EDIN-B dans un modèle de bactériémie staphylococcique
Les bactériémies à S. aureus restent fréquentes, avec un impact souvent sévère sur la mortalité des patients. La lignée ST80 SARM-AC de ce staphylocoque est particulièrement répandue en Europe, et le gène codant la toxine EDIN-B est présent dans un petit nombre de souches. L’impact de l’EDIN-B a été évalué dans un modèle de bactériémie chez des souris déficientes pour le gène codant la cavéoline-1 (souris Cav1-/-) et leurs congénères de génotype « sauvage » (Cav1+/+) issues des mêmes portées. Les animaux Cav1-/- présentent une sensibilité accrue à la bactériémie causée par S. aureus produisant EDIN-B, que nous relions à l’activité enzymatique de cette toxine.
Perspectives
Ces travaux de recherche ont mis en lumière le rôle protecteur de la cavéoline-1 dans un processus infectieux, en lien avec une activité mécanorégulatrice de la rigidité membranaire. D’autres études seront nécessaires pour déterminer si ce contrôle de la rigidité membranaire par la cavéoline-1 résulte de ses propriétés intrinsèques d’insertion dans la membrane, ou s’il découle d’une fonction de tri des lipides depuis le réticulum endoplasmique vers la membrane plasmique.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Lemichez E, Gonzalez-Rodriguez D, Bassereau P, Brochard-Wyart F. Transcellular tunnel dynamics: Control of cellular dewetting by actomyosin contractility and I-BAR proteins. Biol Cell 2012 ; 105 : 109–17. [Google Scholar]
- Charles-Orszag A, Lemichez E, Tran Van Nhieu G, Duménil G. Microbial pathogenesis meets biomechanics. Curr Opin Cell Biol 2016 ; 38 : 31–7. [CrossRef] [Google Scholar]
- Morel C, Lemerle E, Tsai FC, et al. Caveolin-1 protects endothelial cells from extensive expansion of transcellular tunnel by stiffening the plasma membrane 2024 ; eLife 12 : RP92078. [CrossRef] [Google Scholar]
- Lamaze C, Tardif N, Dewulf M, et al. The caveolae dress code: structure and signaling. Curr Opin Cell Biol 2017 ; 47 : 117–25. [CrossRef] [Google Scholar]
- Sinha B, Köster D, Ruez R, et al. Cells respond to mechanical stress by rapid disassembly of caveolae. Cell 2011 ; 144 : 402–13. [CrossRef] [Google Scholar]
- Rawicz W, Smith BA, McIntosh TJ, et al. Elasticity, strength, and water permeability of bilayers that contain raft microdomain-forming lipids. Biophys J 2008 ; 94 : 4725–36. [CrossRef] [Google Scholar]
- Ng WP, Webster KD, Stefani C, et al. Force-induced transcellular tunnel formation in endothelial cells. Mol Biol Cell 2017 ; 28 : 2650–60. [CrossRef] [PubMed] [Google Scholar]
- Stefani C, Gonzalez-Rodriguez D, Senju Y, et al. Ezrin enhances line tension along transcellular tunnel edges via NMIIa driven actomyosin cable formation. Nat Commun 2017 ; 8 : 15839. [CrossRef] [PubMed] [Google Scholar]
- Gonzalez-Rodriguez D, Maddugoda MP, Stefani C, et al. Cellular dewetting: opening of macroapertures in endothelial cells. Phys Rev Lett 2012 ; 108 : 218105. [NASA ADS] [CrossRef] [PubMed] [Google Scholar]
© 2025 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1 La cavéoline-1 contrôle le nombre et le diamètre des tunnels transcellulaires endothéliaux. Image de tunnels transcellulaires (flèches jaunes) se formant après inhibition de la GTPase RhoA au sein de cellules endothéliales intoxinées. Les cellules expriment la protéine fluorescente GFP-LifeAct, qui marque l’actine filamentaire (signal blanc). De gauche à droite : cellules transfectées avec des ARN interférents (ARNi) témoins ou ciblant la cavine-1 ou la cavéoline-1. Barre d’échelle = 10 µm. Figure adaptée de [3]. |
| Dans le texte | |
 |
Figure 2 Principes du démouillage de liquides visqueux et du démouillage cellulaire. En haut : démouillage cellulaire. De gauche à droite : une cellule endothéliale intoxinée perd ses câbles d’actomyosine et s’étale, entraînant ainsi une diminution de l’épaisseur cellulaire avec ouverture d’un tunnel transcellulaire endothélial, puis son élargissement. La nucléation et l’ouverture des tunnels transcellulaires endothéliaux sont induites par l’augmentation de la tension membranaire (flèches rouges) et limitées par la tension de ligne (flèches noires). Un câble d’actomyosine encercle progressivement ces tunnels (cercle vert) pour bloquer leur élargissement. En bas : démouillage d’un liquide visqueux. Le démouillage de liquide correspond à la rupture d’un film visqueux étiré sur une surface non mouillable jusqu’à la formation de gouttelettes. Figure réalisée avec BioRender. |
| Dans le texte | |
Les statistiques affichées correspondent au cumul d'une part des vues des résumés de l'article et d'autre part des vues et téléchargements de l'article plein-texte (PDF, Full-HTML, ePub... selon les formats disponibles) sur la platefome Vision4Press.
Les statistiques sont disponibles avec un délai de 48 à 96 heures et sont mises à jour quotidiennement en semaine.
Le chargement des statistiques peut être long.




