| Issue |
Med Sci (Paris)
Volume 30, Number 6-7, Juin–Juillet 2014
|
|
|---|---|---|
| Page(s) | 637 - 643 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/20143006013 | |
| Published online | 11 July 2014 | |
Le colliculus supérieur
Centre sous-cortical de la sélection visuelle
Superior colliculus as a subcortical center for visual selection
1
Institut de neurosciences, Université Catholique de Louvain, 1200
Bruxelles, Belgique
2
Systems neurobiology laboratory, Salk institute for biological studies, 10010 North Torrey Pines road, La Jolla, California
92037, États-Unis
3
Laboratory of sensorimotor research, National eye institute, Bethesda, Maryland
20892, États-Unis
*
alexandre.zenon@uclouvain.be
Notre système visuel dispose d’une capacité limitée de traitement de l’information et, pour être efficace, il doit donc allouer ses ressources en priorité aux éléments les plus importants de l’environnement. Les principaux centres nerveux qui contrôlent ce mécanisme d’allocation, appelé attention visuelle, ont été localisés au sein du cortex cérébral. Dans cette revue, nous décrivons l’existence d’un autre centre de contrôle attentionnel, situé au sein du tronc cérébral, à savoir le colliculus supérieur (CS). Celui-ci exercerait son influence sur les processus de sélection visuelle en court-circuitant le cortex visuel. La nature exacte des circuits impliqués reste inconnue, mais il est probable que la boucle que forme le CS avec les noyaux gris centraux représente un acteur majeur.
Abstract
Our visual system has limited resources, which need to be allocated in priority to the most relevant elements of the environment. The brain centers of this allocation mechanism, called visual attention, have been studied primarily in cortex. In this review, we describe the role of the superior colliculus, a structure of the brainstem, in attention control. This nucleus exerts its influence on visual selection independently of cortical attentional mechanisms. The exact nature of the subcortical circuits involved remains unknown but it can be hypothesized that the loop connecting the superior colliculus to the basal ganglia are a central actor of this subcortical selection process.
© 2014 médecine/sciences – Inserm
Attention visuelle, manifeste et non manifeste
« Je demandai à Janet de copier un simple dessin composé, de droite à gauche, d’un arbre, une maison, une barrière et d’un autre arbre. Elle copia avec application – bien qu’assez grossièrement – l’arbre à droite, puis la maison avant de poser son crayon, affirmant qu’elle avait fini. Je pointai chaque élément du dessin original et lui demandai de me les nommer. Elle le fit correctement. Je lui demandai alors si elle voulait bien dessiner la barrière.
“Je veux bien si vous le voulez vraiment mais elle va sans doute être renversée au prochain vent !”, répondit-elle, dessinant approximativement la barrière.
“Maintenant copiez le reste de la scène”, demandai-je.
“C’est vraiment tout ce que je peux dessiner”, répondit-elle.
Je pointai l’arbre à gauche.
“Cet arbre? Je ne sais pas dessiner les arbres.”, m’informa-t-elle, et je ne pus la convaincre de le dessiner. »
Cet extrait du livre de Jenni Ogden « Trouble in mind: Stories from a neuropsychologist’s casebook » décrit un exemple frappant de cas d’héminégligence (Figure 1) [1]. Ces cas d’héminégligence surviennent le plus souvent au décours d’une lésion du cortex pariétal droit ; les patients se mettent à ignorer toute la partie gauche de leur environnement. Si un objet bien visible est présenté seul dans leur champ visuel gauche, ces patients sont généralement capables de le voir. Mais si d’autres objets sont présentés en même temps à droite, ils cessent de le percevoir.
 |
Figure 1. Exemple de dessin produit par un patient héminégligent. Il est demandé au patient de dessiner le cadrant d’une horloge avec tous les chiffres et de représenter les aiguilles indiquant 11h10. Dans cet exemple, le patient a placé tous les chiffres du côté droit de l’horloge (© Cécile Prairial). |
Ce déficit marquant met en évidence le rôle crucial d’un aspect de notre vision qui passe d’ordinaire inaperçu : l’attention visuelle (ou sélection, ou orientation visuelle). En fait, nous avons tendance à imaginer que notre système visuel fonctionne comme une caméra, enregistrant en détails tout ce qui se passe autour de nous. En réalité, si notre système visuel devait être comparé à une caméra, 99 % de l’image qu’elle enregistre seraient flous. En effet, en raison notamment de l’inhomogénéité de la densité des photorécepteurs de la rétine, nous percevons de façon nette seulement la partie centrale de notre champ visuel, qui s’étend sur quelques degrés d’angle (un degré correspond plus ou moins à la largeur d’un doigt porté à bout de bras) [2]. Pour compenser cette limitation, nous réalisons en permanence des mouvements des yeux qui permettent de placer les éléments importants de notre environnement à l’intérieur de cette portion nette du champ visuel. On appelle ce processus l’attention manifeste (overt attention). On comprend donc que notre système visuel doit faire preuve d’ingéniosité pour parvenir à construire une image qui soit « en apparence » complète, nette et stable alors qu’elle est en réalité partielle, floue et en mouvement constant. On comprend également à quel point les mécanismes qui décident où l’attention manifeste doit se porter sont un élément absolument fondamental de notre vision.
Par ailleurs, il semble que l’inhomogénéité de la résolution spatiale de la rétine ne soit pas le seul élément qui limite la qualité de notre vision. En effet, même sans déplacer les yeux, nous pouvons allouer des ressources visuelles à certains éléments de notre environnement plutôt qu’à d’autres. Ce processus s’appelle l’attention non manifeste (covert attention). Par exemple, nous pouvons maintenir notre regard sur la route devant nous tout en « déplaçant notre attention » sur un autre véhicule qui nous dépasse. Dans ce cas, nous pourrons identifier avec plus de précision la nature et la vitesse du véhicule, mais nous serons moins à même de remarquer d’autres faits susceptibles de survenir ailleurs sur la route. Cela signifie qu’au-delà de la résolution spatiale de la rétine, certaines ressources cérébrales sont disponibles en quantité limitée et qu’il existe des processus au sein du cerveau qui permettent de contrôler où ces ressources doivent être allouées [3].
Rôle du cortex dans l’attention visuelle
Les déficits d’orientation de l’attention qui font suite, comme exposé ci-dessus, à une lésion du cortex pariétal postérieur, mais aussi de certaines parties du cortex préfrontal ou même temporal, et plus particulièrement du côté droit du cerveau [4], ont permis de suggérer depuis longtemps le rôle de certaines zones cérébrales dans le contrôle attentionnel. Depuis les premières descriptions du syndrome d’héminégligence, un nombre important d’études ont été réalisées chez l’animal. Ces études basées, soit sur l’enregistrement de l’activité de neurones isolés, soit sur la microstimulation électrique, soit sur des techniques pharmacologiques permettant d’inactiver transitoirement les neurones, ont permis de déterminer plus précisément quelles structures cérébrales sont impliquées dans le contrôle des déplacements attentionnels. Une série de structures ont été identifiées au sein du cortex frontal (notamment les champs oculomoteurs frontaux [FEF]) et pariétal (plus particulièrement, l’aire intrapariétale latérale [LIP]), comme étant impliquées à la fois dans le contrôle des mouvements des yeux et dans les déplacements attentionnels non manifestes [5, 6]. Cela suggère que ces deux fonctions dépendent en réalité de mécanismes communs [7–9], bien que cette théorie reste encore l’objet de débats [10, 11].
Ces structures corticales ont été considérées longtemps comme les centres de contrôle de l’attention les plus importants. Aujourd’hui encore, une large majorité des travaux en neurobiologie de l’attention portent sur ces régions. Pourtant, déjà dans les années 1960, James Sprague et ses collaborateurs avaient montré qu’une lésion d’une structure du tronc cérébral appelée colliculus supérieur (CS, Encadré 1 ) entraînait un déficit d’orientation du regard chez le chat, similaire au syndrome d’héminégligence observé chez les patients [12], à ceci près qu’au contraire des cas humains, latéralisés à droite, il n’y a pas d’asymétrie hémisphérique chez l’animal. Le CS était alors considéré comme une structure motrice dont le rôle était de relayer la commande d’exécution des mouvements oculaires ; mais les travaux de James Sprague suggérèrent alors que son rôle ne pouvait pas se limiter à cela.
Le colliculus supérieur
Le colliculus superieur (CS) est une structure situee dans la partie dorsale du mesencephale qui correspond a la partie rostrale du tronc cerebral. Cette structure est organisee en couches paralleles de substance grise (les couches superficielle, intermediaire et profonde) separees par des couches de substance blanche. Le CS est extremement bien conserve dans la phylogenie, puisqu’on peut trouver une structure equivalente chez tous les vertebres, de la lamproie a l’humain. Il est surtout connu pour son role dans l’execution des mouvements oculaires. En effet, une stimulation electrique de faible intensite, surtout au niveau des couches intermediaire et profonde, induit une saccade dont la direction et l’amplitude dependent de la zone stimulee au sein du CS, de sorte que dans chaque couche du CS on peut retrouver une carte topographique assez precise de l’espace visuel [33]. Juste avant la realisation d’une saccade, l’activite des neurones dans la region du CS qui correspond a la zone vers laquelle le regard va etre dirige, est stimulee specifiquement [34]. Ces neurones sont connectes aux noyaux du tronc et de la moelle epiniere, qui contiennent les neurones commandant directement les muscles des yeux et de la nuque, permettant l’orientation du regard [35–37].
James Sprague conduisit ensuite une série d’expériences dans lesquelles il réalisa une lésion d’une partie du cortex visuel, entraînant également un déficit d’orientation visuelle contralatéral ; puis il ajouta une seconde lésion au niveau du CS opposé à la lésion corticale [13]. De façon très étonnante, il observa que, suite à cette double lésion, l’animal redevenait capable d’orienter son regard vers la nourriture qui lui était présentée dans l’hémichamp visuel préalablement déficient. Une série d’études plus récentes ont permis de mieux préciser les circuits impliqués dans ce mécanisme de « compensation » de l’orientation visuelle. En réalité, il semble que quelle que soit la lésion pratiquée au niveau sous-cortical (le CS, la substance noire réticulée ou la commissure entre les deux colliculus supérieurs), la conséquence réellement déterminante, qui permet la restauration de l’orientation visuelle, est la désinhibition du colliculus supérieur du côté de la lésion corticale [14]. Cet effet, aujourd’hui classiquement appelé « effet Sprague », montrait donc que les mécanismes d’orientation visuelle ne sont pas exclusivement corticaux.
Curieusement, le rôle potentiel du CS dans le contrôle attentionnel a été largement négligé pendant plusieurs décennies au profit de l’étude des structures corticales mentionnées plus haut. Ce n’est que plus récemment que plusieurs travaux chez le singe ont renouvelé l’intérêt pour cette structure sous-corticale. Ceux-ci ont montré, notamment, que même en l’absence totale de mouvement oculaire, l’activité des neurones enregistrés dans le CS participait de façon importante à la localisation de l’attention dans l’espace [9, 15]. Dans une étude datant de 2010, une inactivation transitoire du CS était réalisée chez le singe au moyen de l’injection d’une toute petite quantité de muscimol, un agoniste GABA (acide γ-aminobutyrique)-ergique qui induit une inhibition des neurones situés à proximité immédiate de l’injection [16]. Ces inactivations affectent la réalisation des mouvements oculaires, de sorte que la latence des saccades et leur vitesse sont profondément réduites. Ces effets restent limités à la portion de l’espace visuel qui correspond à la partie inactivée de la carte topographique au sein du CS (Encadré 1). En mesurant les vitesses des saccades suite à l’injection de muscimol, les auteurs étaient donc capables de déterminer avec précision la portion de l’espace visuel affectée par l’inactivation. Au cours des expériences, les singes réalisaient une tâche consistant à rapporter la direction vers laquelle un nuage de points en mouvement se déplaçait, tout en maintenant leur regard fixé sur un point central. Il y avait quatre nuages de points à l’écran, dont deux présentaient un mouvement cohérent. Les sujets devaient focaliser leur attention sur le mouvement cohérent d’un des nuages de points (la cible, Figure 2A ) et ignorer l’autre (le « distracteur »). La performance des animaux était proche de 75 % avant l’injection mais, après l’injection, et uniquement lorsque le nuage de points était placé à l’intérieur de la portion d’espace affectée par l’inactivation, leur performance tombait à moins de 25 % (Figure 2B–C). Plus intéressant, leurs erreurs n’étaient pas aléatoires. Ils rapportaient correctement la direction du mouvement du mauvais stimulus, c’est-à-dire du distracteur. Ils présentaient donc un déficit spécifique de la sélection visuelle. Ces résultats démontrent donc très clairement le rôle crucial que le CS joue dans le contrôle attentionnel.
 |
Figure 2. Rôle du CS dans le contrôle attentionnel et conséquences de son inactivation. A. Illustration de la tâche utilisée pour mettre en évidence le rôle du CS dans le contrôle attentionnel [16]. B. Effets comportementaux de l’inactivation du CS lors de l’exécution de la tâche. Les valeurs en abscisse représentent le pourcentage de choix avant l’injection de muscimol (rouge : direction du mouvement de la cible, c’est-à-dire réponse correcte ; jaune : direction du mouvement du « distracteur », c’est-à-dire réponse incorrecte ; gris : autre réponse incorrecte). Les valeurs en ordonnée montrent la proportion de choix après l’injection. Pendant l’inactivation, l’animal rapporte la direction du mouvement du « distracteur » plus souvent que celle de la cible. C. Effets comportementaux durant l’inactivation du CS lorsque l’indice est présenté hors du champ récepteur. Mêmes conventions que ci-dessus. L’inactivation n’a aucun effet dans ce cas. |
Rôle du cortex et des noyaux gris centraux dans le contrôle attentionnel relayé par le colliculus supérieur
La question qui se pose naturellement ensuite est celle-ci : par quels mécanismes une structure impliquée dans le contrôle des mouvements oculaires peut-elle exercer son contrôle sur le traitement visuel ? L’hypothèse la plus évidente est que le CS, via ses connexions indirectes avec le cortex visuel (via le thalamus), contribuerait, au moins en partie, aux effets attentionnels observés au niveau cortical, et qui sont classiquement considérés comme le moyen par lequel l’effet comportemental de l’allocation attentionnelle s’exerce (Encadré 2).
Les effets de l’attention sur le traitement visuel
Le systeme visuel est compose d’un ensemble plus ou moins hierarchise de structures cerebrales [38]. Dans les annees 1980, les premieres etudes realisees chez le primate ont mis en evidence l’existence d’une modulation attentionnelle de l’activite visuelle au sein de ce reseau : l’activite des neurones impliques dans le traitement visuel est amplifiee lorsque l’attention se porte sur le stimulus visuel auquel ils repondent [39], permettant ainsi d’ameliorer le rapport signal/bruit. Plus recemment, d’autres phenomenes lies a l’attention ont ete decrits. Notamment, il a ete montre que l’attention diminue la variabilite des reponses visuelles [40], et conduit les neurones a se desynchroniser [41]. A l’etat de base, et en condition de stimulation visuelle stable, les neurones visuels ont tendance a augmenter et diminuer leur taux de decharge en meme temps, ce qui a pour effet de diminuer la quantite d’informations qu’ils transmettent de facon collective, puisque ces variations ne sont pas liees aux evenements visuels que ces neurones representent [42]. L’attention desynchronise ces variations, ce qui conduit egalement a une amelioration importante du rapport signal/ bruit au niveau de la population de neurones.
Nous avons voulu tester expérimentalement cette hypothèse en combinant des inactivations transitoires du CS à des enregistrements électrophysiologiques dans le cortex visuel lors de la réalisation d’une tâche attentionnelle [17]. Dans cette expérience, les animaux devaient presser un bouton lorsqu’ils percevaient un changement dans la direction du mouvement du nuage de points cible, et ignorer les changements se produisant dans le nuage distracteur (Figure 3A). Lorsque le colliculus supérieur était inactivé, comme attendu, ils devenaient incapables de détecter correctement les changements de direction du mouvement survenant dans la portion de l’espace affectée par l’inactivation, mais commençaient à répondre de manière erronée aux changements ayant lieu dans le nuage de points distracteur, reproduisant le déficit de sélection visuelle décrit ci-dessus. L’activité des neurones était enregistrée pendant la réalisation de cette tâche au sein de deux aires corticales impliquées dans le traitement du mouvement visuel : l’aire middle temporal (MT) et medial superior temporal (MST). Avant l’injection de muscimol dans le CS, ces neurones présentaient toutes les caractéristiques classiques de l’attention : modulation de l’activité, diminution de la variabilité et désynchronisation des neurones adjacents. En supposant que le CS exerce bien son contrôle sur l’attention en étant à l’origine d’au moins une partie des modulations corticales, nous nous attendions à observer, lors de l’inactivation du CS, une diminution, voire même une suppression de ces effets attentionnels dans les aires MT et MST. Tout au contraire, les neurones de MT et MST continuaient à fonctionner tout à fait normalement pendant l’inactivation du CS (Figure 3B–C), alors même que les animaux devenaient incapables d’orienter correctement leur attention vers le stimulus cible. Tous les effets attentionnels présents avant l’inactivation étaient inchangés suite à l’injection de muscimol. Ces résultats démontrent donc que le contrôle du CS sur l’allocation attentionnelle est indépendant des effets attentionnels ayant lieu au niveau cortical. Ceci contredit donc la vision classique selon laquelle l’attention s’exerce exclusivement par le biais des modulations corticales [18] et suggère l’existence de deux systèmes distincts du contrôle attentionnel : l’un sous-cortical et l’autre cortical.
 |
Figure 3. Rôle des aires corticales dans le contrôle attentionnel relayé par le CS. A. Illustration de la tâche utilisée pour étudier l’effet de l’inactivation du CS sur les modulations attentionnelles corticales [17]. B. Propriétés d’un neurone de MST avant inactivation du CS. Le champ récepteur représente la portion de l’espace visuel à laquelle la cellule enregistrée répond. Ce neurone répondait aux stimulus présentés dans le quadrant inférieur gauche. La préférence pour la direction montre le taux de décharge de ce neurone en fonction de la direction du mouvement présenté dans son champ récepteur (cr). Cette cellule répondait préférentiellement aux mouvements visuels dirigés vers le bas et un peu à droite. Le dernier graphe en bas montre le taux de décharge de cette cellule (en potentiel d’action par seconde, pa/s) durant l’exécution de la tâche. Le tracé en vert foncé montre l’activité du neurone lorsque la cible est dans son champ récepteur. Le tracé vert clair représente son activité lorsque le distracteur est présent dans son champ récepteur (cr). Notons que dans ces deux cas, la stimulation visuelle est identique, seule la localisation de l’attention change. La différence entre ces deux tracés représente la modulation attentionnelle classiquement décrite [43]. C. Propriétés du même neurone de MST pendant l’inactivation du CS. La partie affectée du champ visuel est représentée par la forme bleue sur le graphe montrant le champ récepteur (cr) de la cellule. Durant l’inactivation, le champ récepteur (cr), le profil de réponse aux différentes directions du mouvement et, surtout, la modulation attentionnelle restent inchangés. |
Mais si le CS n’exerce pas son contrôle sur l’allocation attentionnelle par le biais des modulations corticales, alors par quel mécanisme le fait-il ? Nous n’avons pas assez de données expérimentales pour l’instant pour répondre à ces questions, mais nous pouvons émettre certaines hypothèses. Si l’on considère toutes les structures sous-corticales vers lesquelles le CS envoie des projections axonales, nous pouvons isoler une série de candidats potentiellement impliqués dans le réseau sous-cortical de l’attention [19]. Parmi ces candidats, le plus convaincant est peut-être le circuit que forme le CS avec les noyaux gris centraux (NGC), via les noyaux intra-laminaires du thalamus (Figure 4). Les NGC sont considérés comme un ensemble de structures important pour la sélection de l’action et l’allocation de ressources [20]. Il est donc tentant de suggérer que le circuit CS-thalamus-NGC-CS pourrait être impliqué aussi de façon centrale dans l’allocation des ressources attentionnelles et la sélection de la cible visuelle [21]. Les connexions anatomiques entre les NGC et le réseau cortical de l’attention d’une part (FEF et LIP notamment [22]), et le CS d’autre part [21], sont parfaitement compatibles avec ce rôle supposé. Les accidents vasculaires conduisant à une lésion des NGC entraînent, dans certains cas, un syndrome d’héminégligence [23] (bien que de nombreuses lésions ailleurs dans l’encéphale puissent entraîner le même syndrome). Chez l’animal, des expériences ont montré qu’une déficience unilatérale en dopamine ou une stimulation électrique du striatum (la structure d’entrée des NGC) conduisent les sujets à réaliser des mouvements oculaires préférentiellement vers la partie ipsilatérale du champ visuel [24, 25]. Finalement, l’injection d’antagonistes de la dopamine entraîne également des déficits qui portent spécifiquement sur l’orientation de l’attention vers les stimulus contralatéraux qui sont en lien avec la récompense [26]. Ces résultats montrent donc que, tout comme le CS, le rôle des NGC dans les mouvements oculaires ne se limite pas au simple contrôle moteur de l’exécution du mouvement, mais s’étend aux aspects cognitifs qui le précèdent, et notamment à la sélection de la « cible saccadique » [27]. Le circuit CS-thalamus-NGC-CS est donc probablement un acteur majeur dans les mécanismes sous-corticaux de la sélection visuelle.
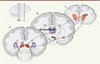 |
Figure 4. Illustration du circuit en boucle formé par le colliculus supérieur (CS), les noyaux intralaminaires du thalamus (Nx Intrathalam), le noyau caudé (Cd) et la substance noire réticulée (SNpr). |
Conclusion
Les découvertes passées et récentes concourent à présenter le CS comme une structure clé dans la sélection visuelle, manifeste et non manifeste. Il semble que le CS exerce cette fonction via des mécanismes qui ne transitent pas par le cortex, suggérant que deux circuits attentionnels fonctionnent en parallèle au niveau cortical et sous-cortical. Les rôles spécifiques de ces deux circuits restent inconnus, mais on peut émettre l’hypothèse selon laquelle le réseau cortical serait plus spécifiquement impliqué dans les aspects cognitifs plus complexes de la sélection visuelle, comme par exemple la coordination avec l’action en cours [28], ou en fonction du contexte visuel environnant [29]. Par opposition, le réseau sous-cortical serait, lui, important pour l’allocation automatique de l’attention vers les stimulus périphériques saillants [30], ou serait mis en jeu au cours de tâches répétitives, ou encore au cours d’apprentissages instrumentaux par renforcement. Finalement, le fait que nous n’ayons pas observé d’effet de l’inactivation du CS sur les processus corticaux dans notre tâche n’exclut pas que ces deux circuits attentionnels puissent dialoguer dans certains contextes. Les champs oculomoteurs frontaux, par exemple, sont connectés à la fois au CS et au cortex visuel [31, 32], et pourraient donc être un lieu privilégié pour cette interaction.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
À Mme Cécile Prairial, neuropsychologue, pour nous avoir autorisés à utiliser le dessin de la Figure 1.
Références
- Ogden JA., Trouble in mind: Stories from a neuropsychologist’s casebook. New York: Oxford University Press, 2012. [Google Scholar]
- Curcio CA, Sloan KR, Kalina RE, et al. Human photoreceptor topography. J Comp Neurol 1990 ; 292 : 497–523. [CrossRef] [PubMed] [Google Scholar]
- Carrasco M. Visual attention: the past 25 years. Vision Res 2011 ; 51 : 1484–1525. [CrossRef] [PubMed] [Google Scholar]
- Thiebaut de Schotten M. L’étude des connexions cérébrales révèle les bases anatomiques de la dominance de l’hémisphère droit pour l’attention spatiale. Med Sci (Paris) 2012 ; 28 : 21–23. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Wardak C, Duhamel J-R. Contrôle du mouvement du regard (1)–Le rôle du cortex pariétal. Med Sci (Paris) 2004 ; 20 : 89–97. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Grosbras M-H, Lobel E, Berthoz A. Contrôle du mouvement du regard (2)–Imagerie fonctionnelle cérébrale des saccades volontaires. Med Sci (Paris) 2004 ; 20 : 225–230. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Filali-Sadouk N, Castet E, Olivier E, et al. Similar effect of cueing conditions on attentional and saccadic temporal dynamics. J Vis 2010 ; 10 : 211–213. [CrossRef] [Google Scholar]
- Rizzolatti G, Riggio L, Dascola I. Reorienting attention across the horizontal and vertical meridians: Evidence in favor of a premotor theory of attention. Neuropsychologia 1987 ; 25 : 31–40. [CrossRef] [PubMed] [Google Scholar]
- Kustov AA, Robinson DL. Shared neural control of attentional shifts and eye movements. Nature 1996 ; 384 : 74–77. [CrossRef] [PubMed] [Google Scholar]
- Blangero A, Khan A, Salemme R, et al. Pre-saccadic perceptual facilitation can occur without covert orienting of attention. Cortex 2010 ; 46 : 1132–1137. [CrossRef] [PubMed] [Google Scholar]
- Juan C-H, Shorter-Jacobi SM, Schall JD. Dissociation of spatial attention and saccade preparation. Proc Natl Acad Sci USA 2004 ; 101 : 15541–15544. [CrossRef] [Google Scholar]
- Sprague JM, Meikle TH. The role of the superior colliculus in visually guide behavior. Exp Neurol 1965 ; 11 : 115–146. [CrossRef] [PubMed] [Google Scholar]
- Sprague JM. Interaction of cortex and superior colliculus in mediation of visually guided behavior in the cat. Science 1966 ; 153 : 1544–1547. [CrossRef] [PubMed] [Google Scholar]
- Durmer JS, Rosenquist AC. Ibotenic acid lesions in the pedunculopontine region result in recovery of visual orienting in the hemianopic cat. Neuroscience 2001 ; 106 : 765–781. [CrossRef] [PubMed] [Google Scholar]
- Ignashchenkova A, Dicke PW, Haarmeier T, et al. Neuron-specific contribution of the superior colliculus to overt and covert shifts of attention. Nat Neurosci 2003 ; 7 : 56–64. [CrossRef] [PubMed] [Google Scholar]
- Lovejoy LP, Krauzlis RJ. Inactivation of primate superior colliculus impairs covert selection of signals for perceptual judgments. Nat Neurosci 2010 ; 13 : 261–266. [CrossRef] [PubMed] [Google Scholar]
- Zénon A, Krauzlis RJ. Attention deficits without cortical neuronal deficits. Nature 2012 ; 489 : 434–437. [CrossRef] [PubMed] [Google Scholar]
- Reynolds JH, Chelazzi L. Attentional modulation of visual processing. Annu Rev Neurosci 2004 ; 27 : 611–647. [CrossRef] [PubMed] [Google Scholar]
- Krauzlis R, Lovejoy LP, Zénon A. Superior colliculus and visual spatial attention. Annu Rev Neurosci 2013 ; 36 : 165–182. [CrossRef] [PubMed] [Google Scholar]
- Redgrave P, Prescott TJ, Gurney K. The basal ganglia: a vertebrate solution to the selection problem?. Neuroscience 1999 ; 89 : 1009–1023. [CrossRef] [PubMed] [Google Scholar]
- McHaffie JG, Stanford TR, Stein BE, et al. Subcortical loops through the basal ganglia. Trends Neurosci 2005 ; 28 : 401–407. [CrossRef] [PubMed] [Google Scholar]
- Selemon LD, Goldman-Rakic PS. Common cortical and subcortical targets of the dorsolateral prefrontal and posterior parietal cortices in the rhesus monkey: evidence for a distributed neural network subserving spatially guided behavior. J Neurosci 1988 ; 8 : 4049–4068. [PubMed] [Google Scholar]
- Karnath H-O. The subcortical anatomy of human spatial neglect: putamen, caudate nucleus and pulvinar. Brain 2002 ; 125 : 350–360. [CrossRef] [PubMed] [Google Scholar]
- Miyashita N, Hikosaka O, Kato M. Visual hemineglect induced by unilateral striatal dopamine deficiency in monkeys. Neuroreport 1995 ; 6 : 1257–1260. [CrossRef] [PubMed] [Google Scholar]
- Ding L, Gold JI. Separate, causal roles of the Caudate in saccadic choice and execution in a perceptual decision task. Neuron 2012 ; 75 : 865–874. [CrossRef] [PubMed] [Google Scholar]
- Hikosaka O. Basal ganglia mechanisms of reward-oriented eye movement. Ann New York Acad Sci 2007 ; 1104 : 229–249. [CrossRef] [Google Scholar]
- Shires J, Joshi S, Basso MA. Shedding new light on the role of the basal ganglia-superior colliculus pathway in eye movements. Curr Opin Neurobiol 2010 ; 20 : 717–725. [CrossRef] [PubMed] [Google Scholar]
- Hayhoe M, Ballard D. Eye movements in natural behavior. Trends Cogn Sci 2005 ; 9 : 188–194. [CrossRef] [PubMed] [Google Scholar]
- Chun MM. Contextual cueing of visual attention. Trends Cogn Sci 2000 ; 4 : 170–178. [CrossRef] [PubMed] [Google Scholar]
- Yantis S, Jonides J. Abrupt visual onsets and selective attention: Voluntary versus automatic allocation. J Exp Psychol Hum Percept Perform 1990 ; 16 : 121–134. [CrossRef] [PubMed] [Google Scholar]
- Lynch JC, Tian J-R. Cortico-cortical networks and cortico-subcortical loops for the higher control of eye movements. Prog Brain Res 2006 ; 151 : 461–501. [CrossRef] [PubMed] [Google Scholar]
- Schall JD, Morel A, King DJ, et al. Topography of visual cortex connections with frontal eye field in macaque: convergence and segregation of processing streams. J Neurosci 1995 ; 15 : 4464–4487. [PubMed] [Google Scholar]
- Robinson DA. Eye movements evoked by collicular stimulation in the alert monkey. Vision Res 1972 ; 12 : 1795–1808. [CrossRef] [PubMed] [Google Scholar]
- Munoz DP, Wurtz RH. Saccade-related activity in monkey superior colliculus. I. Characteristics of burst and buildup cells. J Neurophysiol 1995 ; 73 : 2313–2333. [PubMed] [Google Scholar]
- Moschovakis AK, Scudder CA, Highstein SM. The microscopic anatomy and physiology of the mammalian saccadic system. Prog Neurobiol 1996 ; 50 : 133–254. [CrossRef] [PubMed] [Google Scholar]
- Olivier E, Chat M, Grantyn A. Rostrocaudal and lateromedial density distributions of superior colliculus neurons projecting in the predorsal bundle and to the spinal cord: a retrograde HRP study in the cat. Exp Brain Res 1991 ; 87 : 268–282. [CrossRef] [PubMed] [Google Scholar]
- Corneil BD, Olivier E, Munoz DP. Neck muscle responses to stimulation of monkey superior colliculus. I. Topography and manipulation of stimulation parameters. J Neurophysiol 2002 ; 88 : 1980–1999. [PubMed] [Google Scholar]
- Van Essen DC. Organization of visual areas in macaque and human cerebral cortex. In: Chalupa LM, Werner JS, eds. Visual neurosciences. Cambridge: MIT Press, 2003 : 507–521. [Google Scholar]
- Mountcastle VB, Motter BC, Steinmetz MA, Sestokas AK. Common and differential effects of attentive fixation on the excitability of parietal and prestriate (V4) cortical visual neurons in the macaque monkey. J Neurosci 1987 ; 7 : 2239–2257. [PubMed] [Google Scholar]
- Mitchell JF, Sundberg KA, Reynolds JH. Differential attention-dependent response modulation across cell classes in macaque visual area V4. Neuron 2007 ; 55 : 131–141. [CrossRef] [PubMed] [Google Scholar]
- Mitchell JF, Sundberg KA, Reynolds JH. Spatial attention decorrelates intrinsic activity fluctuations in macaque area V4. Neuron 2009 ; 63 : 879–888. [CrossRef] [PubMed] [Google Scholar]
- Bair W, Zohary E, Newsome WT. Correlated firing in macaque visual area MT: Time scales and relationship to behavior. J Neurosci 2001 ; 21 : 1676–1697. [PubMed] [Google Scholar]
- Treue S, Maunsell JHR. Attentional modulation of visual motion processing in cortical areas MT and MST. Nature 1996 ; 382 : 539–541. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Exemple de dessin produit par un patient héminégligent. Il est demandé au patient de dessiner le cadrant d’une horloge avec tous les chiffres et de représenter les aiguilles indiquant 11h10. Dans cet exemple, le patient a placé tous les chiffres du côté droit de l’horloge (© Cécile Prairial). |
| Dans le texte | |
 |
Figure 2. Rôle du CS dans le contrôle attentionnel et conséquences de son inactivation. A. Illustration de la tâche utilisée pour mettre en évidence le rôle du CS dans le contrôle attentionnel [16]. B. Effets comportementaux de l’inactivation du CS lors de l’exécution de la tâche. Les valeurs en abscisse représentent le pourcentage de choix avant l’injection de muscimol (rouge : direction du mouvement de la cible, c’est-à-dire réponse correcte ; jaune : direction du mouvement du « distracteur », c’est-à-dire réponse incorrecte ; gris : autre réponse incorrecte). Les valeurs en ordonnée montrent la proportion de choix après l’injection. Pendant l’inactivation, l’animal rapporte la direction du mouvement du « distracteur » plus souvent que celle de la cible. C. Effets comportementaux durant l’inactivation du CS lorsque l’indice est présenté hors du champ récepteur. Mêmes conventions que ci-dessus. L’inactivation n’a aucun effet dans ce cas. |
| Dans le texte | |
 |
Figure 3. Rôle des aires corticales dans le contrôle attentionnel relayé par le CS. A. Illustration de la tâche utilisée pour étudier l’effet de l’inactivation du CS sur les modulations attentionnelles corticales [17]. B. Propriétés d’un neurone de MST avant inactivation du CS. Le champ récepteur représente la portion de l’espace visuel à laquelle la cellule enregistrée répond. Ce neurone répondait aux stimulus présentés dans le quadrant inférieur gauche. La préférence pour la direction montre le taux de décharge de ce neurone en fonction de la direction du mouvement présenté dans son champ récepteur (cr). Cette cellule répondait préférentiellement aux mouvements visuels dirigés vers le bas et un peu à droite. Le dernier graphe en bas montre le taux de décharge de cette cellule (en potentiel d’action par seconde, pa/s) durant l’exécution de la tâche. Le tracé en vert foncé montre l’activité du neurone lorsque la cible est dans son champ récepteur. Le tracé vert clair représente son activité lorsque le distracteur est présent dans son champ récepteur (cr). Notons que dans ces deux cas, la stimulation visuelle est identique, seule la localisation de l’attention change. La différence entre ces deux tracés représente la modulation attentionnelle classiquement décrite [43]. C. Propriétés du même neurone de MST pendant l’inactivation du CS. La partie affectée du champ visuel est représentée par la forme bleue sur le graphe montrant le champ récepteur (cr) de la cellule. Durant l’inactivation, le champ récepteur (cr), le profil de réponse aux différentes directions du mouvement et, surtout, la modulation attentionnelle restent inchangés. |
| Dans le texte | |
 |
Figure 4. Illustration du circuit en boucle formé par le colliculus supérieur (CS), les noyaux intralaminaires du thalamus (Nx Intrathalam), le noyau caudé (Cd) et la substance noire réticulée (SNpr). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




