Figure 2.
Télécharger l'image originale
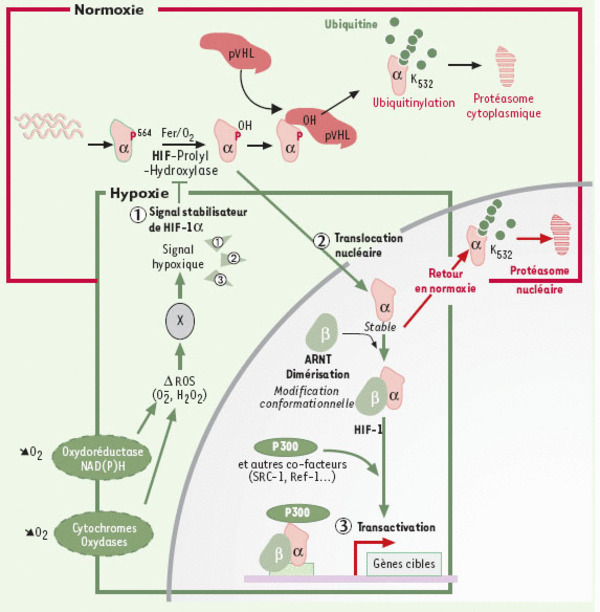
Régulation de l’activité de HIF-1. En condition de normoxie, la protéine HIF-1α est très instable. Elle fixe pVHL, après une hydroxylation sur sa proline 564 dépendante de l’oxygène et du fer. La protéine pVHL fait partie d’un complexe (contenant les élongines B et C et la protéine CUL-2) qui possède une activité E3 ubiquitine ligase. HIF-1α est donc ubiquitinylé en normoxie puis dégradé par le protéasome. En condition d’hypoxie, HIF-1α n’est plus hydroxylé et ne fixe plus pVHL. Le signal hypoxique va aussi déclencher la translocation nucléaire de HIF-1a. Il peut dès lors se fixer à son partenaire HIF-1ß/ARNT1 ainsi qu’à d’autres co-facteurs tels que p300/CBP pour activer des gènes sous la dépendance d’éléments de réponse à l’hypoxie (HRE). Enfin, l’hypoxie permet d’augmenter directement la capacité transcriptionnelle de HIF-1 via ses domaines transactivateurs. Il est possible que d’autres senseurs (oxydoréductases, cytochromes) participent aussi à l’élaboration du signal hypoxique via les ROS. De retour en hypoxie, HIF-1α est rapidement dégradé, une étape pouvant être assurée par le protéasome nucléaire [55].
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




