| Issue |
Med Sci (Paris)
Volume 40, Number 8-9, Août-Septembre 2024
|
|
|---|---|---|
| Page(s) | 616 - 619 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2024089 | |
| Published online | 20 September 2024 | |
La dédifférenciation cellulaire entretient la population de cellules souches des mélanocytes dans le follicule pileux
Cell dedifferentiation maintains the melanocyte stem cell population in the hair follicle
1
Équipe photobiologie, CNRS UMR 8256, Institut de biologie Paris-Seine, Sorbonne université, Paris, France
2
UFR 927 Sciences de la vie, Sorbonne université, Paris, France
Le poil (tige pilaire) est la partie externe du follicule pileux, un mini-organe soumis au cycle pilaire au cours duquel se succèdent des phases de croissance (anagène), de régression (catagène) et de repos (télogène) [1, 2]. La phase anagène met en place un nouveau poil et implique deux populations de cellules souches : les HFSC (hair follicle stem cells), à l’origine des cellules constituant le poil et ses couches épithéliales périphériques, et les MeSC (melanocyte stem cells), qui produisent les mélanocytes responsables de la pigmentation du poil. HFSC et MeSC co-résident dans deux régions contigües du follicule pileux, le bulge (que l’on peut traduire par « renflement ») et le hair germ (HG, que l’on peut traduire par « zone germinative »)1 (Figure 1) [3–8]. Le début de la phase anagène correspond à l’activation (prolifération et différenciation) coordonnée des HFSC et des MeSC [7, 8]. L’activation des MeSC du HG est supérieure à celle des MeSC du bulge [7, 8], un constat qui suggère que les MeSC du HG sont largement « consommées » à chaque cycle pilaire pour produire les mélanocytes matures (pigmentés, produisant la mélanine) du bulbe pileux (Figure 1), tandis que les MeSC du bulge constitueraient une population de long terme, responsable du maintien des MeSC [8]. Cette hypothèse implique que la différenciation des MeSC du HG soit un processus irréversible. Elle étend aux MeSC le modèle proposé pour les HFSC, et apparaît cohérente avec les liens fonctionnels entre ces deux populations [6–10]. Toutefois, elle ignore certaines différences entre MeSC et HFSC. Ainsi, alors que des marqueurs et des propriétés distinguent les HFSC du HG de celles du bulge [1, 5]2, une telle distinction n’a pas été rapportée pour les MeSC [7]. De plus, les MeSC disparaissent plus tôt que les HFSC au cours de la vie, ce qui cause, ou rend irréversible, le grisonnement lié à l’âge [8, 9]. Enfin, des observations suggèrent que l’engagement des MeSC dans la différenciation n’est pas irréversible [3, 10]. Une étude récente décrit le devenir des MeSC du bulge et du HG au cours d’un ou de plusieurs cycles pilaires chez la souris. Ses résultats indiquent que les MeSC se maintiennent grâce à un mécanisme particulier, distinct de celui des HFSC, et ouvrent de nouvelles pistes pour comprendre le grisonnement lié à l’âge [8].
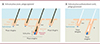 |
Figure 1. A. Le maintien des cellules souches des mélanocytes (MeSC) du follicule pileux repose sur la dédifférenciation cellulaire. En phase télogène, la partie inférieure du follicule pileux se compose du bulge et du hair germ (HG). Bulge et HG contiennent les cellules souches du follicule pileux (hair follicle stem cells, HFSC, non représentées) distinguables par l’expression de CD34 (bulge) et de la P-cadhérine (HG). Juste en dessous du HG, des cellules mésenchymateuses spécialisées forment la papille dermique (en bleu), qui contrôle l’activation des HFSC et la régénération du follicule pileux [1, 2, 4–6, 14, 15]. Dans la plupart des follicules pileux en phase télogène de la souris jeune (pigmentée), les MeSC (en blanc) sont exclusivement présentes dans le HG, où elles forment une population étroitement rassemblée. Une petite minorité des follicules pileux présentent en plus des MeSC dans le bulge (cas représenté ici). Au début de la phase anagène, les MeSC du HG sont activées par l’induction du signal Wnt [7, 8]. Elles engendrent une population de cellules intermédiaires, les mélanocytes TA (transit-amplifying) (en orange), qui migrent vers la base du follicule pileux en croissance. Une partie des mélanocytes TA maintiennent un signal Wnt actif et achèvent leur différenciation (flèche rouge) en mélanocytes matures pigmentés (en rouge) dans le bulbe pileux. Une autre partie des mélanocytes TA remontent vers le bulge ou l’ORSup (upper outer root sheath), une région située juste en dessous du bulge en phase anagène [1, 8]. Dans ce cas, la migration est associée à une extinction du signal Wnt et à une dédifférenciation (flèche blanche) en MeSC, qui se relocalisent généralement dans le HG lors de la phase télogène suivante (cas représenté), ou restent parfois dans le bulge. Notons que les MeSC du bulge présentent une faible prolifération (non représentée) en milieu ou fin de phase anagène [8]. Chez les souris transgéniques (Oca2creER ; RosaLSL-tdTomato) utilisées pour mettre en évidence la dédifférenciation des mélanocytes en MesC, la séquence codant la recombinase conditionnelle creER est insérée (knock-in) dans le gène du marqueur tardif de la différenciation mélanocytaire Oca2. L’activation transcriptionnelle de Oca2 s’accompagne donc de celle de creER, qui, en présence de l’inducteur tamoxifène, déclenche l’expression irréversible (transmise à toute la descendance de la cellule) de la protéine fluorescente rouge tdTomato, détectable directement par un procédé non invasif. L’expression de tdTomato atteste donc d’au moins un engagement dans la différenciation mélanocytaire jusqu’au stade OCA2+, et les MeSC tdTomato+ sont par conséquent issues de la dédifférenciation de mélanocytes (partiellement) différenciés (mélanocytes TA OCA2+). Pour le suivi des MeSC pendant un cycle pilaire complet à partir de la phase télogène, une autre lignée de souris a été utilisée (TyrcreER;RosaLSL-tdTomato) permettant de déclencher le marquage dans les MeSC lors de la phase télogène initiale. Dans les deux lignées de souris, le suivi en direct (live imaging) est réalisé lors du premier cycle pilaire (à partir de l’âge de 21 jours environ) : un même follicule pileux est observé à plusieurs reprises lors du cycle et les conditions choisies permettent une analyse clonale (déclenchement du marquage dans une seule cellule par follicule pileux) [8]. B. Mécanisme proposé pour le grisonnement précoce des souris dans un modèle de vieillissement accéléré du follicule pileux. Le vieillissement des follicules pileux a été artificiellement accéléré par des épilations répétées en phase télogène pour induire sept cycles pilaires (ou six, suivis d’un vieillissement naturel pendant 8 mois). À l’issue de cette période, les souris grisonnent, et la répartition des MeSC est fortement modifiée : elles ont disparu du HG dans un dixième des follicules pileux, mais sont présentes dans le bulge de la majorité d’entre eux, où elles apparaissent dispersées. Dans certains follicules pileux vieillissants (cas représenté), les MeSC sont situées exclusivement dans le bulge. Dans d’autres cas (non représentés), des MeSC s’accumulent dans le bulge, mais sont aussi encore présentes dans le HG [8]. Chez la souris jeune (pigmentée), les (rares) MeSC du bulge n’engendrent pas de mélanocytes matures lors de la phase anagène, à la différence de celles du HG [8]. Les auteurs postulent donc que, dans ce modèle de follicule pileux vieillissant, l’accumulation de MeSC dans le bulge en même temps que leur disparition (ou raréfaction) dans le HG diminue leur capacité à se différencier, ce qui cause le grisonnement. Toutefois, le devenir des MeSC du bulge en phase anagène n’a pas été étudié dans les follicules pileux vieillissants, et les auteurs ne montrent pas directement que les follicules pileux dépigmentés correspondent bien à ceux qui ont accumulé des MeSC dans le bulge et perdu celles du HG [8]. Certaines structures associées au follicule pileux ne sont pas représentées (par exemple la glande sébacée), et le nombre de cellules dessinées est volontairement réduit. |
Le lignage mélanocytaire du follicule pileux a été suivi grâce à l’expression d’une protéine fluorescente dans différentes populations de cellules. Une fois déclenchée, l’expression de la protéine marqueur se maintient dans la cellule et dans toute sa descendance, et peut être détectée de façon non invasive [8]. En marquant ainsi les MeSC, les auteurs montrent que la quasi-totalité des MeSC du HG commencent à se différencier au début de la phase anagène. Ils confirment que cette différenciation dépend de l’activation du signal Wnt dans les MeSC du HG, activation elle-même dépendante de ligands Wnt sécrétés par les cellules épithéliales voisines3 [7, 8]. Surtout, ils dévoilent un élément nouveau. L’engagement généralisé des MeSC du HG dans la différenciation suggère que ces cellules ne s’auto-renouvellent pas, et que leur régénération repose sur les MeSC du bulge. Or, ce n’est pas le cas : un suivi individuel des MeSC du HG lors d’un cycle pilaire montre que ces cellules produisent à la fois des mélanocytes matures du bulbe pileux et de nouveaux MeSC [8]. Comment cette double capacité des MeSC du HG est-elle compatible avec leur entrée collective en différenciation ? Afin de répondre à cette question, les auteurs ont suivi des mélanocytes engagés dans la différenciation grâce à un nouveau modèle permettant de déclencher le marquage fluorescent dans des cellules exprimant le gène de différenciation mélanocytaire Oca2 (Oculocutaneous albinism 2)4 (Figure 1). Ils montrent ainsi qu’une partie des cellules marquées produites en début de phase anagène (mélanocytes TA, transit amplifying5, OCA2+) se dédifférencient en MeSC plus tard au cours de cette phase (Figure 1) [8]. OCA2 étant un marqueur tardif de la différenciation mélanocytaire [8], ce résultat montre que la dédifférenciation en MeSC est possible même pour des mélanocytes ayant atteint un stade avancé de la différenciation. Il existe cependant une limite puisque les mélanocytes matures du bulbe pileux ne se dédifférencient pas, sont entièrement éliminés à la fin de la phase anagène, et sont renouvelés lors du cycle pilaire suivant [3, 8]. Les MeSC du HG régénérées par dédifférenciation de mélanocytes TA OCA2+ peuvent se maintenir (directement ou via leur descendance) et redonner des mélanocytes matures jusqu’à au moins deux ans après la dédifférenciation [8]. Ils sont donc capables d’entretenir à long terme la pigmentation du follicule pileux. De plus, le nombre de MeSC qui se sont engagées au moins une fois dans la différenciation jusqu’au stade OCA2+ augmente à chaque cycle pilaire, et représente la totalité des MeSC dans plus d’un cinquième des follicules pileux après trois cycles [8]. Sans la dédifférenciation, le stock de MeSC s’épuiserait donc rapidement. Enfin, les auteurs montrent que la dédifférenciation des mélanocytes TA OCA2+ nécessite la baisse du signal Wnt dans ces cellules, baisse associée à leur migration vers le bulge (Figure 1). Ils concluent que les MeSC du HG peuvent régénérer toutes les populations mélanocytaires du follicule pileux puisque leurs descendantes partiellement différenciées peuvent soit se différencier irréversiblement en mélanocytes matures soit se dédifférencier en MeSC. À l’appui de cette conclusion, tous les follicules pileux de la souris jeune (pigmentée) contiennent des MeSC dans le HG, mais après de multiples cycles pilaires déclenchés par une épilation, une partie des follicules pileux est dépourvue de MeSC dans le HG, et la souris grisonne [8] (Figure 1).
Réciproquement, le rôle des MeSC du bulge apparaît amoindri par les résultats de cette étude. Chez la souris jeune, la plupart des follicules pileux en phase télogène ne contiennent aucune MeSC dans le bulge. En effet, la présence de MeSC dans le bulge pendant la phase anagène est généralement transitoire, et correspond à des mélanocytes TA en cours de migration et de dédifférenciation avant leur « retour » dans le HG en phase télogène [8]. De plus, le suivi en direct des rares MeSC situées dans le bulge en phase télogène montrent que, lors de la phase anagène suivante, elles se divisent peu, ne produisent aucun mélanocyte mature, et restent dans le bulge [8]. Ces MeSC apparaissent donc comme « coincées » dans leur niche, au moins dans des conditions ordinaires [8]. De façon remarquable, dans les follicules pileux vieillis expérimentalement par la répétition de cycles pilaires et d’épilations, les MeSC s’accumulent fréquemment dans le bulge en même temps qu’elles disparaissent du HG [8] (Figure 1). Dans ce modèle de vieillissement, le grisonnement des souris ne semble donc pas associé à un épuisement du stock de MeSC, mais à leur absence dans le micro-environnement du HG propice à leur différenciation en phase anagène. Cette observation suggère que le grisonnement lié à l’âge pourrait résulter non pas seulement d’un excès de la différenciation ou d’une défaillance de l’auto-renouvellement des MeSC, comme cela a été proposé à partir d’autres modèles [9–13], mais aussi d’un défaut de leur migration et de leur différenciation.
En résumé, cette étude révèle l’importance des MeSC du HG dans l’entretien à long terme de la pigmentation du follicule pileux. Elle dévoile que la dédifférenciation joue un rôle clé dans l’entretien normal d’une population de cellules souches somatiques. Elle souligne l’influence de la position et de la migration des mélanocytes sur leur différenciation et leur dédifférenciation. Des mélanocytes du compartiment TA « remontent » le chemin de la différenciation, au sens à la fois spatial et phénotypique, et redonnent des MeSC fonctionnelles dans le HG [8] (Figure 1). Ce mécanisme indirect d’auto-renouvellement, qui fait intervenir un intermédiaire partiellement différencié, distingue les MeSC des HFSC, et d’autres cellules souches somatiques de souris, qui s’autorenouvellent à l’état non-différencié et se différencient généralement de façon irréversible6 [5, 6, 8]. Les résultats de cette étude suscitent de nombreuses questions. L’accumulation de MeSC dans le bulge des follicules pileux vieillis expérimentalement résulte-t-elle d’une altération progressive des MeSC, de celle de leur environnement, ou simplement de la récurrence d’un retour « incomplet » dans le HG à chaque cycle pilaire [8] ? Les MeSC du bulge peuvent-elles produire des mélanocytes matures dans certaines conditions [8] ? Peuvent-elles migrer dans le HG ? Dans les follicules pileux vieillis expérimentalement, un tel repositionnement suffirait-il à permettre leur différenciation en phase anagène et, si oui, peut-on le favoriser pour restaurer la pigmentation des souris grisonnantes [8] ? Le fait que l’engagement des MeSC dans la différenciation précède leur migration et (en général) leur prolifération [8] contribue-t-il à la réversibilité de leur différenciation ? Les limites de cette réversibilité, à la fois lors d’un cycle pilaire et au cours des cycles, restent à préciser. La méthode employée ne permet pas de compter le nombre de fois qu’une MeSC s’est différenciée jusqu’au stade OCA2+. On ne sait donc pas si ce nombre influe sur le destin des MeSC, ni s’il existe une limite à ce nombre. Enfin, puisque les mélanocytes matures du bulbe pileux ne peuvent pas se dédifférencier en MeSC, comment s’opère la transition vers une différenciation irréversible ? Celle-ci est corrélée avec l’extinction de plusieurs gènes, dont certains jouent un rôle important dans d’autres types de cellules souches [8]. En revanche, elle n’accompagne pas nécessairement l’acquisition de la capacité à produire la mélanine : des mélanocytes pigmentés (et OCA2+), issus d’une différenciation accélérée par l’exposition des souris aux rayonnements UVB, peuvent se dédifférencier en MeSC [8]. En milieu de phase anagène, ces mélanocytes pigmentés « réversibles » sont localisés, en dehors du bulbe pileux, et expriment plus faiblement certains marqueurs de différenciation (dont OCA2) que les mélanocytes pigmentés « normaux » du bulbe pileux [8]. Il sera intéressant de déterminer le rôle du micro-environnement du bulbe pileux, qui promeut la maturation fonctionnelle des mélanocytes [14], dans leur progression vers une différenciation irréversible.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
HG désigne ici le secondary hair germ, structure du follicule pileux « cyclant » après la naissance, et non le primary hair germ, primordium du follicule pileux dans l’embryon [5]. Le HG contient des MeSC entourées par des HFSC, et il est en contact direct avec la papille dermique. Il se forme en fin de phase catagène, et disparaît au début de la phase anagène en contribuant de façon majeure à la régénération du follicule pileux [2, 5, 7, 8]. Le HG est bien caractérisé chez la souris, tandis que son existence est plus incertaine chez l’homme [5].
Pour marquer ces différences, certains auteurs utilisent des termes distincts pour les deux populations : HFSC pour celle du bulge et (par exemple) HFSC amorcées (primed) [1, 5] ou progéniteurs [6, 8] pour celle du HG. Nous avons gardé ici la même appellation (HFSC) pour ces deux populations, comme d’autres auteurs [13]. Soulignons que le « caractère souche » des HFSC du HG, leur capacité d’auto-renouvellement, et leurs liens avec les HFSC du bulge restent des points discutés [1, 5, 8].
Population TA (transit amplifying) désigne couramment les cellules prolifératives intermédiaires entre les cellules souches (leurs ascendantes) et les cellules différenciées (leurs descendantes) [1, 3, 5, 8]. Nous utilisons ici mélanocytes TA pour désigner plus largement les cellules, prolifératives ou non, présentant une différenciation intermédiaire entre les MeSC non activées (en phase télogène) et les mélanocytes matures du bulbe pileux.
Références
- Myung P, Ito M. Dissecting the bulge in hair regeneration. J Clin Invest 2012 ; 122 : 448–54. [CrossRef] [PubMed] [Google Scholar]
- Morgan BA. The dermal papilla: An instructive niche for epithelial stem and progenitor cells in development and regeneration of the hair follicle. Cold Spring Harb Perspect Med 2014 ; 4 : a015180. [CrossRef] [PubMed] [Google Scholar]
- Nishimura EK, Jordan SA, Oshima H, et al. Dominant role of the niche in melanocyte stem-cell fate determination. Nature 2002 ; 416 : 854–60. [CrossRef] [PubMed] [Google Scholar]
- Infarinato NR, Stewart KS, Yang Y, et al. BMP signaling: at the gate between activated melanocyte stem cells and differentiation. Genes Dev 2020 ; 34 : 1713–34. [CrossRef] [PubMed] [Google Scholar]
- Panteleyev AA. Functional anatomy of the hair follicle: the secondary hair germ. Exp Dermatol 2018 ; 27 : 701–20. [CrossRef] [PubMed] [Google Scholar]
- Rompolas P, Mesa KR, Greco V. Spatial organization within a niche as a determinant of stem-cell fate. Nature 2013 ; 502 : 513–8. [CrossRef] [PubMed] [Google Scholar]
- Rabbani P, Takeo M, Chou WC, et al. Coordinated activation of Wnt in epithelial and melanocyte stem cells initiates pigmented hair regeneration. Cell 2011 ; 145 : 941–55. [CrossRef] [PubMed] [Google Scholar]
- Sun Q, Lee W, Hu H, et al. Dedifferentiation maintains melanocyte stem cells in a dynamic niche. Nature 2023 ; 616 : 774–82. [CrossRef] [PubMed] [Google Scholar]
- Nishimura EK, Granter SR, Fisher DE. Mechanisms of hair graying: incomplete melanocyte stem cell maintenance in the niche. Science 2005 ; 307 : 720–4. [CrossRef] [PubMed] [Google Scholar]
- Nishimura EK, Suzuki M, Igras V, et al. Key roles for transforming growth factor beta in melanocyte stem cell maintenance. Cell Stem Cell 2010 ; 6 : 130–40. [CrossRef] [PubMed] [Google Scholar]
- Tanimura S, Tadokoro Y, Inomata K, et al. Hair follicle stem cells provide a functional niche for melanocyte stem cells. Cell Stem Cell 2011 ; 8 : 177–87. [CrossRef] [PubMed] [Google Scholar]
- Inomata K, Aoto T, Binh NT, et al. Genotoxic stress abrogates renewal of melanocyte stem cells by triggering their differentiation. Cell 2009 ; 137 : 1088–99. [CrossRef] [PubMed] [Google Scholar]
- Zhang B, Ma S, Rachmin I, et al. Hyperactivation of sympathetic nerves drives depletion of melanocyte stem cells. Nature 2020 ; 577 : 676–81. [CrossRef] [PubMed] [Google Scholar]
- Zocco M, Blanpain C. Identifying the niche controlling melanocyte differentiation. Genes Dev 2017 ; 31 : 721–3. [CrossRef] [PubMed] [Google Scholar]
- Dekoninck S, Blanpain C. Stem cell dynamics, migration and plasticity during wound healing. Nat Cell Biol 2019 ; 21 : 18–24. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. A. Le maintien des cellules souches des mélanocytes (MeSC) du follicule pileux repose sur la dédifférenciation cellulaire. En phase télogène, la partie inférieure du follicule pileux se compose du bulge et du hair germ (HG). Bulge et HG contiennent les cellules souches du follicule pileux (hair follicle stem cells, HFSC, non représentées) distinguables par l’expression de CD34 (bulge) et de la P-cadhérine (HG). Juste en dessous du HG, des cellules mésenchymateuses spécialisées forment la papille dermique (en bleu), qui contrôle l’activation des HFSC et la régénération du follicule pileux [1, 2, 4–6, 14, 15]. Dans la plupart des follicules pileux en phase télogène de la souris jeune (pigmentée), les MeSC (en blanc) sont exclusivement présentes dans le HG, où elles forment une population étroitement rassemblée. Une petite minorité des follicules pileux présentent en plus des MeSC dans le bulge (cas représenté ici). Au début de la phase anagène, les MeSC du HG sont activées par l’induction du signal Wnt [7, 8]. Elles engendrent une population de cellules intermédiaires, les mélanocytes TA (transit-amplifying) (en orange), qui migrent vers la base du follicule pileux en croissance. Une partie des mélanocytes TA maintiennent un signal Wnt actif et achèvent leur différenciation (flèche rouge) en mélanocytes matures pigmentés (en rouge) dans le bulbe pileux. Une autre partie des mélanocytes TA remontent vers le bulge ou l’ORSup (upper outer root sheath), une région située juste en dessous du bulge en phase anagène [1, 8]. Dans ce cas, la migration est associée à une extinction du signal Wnt et à une dédifférenciation (flèche blanche) en MeSC, qui se relocalisent généralement dans le HG lors de la phase télogène suivante (cas représenté), ou restent parfois dans le bulge. Notons que les MeSC du bulge présentent une faible prolifération (non représentée) en milieu ou fin de phase anagène [8]. Chez les souris transgéniques (Oca2creER ; RosaLSL-tdTomato) utilisées pour mettre en évidence la dédifférenciation des mélanocytes en MesC, la séquence codant la recombinase conditionnelle creER est insérée (knock-in) dans le gène du marqueur tardif de la différenciation mélanocytaire Oca2. L’activation transcriptionnelle de Oca2 s’accompagne donc de celle de creER, qui, en présence de l’inducteur tamoxifène, déclenche l’expression irréversible (transmise à toute la descendance de la cellule) de la protéine fluorescente rouge tdTomato, détectable directement par un procédé non invasif. L’expression de tdTomato atteste donc d’au moins un engagement dans la différenciation mélanocytaire jusqu’au stade OCA2+, et les MeSC tdTomato+ sont par conséquent issues de la dédifférenciation de mélanocytes (partiellement) différenciés (mélanocytes TA OCA2+). Pour le suivi des MeSC pendant un cycle pilaire complet à partir de la phase télogène, une autre lignée de souris a été utilisée (TyrcreER;RosaLSL-tdTomato) permettant de déclencher le marquage dans les MeSC lors de la phase télogène initiale. Dans les deux lignées de souris, le suivi en direct (live imaging) est réalisé lors du premier cycle pilaire (à partir de l’âge de 21 jours environ) : un même follicule pileux est observé à plusieurs reprises lors du cycle et les conditions choisies permettent une analyse clonale (déclenchement du marquage dans une seule cellule par follicule pileux) [8]. B. Mécanisme proposé pour le grisonnement précoce des souris dans un modèle de vieillissement accéléré du follicule pileux. Le vieillissement des follicules pileux a été artificiellement accéléré par des épilations répétées en phase télogène pour induire sept cycles pilaires (ou six, suivis d’un vieillissement naturel pendant 8 mois). À l’issue de cette période, les souris grisonnent, et la répartition des MeSC est fortement modifiée : elles ont disparu du HG dans un dixième des follicules pileux, mais sont présentes dans le bulge de la majorité d’entre eux, où elles apparaissent dispersées. Dans certains follicules pileux vieillissants (cas représenté), les MeSC sont situées exclusivement dans le bulge. Dans d’autres cas (non représentés), des MeSC s’accumulent dans le bulge, mais sont aussi encore présentes dans le HG [8]. Chez la souris jeune (pigmentée), les (rares) MeSC du bulge n’engendrent pas de mélanocytes matures lors de la phase anagène, à la différence de celles du HG [8]. Les auteurs postulent donc que, dans ce modèle de follicule pileux vieillissant, l’accumulation de MeSC dans le bulge en même temps que leur disparition (ou raréfaction) dans le HG diminue leur capacité à se différencier, ce qui cause le grisonnement. Toutefois, le devenir des MeSC du bulge en phase anagène n’a pas été étudié dans les follicules pileux vieillissants, et les auteurs ne montrent pas directement que les follicules pileux dépigmentés correspondent bien à ceux qui ont accumulé des MeSC dans le bulge et perdu celles du HG [8]. Certaines structures associées au follicule pileux ne sont pas représentées (par exemple la glande sébacée), et le nombre de cellules dessinées est volontairement réduit. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




