| Issue |
Med Sci (Paris)
Volume 40, Number 5, Mai 2024
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 474 - 476 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2024049 | |
| Published online | 31 May 2024 | |
Des nanofeuilles inorganiques immunostimulantes pour lutter contre les infections bactériennes liées aux implants de matériel médical
Inorganic nanosheets facilitate humoral immunity against medical implant infections by modulating immune co-stimulatory pathway
Master 2 infectiologie, immunité, vaccinologie et biomédicaments, Université de Tours, 37000 Tours, France
L’utilisation d’implants médicaux (prothèses, cathéters, chambres implantables, etc.) a considérablement augmenté ces dernières décennies. Mais celle-ci est associée à un risque majeur d’infections des patients. En effet, d’après le Center for Disease Control (CDC), 50 à 70 % des infections associées aux soins sont attribuées aux implants médicaux [1] et 80 % de ces infections sont associées à la formation de biofilms bactériens [2].
Le biofilm bactérien est un agrégat de cellules bactériennes attaché à une surface et enrobé d’une matrice polymérique, formant une niche d’immunodépression en rendant les antigènes bactériens invisibles au système immunitaire, et augmentant la résistance des bactéries pathogènes à la réponse immunitaire de l’hôte ainsi qu’aux antibiotiques [3]. Une des stratégies en développement contre ce type de biofilm est d’optimiser la réponse immunitaire de l’hôte, en particulier la production d’anticorps neutralisants efficaces et la mise en place d’une réponse mémoire dirigée contre le biofilm. L’utilisation des nanotechnologies comme procédé d’immunothérapie est de plus en plus envisagée, notamment dans le traitement de certains cancers ou comme particules nanoadjuvantes dans les stratégies vaccinales. Il a été montré que du nanomatériel contenant du manganèse, du phosphore et du sélénium possède un potentiel immuno-stimulateur [4–6]. Dans une étude récente, Yang et al. [7] font l’hypothèse qu’une nanofeuille en deux dimensions à base de chalcogénophosphate de manganèse (MnPSe3) associée à du polyvinylpyrrolidone (MPS-PVP) peut agir comme un agent immuno-stimulant inorganique dans le traitement d’infections bactériennes liées à des implants médicaux.
In vitro, le MPS-PVP, en érodant le biofilm, permet l’exposition d’antigènes et l’activation des voies de signalisation pro-inflammatoires des macrophages
Le biofilm bactérien, par de multiples mécanismes, échappe à la reconnaissance par le système immunitaire, notamment en modulant l’expression des antigènes bactériens et en sécrétant des substances extracellulaires polymériques protectrices. Activer la libération des antigènes du biofilm est donc un des objectifs majeurs d’une immunothérapie active contre le biofilm. Les auteurs ont pu démontrer que, in vitro, le MPS-PVP, aux concentrations de 10 et 20 µg/mL, induit une destruction du biofilm produit in vitro par culture bactérienne sur des plaques de titanium, supérieure à la vancomycine et à l’ofloxacine, et une réduction significative de l’inoculum bactérien. Des expériences de cytométrie en flux ont de plus permis de mettre en évidence une importante apoptose bactérienne (grâce à un marquage avec l’iodure de propidium), ainsi qu’une concentration importante en espèces réactives de l’oxygène (ROS), ces deux mécanismes étant potentiellement impliqués dans la destruction du biofilm.
Des analyses du transcriptome (par séquençage de l’ARN, RNAseq) d’une lignée macrophagique murine cultivée en présence de MPS-PVP ont montré que trois voies de signalisation pro-inflammatoires étaient activées dans ces conditions : les voies des NOD (nucleotide-binding oligomerization domain)-like récepteurs, de l’IL(interleukine)-17 et du TNF-α (tumor necrosis factor alpha). De plus, le MPS-PVP induit l’expression sur les macrophages de molécules co-activatrices comme CD40, CD80 et CD69, et la production de cytokines pro-inflammatoires comme le TNF-α, l’IL-1β, l’IL-6 et l’IL-12, qui vont permettre la maturation des cellules dendritiques et l’amplification de la réponse immunitaire adaptative médiée par les lymphocytes T et B dirigés contre le biofilm.
Des expériences de cytométrie en flux et d’imagerie ont par ailleurs montré qu’alors que la présence de biofilms modifie la polarisation de macrophages de type M1 (pro-inflammatoires) vers un phénotype de type M2 (anti-inflammatoires), les macrophages exposés au MPS-PVP expriment plus le CCR7 (C-C chemokine receptor type 7), marqueur du phénotype M1, que le CD206, marqueur du phénotype M2, et leur taux de phagocytose bactérienne est bien supérieur à celui des macrophages contrôles exposés à du PBS (solution saline tamponnée au phosphate) ou exposés à la vancomycine.
Ces expériences in vitro suggèrent que le MPS-PVP pourrait constituer une stratégie intéressante pour moduler le microenvironnement anti-inflammatoire généré par le biofilm bactérien et permettre la destruction de ce dernier par le déclenchement des réponses immunitaires innée et adaptative de l’hôte.
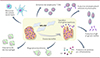 |
Figure 1. Activation par le MPS-PVP d’une immunité innée et adaptative dirigée contre les bactéries du biofilm. L’érosion du biofilm par le MPS-PVP permet l’exposition d’antigènes bactériens induisant une cascade de réponses pro-inflammatoires: augmentation des macrophages pro-inflammatoires M1, des cellules dendritiques matures, des lymphocytes T CD4+, des plasmocytes et plasmoblastes, diminution des lymphocytes T régulateurs, augmentation des taux sériques de cytokines pro-inflammatoires et des IgG et IgM. Les auteurs démontrent ainsi que le MPS-PVP induit l’activation d’une immunité innée et adaptative dirigée contre les bactéries du biofilm. |
In vivo, le MPS-PVP permet un contrôle du biofilm et de l’infection sur matériel médical
Staphylococcus aureus est la principale bactérie responsable d’infection sur matériel médical. Selon les pays, près de la moitié de ces bactéries sont résistantes à la méticilline (Staphylococcus aureus résistant à la méticilline, SARM). Lors de ces infections, l’antibiotique de choix est la vancomycine [8, 9]. Les auteurs ont donc voulu étudier l’effet du MPS-PVP comparé à celui de la vancomycine dans l’infection de matériel à SARM. Pour cela, ils ont créé un modèle murin d’infection de matériel, en implantant à des souris du matériel en titane, qu’ils ont infecté par injection de SARM. Trois jours après, ils ont injecté aux souris le MPS-PVP, de la vancomycine ou du PBS (contrôle). Au cours des 10 jours suivant l’injection de MPS-PVP, la surface de la plaie a diminué, alors qu’elle n’a cessé de croître avec le contrôle ou la vancomycine. Des analyses bactériologiques et immunologiques ont ensuite été réalisées au 10e jour. La charge bactérienne au niveau du matériel et des tissus adjacents était moins élevée chez les souris traitées au MPS-PVP. L’analyse par cytométrie de flux des ganglions drainant le site de l’infection a montré, chez les souris traitées avec le MPS-PVP, une augmentation des macrophages de type M1, des cellules dendritiques matures, des lymphocytes T CD4+, des plasmocytes et plasmoblastes, ainsi qu’une diminution des lymphocytes T régulateurs. Les auteurs ont également observé des taux sériques de cytokines pro-inflammatoires (IL-1β, TNF-α, IL-6, IL-12) et d’immunoglobulines G et M plus élevés chez les souris ayant reçu le MPS-PVP.
Ainsi, les chercheurs démontrent in vivo l’effet du MPS-PVP sur l’activation d’une immunité innée et humorale dirigée contre les bactéries du biofilm, via une induction de réponses pro-inflammatoires.
Utilisation comme immunothérapie néoadjuvante in vivo
En pratique clinique, les infections sur matériel nécessitent souvent un remplacement du matériel. Malgré tout, les récidives d’infection sont fréquentes, dues à la présence de micro-dépôts bactériens, s’apparentant à des micro-métastases infectieuses [10, 11]. Dans le cadre des pathologies tumorales malignes, l’immunothérapie néoadjuvante permet de diminuer le volume tumoral et de traiter les éventuelles micro-métastases [12].
De façon analogue, les chercheurs ont posé l’hypothèse que le MPS-PVP pourrait agir comme une immunothérapie néoadjuvante. Ils ont implanté du matériel à des souris puis ont infecté ce matériel avec du SARM. Neuf jours après, ils ont injecté le MPS-PVP, du PBS (contrôle) ou de la vancomycine, puis ont retiré l’implant le lendemain. Au onzième jour, ils ont disposé un nouvel implant et l’ont infecté au SARM.
Après la pose du deuxième implant, la surface des plaies des souris traitées avec le MPS-PVP a diminué progressivement, à la différence des souris non traitées. Les analyses réalisées au 25e jour ont mis en évidence un nombre de bactéries au niveau de l’implant et des tissus adjacents plus faible pour les souris traitées au MPS-PVP. D’un point de vue immunologique, l’analyse en cytométrie de flux des ganglions drainants a montré, chez les souris ayant reçu le MPS-PVP, un nombre plus important de lymphocytes B mémoires, incluant une proportion de cellules aptes à se différencier en plasmocytes plus importante. Les auteurs ont également observé un taux plus élevé de cytokines pro-inflammatoires Il-1β, TNF-α, IL-6, IL-12 et d’immunoglobulines G.
Le MPS-PVP utilisé comme immunothérapie néoadjuvante permet donc d’induire une réponse immunitaire systémique, et une immunité humorale mémoire, permettant d’éliminer de potentiels foyers bactériens micro-métastatiques et de lutter contre d’éventuelles récidives de l’infection sur matériel.
Conclusion
En conclusion, l’érosion du biofilm et l’exposition d’antigènes induits par le MPS-PVP permettent l’activation des macrophages pro-inflammatoires, l’augmentation de la phagocytose et de la présentation antigénique, et donc les réponses cytokiniques et humorales dirigées contre le biofilm. Par conséquent, il pourrait être utilisé comme immunothérapie néoadjuvante des chirurgies de remplacement de matériel infecté.
Pour l’ensemble des réponses testées, le MPS-PVP est significativement plus efficace que la vancomycine et ce avec un effet dose-dépendant.
Les auteurs abordent également dans leur étude la biosécurité de leur procédé thérapeutique, en montrant l’absence de lésions histologiques d’organes après traitement chez la souris. Davantage d’études sur la sécurité d’utilisation sont évidemment à envisager.
Enfin, des expériences complémentaires de cette étude suggèrent un faible effet du MPS-PVP sur le microbiote de l’hôte et sur la sélection de germes résistants, quasi-identique à celui du PBS, ce qui en fait un candidat de choix pour un traitement alternatif aux antibiotiques des infections de matériel.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- VanEpps JS, Younger JG. Implantable Device-Related Infection. Shock 2016 ; 46 : 597–608. [CrossRef] [PubMed] [Google Scholar]
- Hrynyshyn A, Simões M, Borges A. Biofilms in Surgical Site Infections: Recent Advances and Novel Prevention and Eradication Strategies. Antibiotics (Basel) 2022; 11 : 69. [CrossRef] [PubMed] [Google Scholar]
- Tremblay YDN, Hathroubi S, Jacques M. Bacterial biofilms: their importance in animal health and public health. Can J Vet Res 2014 ; 78 : 110–116. [PubMed] [Google Scholar]
- Zhang R, Wang C, Guan Y, et al. Manganese salts function as potent adjuvants. Cell Mol Immunol 2021; 18 : 1222–34. [CrossRef] [PubMed] [Google Scholar]
- Yao Y, Chen Z, Zhang H, et al. Selenium-GPX4 axis protects follicular helper T cells from ferroptosis. Nat Immunol 2021; 22 : 1127–39. [CrossRef] [PubMed] [Google Scholar]
- Li WH, Wu JJ, Wu L, et al. Black phosphorous nanosheet: A novel immune-potentiating nanoadjuvant for near-infrared-improved immunotherapy. Biomaterials 2021; 273 : 120788. [CrossRef] [PubMed] [Google Scholar]
- Yang C, Luo Y, Shen H, et al. Inorganic nanosheets facilitate humoral immunity against medical implant infections by modulating immune co-stimulatory pathways. Nat Commun 2022; 13 : 4866. [CrossRef] [PubMed] [Google Scholar]
- Moran GJ, Krishnadasan A, Gorwitz RJ, et al. Methicillin-resistant S. aureus infections among patients in the emergency department. N Engl J Med 2006 ; 355 : 666–674. [CrossRef] [PubMed] [Google Scholar]
- Wei J, Wen Y, Tong K, et al. Local Application of Vancomycin in One-Stage Revision of Prosthetic Joint Infection Caused by Methicillin-Resistant Staphylococcus aureus. Antimicrob Agents Chemother 2021; 65 : e0030321. [CrossRef] [PubMed] [Google Scholar]
- Bernard L, Arvieux C, Brunschweiler B, et al. Antibiotic Therapy for 6 or 12 Weeks for Prosthetic Joint Infection. N Engl J Med 2021; 384 : 1991–2001. [CrossRef] [PubMed] [Google Scholar]
- Srivastava K, Bozic KJ, Silverton C, et al. Reconsidering Strategies for Managing Chronic Periprosthetic Joint Infection in Total Knee Arthroplasty: Using Decision Analytics to Find the Optimal Strategy Between One-Stage and Two-Stage Total Knee Revision. J Bone Joint Surg Am 2019 ; 101 : 14–24. [CrossRef] [PubMed] [Google Scholar]
- Chalabi M, Fanchi LF, Dijkstra KK, et al. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med 2020; 26 : 566–76. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Activation par le MPS-PVP d’une immunité innée et adaptative dirigée contre les bactéries du biofilm. L’érosion du biofilm par le MPS-PVP permet l’exposition d’antigènes bactériens induisant une cascade de réponses pro-inflammatoires: augmentation des macrophages pro-inflammatoires M1, des cellules dendritiques matures, des lymphocytes T CD4+, des plasmocytes et plasmoblastes, diminution des lymphocytes T régulateurs, augmentation des taux sériques de cytokines pro-inflammatoires et des IgG et IgM. Les auteurs démontrent ainsi que le MPS-PVP induit l’activation d’une immunité innée et adaptative dirigée contre les bactéries du biofilm. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




