Figure 1.
Télécharger l'image originale
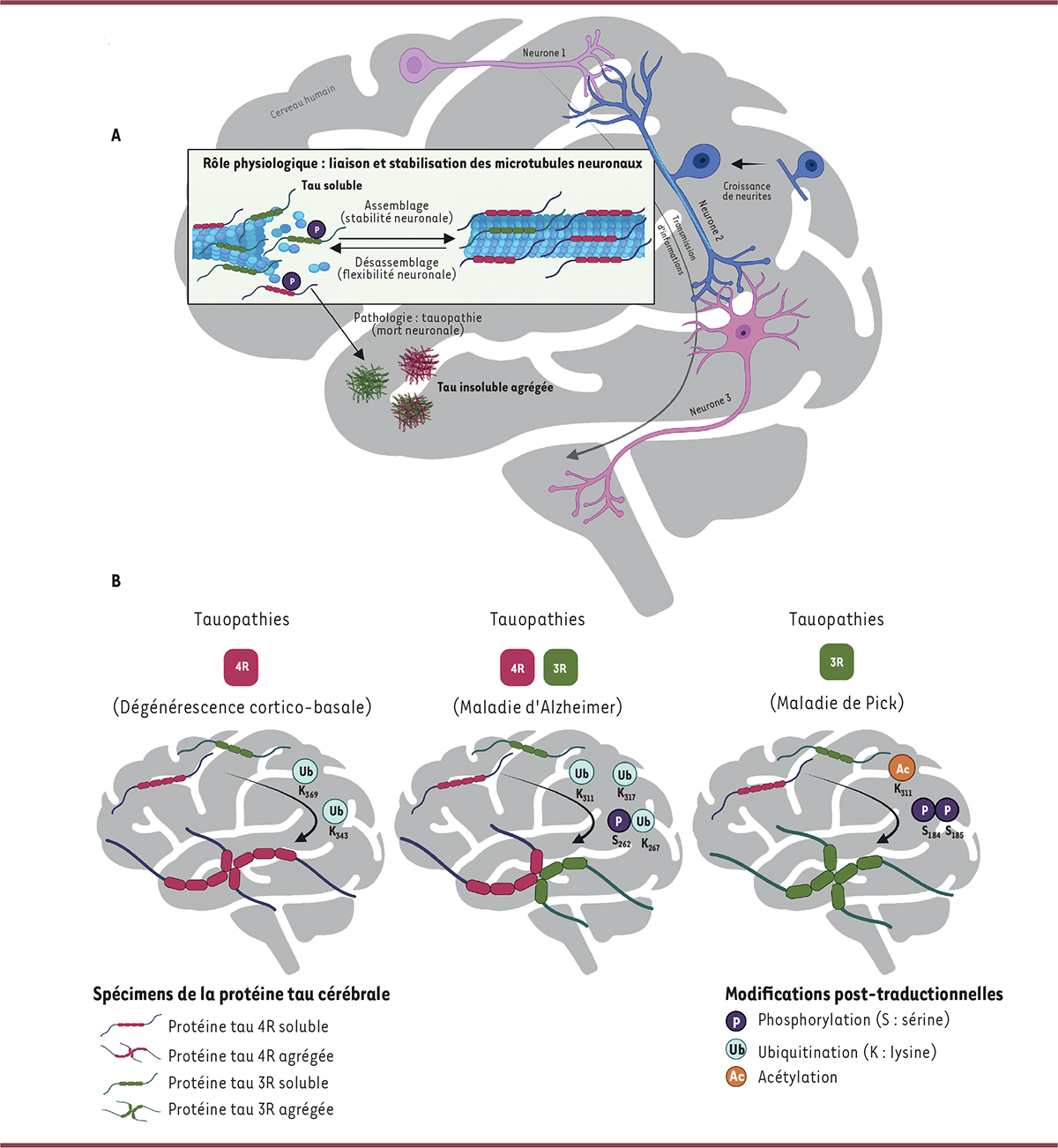
Modifications post-traductionnelles de la protéine tau cérébrale soluble spécifiques du type d’agrégats dans les tauopathies. A. La protéine tau est physiologiquement présente dans les neurones, où elle est directement impliquée dans la stabilisation et la polymérisation des microtubules, nécessaire à la croissance des neurites établissant des connections inter-neuronales pour la transmission des influx nerveux. Il existe deux groupes d’isoformes de la protéine, 4R et 3R, les isoformes 4R étant plus affines pour le microtubule, qu’elles stabilisent davantage, tandis que les isoformes 3R favorisent la flexibilité axonale. Une tauopathie implique le détachement de la protéine tau des microtubules, suivi de l’accumulation de celle-ci sous la forme d’agrégats insolubles, qui provoquent la mort des neurones. B. Les tauopathies sont classifiées en fonction des isoformes de la protéine tau qui s’agrègent : 4R-exclusives, mixtes 4R/3R ou 3R-exclusives. L’analyse post mortem, par spectrométrie de masse, des protéines tau solubles et agrégées après leur isolement et ségrégation à partir de cerveaux de personnes atteintes de tauopathies a montré que certaines modifications post-traductionnelles de la protéine tau soluble étaient spécifiques des tauopathies 4R (Ub-K369 et Ub-K343), 3R (Ac-K311 et P-S184+P-S185) et mixte 3R/4R (Ub-K267+P-S262, Ub-K317 et Ub-K311), malgré des quantités d’isoformes 4R et 3R de la protéine soluble similaires dans tous les types de tauopathies.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




