| Issue |
Med Sci (Paris)
Volume 40, Number 2, Février 2024
|
|
|---|---|---|
| Page(s) | 143 - 145 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023203 | |
| Published online | 27 February 2024 | |
Le chromosome Y ne contribue pas à la différence de longévité entre sexes chez la mouche drosophile
The Y chromosome has no impact on sex-specific longevity
Université Côte d’Azur, CNRS, Inserm, Institut de biologie Valrose, Nice, France
L’hypothèse de la « toxicité » du chromosome Y
Dans beaucoup d’espèces animales, la longévité varie selon le sexe. En particulier, les femmes vivent en moyenne plus longtemps que les hommes, dans tous les pays [1]. De plus, les personnes ayant un caryotype anormal XXY (syndrome de Klinefelter) ou XYY (syndrome de Jacob) ont une durée de vie moyenne réduite, respectivement de 2 et 10 ans [2]. Des méta-analyses compilant les données de 344 espèces de mammifères, d’oiseaux, de reptiles et d’amphibiens ont montré qu’il existe une forte association entre les chromosomes sexuels et la longévité. La durée de vie moyenne des individus du sexe homogamétique est supérieure d’environ 18 % à celle des individus du sexe hétérogamétique. Dans les espèces pour lesquelles le système de détermination du sexe est du type XX/XY, les mâles, qui sont hétérogamétiques (XY), meurent plus jeunes que les femelles, homogamétiques (XX). Inversement, chez les oiseaux et les reptiles, pour lesquels le système de détermination du sexe est du type ZZ/ZW, les mâles, qui sont homogamétiques (ZZ), vivent plus longtemps que les femelles, hétérogamétiques (ZW). Les chromosomes Y et W étant structurellement semblables, une corrélation a été établie entre chromosomes sexuels et durée de vie des individus [3, 4]. Une explication proposée repose sur l’existence d’une « toxicité » liée à la présence du chromosome Y chez les mâles. Le chromosome Y ne ressemble pas aux autres chromosomes : il ne contient qu’un petit nombre de gènes, et il est majoritairement constitué de séquences simples répétées et d’éléments transposables. L’ensemble est transcriptionnellement réprimé sous forme d’hétérochromatine.
Chez la mouche drosophile, il a été montré que cette hétérochromatine abondante du chromosome Y titre les facteurs hétérochromatiques, ce qui limite la formation de l’hétérochromatine sur les autres chromosomes. Cet effet du chromosome Y augmente avec l’âge, et certaines séquences répétées, incluant les éléments transposables, peuvent alors être exprimées de façon incorrecte chez les mâles âgés [5]. Par ailleurs, les éléments transposables réactivés auraient également la capacité de s’insérer dans d’autres chromosomes, créant une instabilité génomique, avec de potentiels effets délétères sur la durée de vie de l’individu [5]. Nous avons donc voulu tester cette hypothèse en modifiant la quantité de matériel génétique du chromosome Y pour mesurer l’impact de la présence de ce chromosome sur la longévité [6].
Une collection de chromosomes Y de différentes tailles chez la drosophile
Nous avons choisi la mouche drosophile, un organisme modèle qui présente plusieurs avantages pour notre objectif. La détermination du sexe et des caractères sexuels secondaires est génétique et ne dépend pas d’hormones stéroïdes. Elle ne repose pas sur la présence d’un chromosome Y, mais sur le nombre de chromosomes X : le mâle n’a qu’un seul chromosome X et la femelle en a deux. Un mâle dépourvu du chromosome Y (X0) reste un mâle. De plus, alors que le chromosome Y constitue moins de 2 % du génome de l’homme, il représente 13 % du génome de la drosophile mâle [6]. C’est donc un grand chromosome, riche en hétérochromatine et avec seulement 15 gènes fonctionnels, uniquement requis pour la spermatogenèse.
Pour tester l’hypothèse de la « toxicité » du chromosome Y, nous avons modifié sa taille et constitué une bibliothèque de chromosomes Y comportant de grandes délétions, à partir d’un chromosome Y unique et dans un contexte génétique homogène. Avec la technique CRISPR-Cas9, nous avons conçu différents ARN guides ciblant des séquences répétées spécifiques de plusieurs locus de ce chromosome et de son centromère afin de produire de trop nombreuses coupures, dépassant les capacités de réparation de la cellule et entraînant la perte de fragments ciblés de ce chromosome au fil des divisions cellulaires. Ces ARN guides et l’endonucléase Cas9 ont été exprimés dans la lignée germinale mâle, et par croisements, nous avons obtenu, en moyenne, 25 % de descendants porteurs de chromosomes Y modifiés (Figure 1A). Cette stratégie expérimentale nous a permis de créer une collection de mouches dépourvues du chromosome Y, ou avec un chromosome Y dont la longueur variait entre 21 % et 72 % de celle du chromosome d’origine, qui ont été validées par cytométrie en flux.
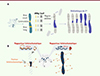 |
Figure 1. Obtention de chromosomes Y de différentes tailles chez la drosophile par une stratégie utilisant la technique CRISPR-Cas9. A. Des lignées de drosophiles avec des chromosomes Y de différentes tailles Y* ont été établies en utilisant la technique CRISPR-Cas9 pour produire des délétions du chromosome Y. Les régions colorées en jaune correspondent à des séquences répétées spécifiques de ce chromosome et ciblées par les ARN guides (ARNg). B. Le chromosome Y affecte la formation d’hétérochromatine dans les autres chromosomes en séquestrant plus ou moins les facteurs hétérochromatiques selon sa taille. L’expression d’un rapporteur (white) inséré dans l’hétérochromatine de ces autres chromosomes permet de visualiser sa formation. |
Rappelons que le chromosome Y peut capter et titrer les facteurs hétérochromatiques présents en quantité limitée dans la cellule [7]. La titration est proportionnelle à la taille de ce chromosome, et modifie la formation d’hétérochromatine dans les autres chromosomes [8]. Des gènes rapporteurs d’expression insérés dans l’hétérochromatine des autosomes permettent de mesurer la présence d’une hétérochromatine répressive de la transcription (Figure 1B). Avec cette collection de chromosomes Y porteurs de délétions de différentes tailles, nous avons constaté que l’expression de ces gènes rapporteurs était corrélée avec la longueur du chromosome Y. Ce résultat validait notre stratégie expérimentale puisqu’une modification de la taille de ce chromosome affectait la formation de l’hétérochromatine et l’expression de gènes situés sur d’autres chromosomes.
La taille du chromosome Y ne modifie pas la longévité des drosophiles
L’obtention de ces délétions permet également de tester certains caractères présentant un dimorphisme sexuel, tels que la taille et le poids. Dans les lignées de mouches dont les chromosomes Y étaient de tailles différentes, nous n’avons observé aucune modification de ces caractères par rapport aux mâles témoins. Nous n’avons pas non plus constaté de modification de la longévité des mâles de notre collection, quelle que soit la taille de leur chromosome Y, y compris en son absence (mâles XO) (Figure 2A). Afin de confirmer ces observations, nous avons produit des mâles XYY possédant un chromosome Y surnuméraire, chez lesquels la quantité d’hétérochromatine de ce chromosome est doublée, représentant environ un quart du génome, ce qui était susceptible d’entraîner un effet « supertoxique ». Mais là encore, la durée de vie des mâles XYY était inchangée par rapport à celle des témoins XY et XO. Enfin, pour tester directement l’implication de la quantité d’hétérochromatine, nous avons généré des individus avec des chromosomes Y de différentes tailles dans un contexte mutant où la quantité de facteurs hétérochromatiques était réduite de moitié. Or cette condition ne changeait pas non plus la durée de vie des mâles. Ces résultats indiquent que la présence du chromosome Y n’est pas impliquée dans la longévité des drosophiles mâles, et permettent d’écarter l’hypothèse de la « toxicité » de ce chromosome résultant de sa structure hétérochromatique.
 |
Figure 2. Le chromosome Y n’est pas impliqué dans les différences phénotypiques entre sexes chez la drosophile. A. Des chromosomes Y de différentes tailles ont été utilisés, chez la drosophile, pour étudier des phénotypes dimorphiques, comme la taille et la durée de vie. Aucun de ces phénotypes n’est modifié par la taille du chromosome Y. B. Les femelles XX sont « masculinisées » en inactivant par mutation le gène tra codant le déterminant sexuel femelle transformer (mutants traKO). Des mâles XY sont « féminisés » par l’expression forcée de ce gène (traF). Les individus de phénotype femelle (traF), quel que soit leur sexe chromosomique (XX ou XY), vivent plus longtemps que les individus de phénotype mâle (traKO) XX ou XY. |
Le sexe phénotypique contrôle la durée de vie des individus
Comme l’écart de longévité entre les sexes n’est pas dépendant du sexe chromosomique, nous avons cherché à savoir si le facteur décisif est le sexe phénotypique. La présence des chromosomes sexuels conditionne l’expression d’une cascade de gènes qui établissent les caractères dimorphiques anatomiques et comportementaux propres à chaque sexe. Chez la drosophile, la présence de deux chromosomes X déclenche la synthèse de l’isoforme « femelle » du facteur d’épissage transformer (traF), déterminant principal de l’identité phénotypique femelle. Des manipulations génétiques de ce déterminant sexuel permettent de découpler le sexe chromosomique du sexe phénotypique. En effet, les femelles XX porteuses de la mutation inactivatrice de traF ont un phénotype mâle, et inversement, les mâles XY avec une expression forcée de traF ont un phénotype femelle. En utilisant cette approche génétique, nous avons constaté que les femelles « masculinisées » (mutantes pour traF) ont une durée de vie réduite par rapport à des femelles de génotype « sauvage ». Inversement, les mâles « féminisés » par l’expression forcée de traF ont une longévité accrue (Figure 2B). De plus, les longévités des femelles XX de génotype sauvage et des mâles XY « féminisés »étaient identiques. Ces résultats permettent de conclure que c’est le sexe phénotypique, et non la présence du chromosome Y, qui détermine la différence de longévité entre les sexes.
Perspectives
L’absence d’effet du chromosome Y sur la longévité chez la drosophile est un argument fort pour rejeter l’hypothèse d’un effet toxique de ce chromosome dans la plupart des espèces, puisque le chromosome Y y est souvent beaucoup plus petit. Nous avons découvert que l’écart de longévité entre les sexes chez la drosophile est conditionné par le sexe phénotypique et par l’expression du déterminant sexuel transformer. Il convient désormais de rechercher par quels mécanismes ce déterminant sexuel assigne la longévité dans cette espèce. Ces découvertes pourront vraisemblablement éclairer le dimorphisme sexuel de longévité dans d’autres espèces, pour lesquelles d’autres déterminants sexuels joueraient des rôles équivalents.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Ces travaux ont été financés par l’université Côte d’Azur, le CNRS (ATIP-Avenir programme), l’Inserm, la Commission européenne (ERC starting grant CellSex, grant no. ERC-2019-STG 850 934) et l’ANR (LABEX SIGNALIFE ANR-11-LABX-0028-01 et IDEX UCAJedi ANR-15-IDEX-01).
Références
- Austad SN, Fischer KE. Sex differences in lifespan. Cell Metab 2016 ; 23 : 1 022–033. [Google Scholar]
- Stochholm K, Hjerrild B, Mortensen KH, et al. Socioeconomic parameters and mortality in Turner syndrome. Eur J Endocrinol 2012 ; 166 : 1 013–019. [Google Scholar]
- Xirocostas ZA, Everingham SE, Moles AT. The sex with the reduced sex chromosome dies earlier : a comparison across the tree of life. Biol Lett 2020; 16 : 20190867. [CrossRef] [PubMed] [Google Scholar]
- Pipoly I, Bokony V, Kirkpatrick M, et al. The genetic sex-determination system predicts adult sex ratios in tetrapods. Nature 2015 ; 527 : 91–94. [CrossRef] [PubMed] [Google Scholar]
- Brown EJ, Nguyen AH, Bachtrog D. The Y chromosome may contribute to sex-specific ageing in Drosophila. Nat Ecol Evol 2020; 4 : 853–62. [CrossRef] [PubMed] [Google Scholar]
- Delanoue R, Clot C, Leray C, et al. Y chromosome toxicity does not contribute to sex-specific differences in longevity. Nat Ecol Evol 2023; 7 : 1 245–56. [Google Scholar]
- Elgin SCR, Reuter G. Position-effect variegation, heterochromatin formation, and gene silencing in Drosophila. Cold Spring Harb Perspect Biol 2013 ; 5 : a017780. [PubMed] [Google Scholar]
- Dimitri P, Pisano C. Position effect variegation in Drosophila melanogaster : relationship between suppression effect and the amount of Y chromosome. Genetics 1989 ; 122 : 793–800. [CrossRef] [PubMed] [Google Scholar]
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Obtention de chromosomes Y de différentes tailles chez la drosophile par une stratégie utilisant la technique CRISPR-Cas9. A. Des lignées de drosophiles avec des chromosomes Y de différentes tailles Y* ont été établies en utilisant la technique CRISPR-Cas9 pour produire des délétions du chromosome Y. Les régions colorées en jaune correspondent à des séquences répétées spécifiques de ce chromosome et ciblées par les ARN guides (ARNg). B. Le chromosome Y affecte la formation d’hétérochromatine dans les autres chromosomes en séquestrant plus ou moins les facteurs hétérochromatiques selon sa taille. L’expression d’un rapporteur (white) inséré dans l’hétérochromatine de ces autres chromosomes permet de visualiser sa formation. |
| Dans le texte | |
 |
Figure 2. Le chromosome Y n’est pas impliqué dans les différences phénotypiques entre sexes chez la drosophile. A. Des chromosomes Y de différentes tailles ont été utilisés, chez la drosophile, pour étudier des phénotypes dimorphiques, comme la taille et la durée de vie. Aucun de ces phénotypes n’est modifié par la taille du chromosome Y. B. Les femelles XX sont « masculinisées » en inactivant par mutation le gène tra codant le déterminant sexuel femelle transformer (mutants traKO). Des mâles XY sont « féminisés » par l’expression forcée de ce gène (traF). Les individus de phénotype femelle (traF), quel que soit leur sexe chromosomique (XX ou XY), vivent plus longtemps que les individus de phénotype mâle (traKO) XX ou XY. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




