| Issue |
Med Sci (Paris)
Volume 40, Number 1, Janvier 2024
La cavité orale et les dents au cœur de la santé
|
|
|---|---|---|
| Page(s) | 10 - 15 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023189 | |
| Published online | 01 February 2024 | |
Les dents et le milieu buccal au cœur de la santé globale
Teeth and oral cavity at the heart of systemic health
1
Université Toulouse III Paul Sabatier, faculté de santé, département odontologie, Toulouse, France
2
Service d’odontologie, hôpitaux de Toulouse, Toulouse, France
3
InCOMM ( Intestine ClinicOmics Microbiota & Metabolism), UMR1297 Inserm/université Toulouse III, French Institute of Metabolic and Cardiovascular Diseases (i2MC), Toulouse, France
4
URU Evolsan, équipe analyse des pratiques, université Toulouse III Paul Sabatier, Toulouse, France
*
thibault.canceill@univ-tlse3.fr
La recherche autour des interrelations existant entre les maladies orales et les maladies systémiques connaît une croissance exponentielle depuis plus de vingt ans. Les dents et leurs tissus de soutien peuvent être atteints de maladies, notamment infectieuses, dont les conséquences se font ressentir localement, dans la cavité buccale, mais aussi à distance dans l’organisme. Ces maladies conduisent fréquemment à l’entretien d’un état inflammatoire dans la cavité orale qui complique les traitements de maladies inflammatoires systémiques. L’objectif de cette revue est de dresser un état des lieux des connaissances actuelles concernant les interrelations qui peuvent exister, chez l’adulte comme chez l’enfant.
Abstract
Research into the interrelationships between oral and systemic diseases has been growing exponentially for over 20 years. Teeth and their supporting tissues can be affected by pathologies, particularly infectious ones, the consequences of which are felt locally in the oral cavity and at a distance in the body. Oral diseases frequently lead to the maintenance of an inflammatory state in oral bones and mucosa, which complicates the treatment of systemic inflammatory pathologies. The aim of this review is to take stock of current knowledge concerning the interrelationships that may exist between the oral environment and other organs, in both adults and children.
© 2024 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Thibault Canceill).
Le milieu buccal a pour particularité d’être un milieu contaminé puisqu’il regroupe une niche bactérienne très riche contenant plus de 500 espèces différentes [1]. La composition exacte de ce microbiote est très variable selon les individus car elle dépend notamment de son âge, de ses habitudes hygiéno-diététiques ou de son activité physique [2]. À l’état physiologique, ces microorganismes cohabitent avec l’organisme hôte de façon symbiotique mais, lors d’une désorganisation de l’écosystème buccal, certaines bactéries prolifèrent et exercent une virulence plus importante vis-à-vis des tissus. L’état de symbiose est stabilisé lorsqu’il existe un équilibre entre la prolifération des espèces bactériennes et les capacités immunitaires de l’hôte. En revanche, en cas de dysbiose, les bactéries dont la prolifération devient incontrôlable par l’organisme de l’individu varient selon les tissus concernés et les affections. Dans le cadre de lésions carieuses, les bactéries des types Streptococcus mutans, Streptococcus sobrinus et Lactobacillus sont parmi les plus retrouvées [3]. Dans le cas de parodontites, ce sont surtout des bactéries anaérobies strictes Gram négatif, en particulier les Fusobacterium, les Porphyromonas, ou les Prevotella, qui prolifèrent [4].
L’organe dentaire et ses tissus de soutien
L’être humain possède, à l’âge adulte, 32 dents réparties en huit incisives, quatre canines, huit prémolaires et douze molaires. L’enfant, en denture temporaire, possède vingt dents sans prémolaires et avec seulement huit molaires. Pour toutes les dents, la couronne correspond à la partie visible dans la cavité buccale et la racine à la partie intra-osseuse. Les dents sont qualifiées de mono ou pluriradiculées selon le nombre de racines qu’elles présentent, et de mono ou pluricuspidées selon le nombre de cuspides présentes sur la couronne. La jonction entre couronne et racine est appelée collet.
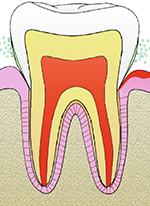
Une dent est toujours constituée de trois tissus : l’émail, la dentine, et le tissu pulpaire (Figure 1). L’émail est le tissu le plus dur de l’organisme [5] : il contient plus de 97 % de composés minéraux, essentiellement de l’hydroxyapatite [6] (→).
(→) Voir la Synthèse de G. Lignon et al., m/s n° 5, mai 2015, page 515
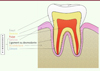 |
Figure 1. Représentation schématique de l’anatomie d’une dent et de son parodonte (coupe sagittale). |
On ne le retrouve que sur la couronne, à la différence de la dentine, tissu sous-jacent présent aussi bien au niveau coronaire que radiculaire. La dentine est constituée à 70 % de composés minéraux (là aussi de type hydroxyapatite) et à 30 % de composés organiques, notamment de collagène de type 1 [7]. La structure de ce tissu est organisée en tubules qui contiennent les prolongements des odontoblastes, les cellules responsables de la production de dentine [8] (→)
(→) Voir la Synthèse de J.C. Maurin et al., m/s n° 3, mars 2013, page 293
et dont les corps cellulaires sont situés en périphérie du tissu central de la dent : le tissu pulpaire. L’apposition de dentine se fait tout au long de la vie, ce qui n’est pas le cas de l’émail. La pulpe étant un tissu richement vascularisé et innervé, elle est considérée comme responsable de la vitalité de la dent. Avec le temps et les agressions potentiellement subies par une dent, une apposition dentinaire, dite tertiaire, se produit autour de la cavité pulpaire, conduisant à une calcification du tissu pulpaire.
Chacune des faces d’une dent possède ses propres reliefs anatomiques destinés à faciliter son intégration dans la cavité buccale et à optimiser le rôle de la dent lors des fonctions de mastication, de phonation et de déglutition. L’espace entre deux dents, occupé ou non par un feston de gencive, est appelé embrasure proximale. Les faces proximales des dents, en regard de l’embrasure, entrent en contact rapproché pour former le point de contact, protéger la gencive sous-jacente et permettre la transmission des forces occlusales le long de l’arcade.
Chez l’enfant, les dents temporaires apparaissent très tôt sur l’arcade. C’est aux alentours de six mois que la première dent fait son éruption : il s’agit généralement de l’incisive centrale mandibulaire. Les dents temporaires présentent les mêmes éléments anatomiques que les dents permanentes, mais quelques différences sont notables. Elles sont plus petites et ne présentent pas de point de contact entre elles. Leur aspect est plus globuleux et leur teinte plus laiteuse (d’où le terme de « dent de lait »). La pulpe a également un volume plus important, ce qui explique son atteinte plus rapide lors d’une lésion carieuse. Les molaires temporaires, au nombre de huit, présentent des racines très divergentes, ce qui laisse la place au germe de la dent définitive sous-jacente. Au cours de son éruption, la dent définitive résorbe les racines de la dent temporaire, permettant son exfoliation. Généralement, c’est encore l’incisive centrale mandibulaire qui s’exfolie en premier aux alentours de six ans. C’est également lors de cette même période que les premières molaires permanentes font leur éruption, sans remplacer de dents lactéales.
Les dents sont ancrées dans leurs arcades par l’intermédiaire de quatre tissus regroupés sous le nom de parodonte. Deux de ces tissus sont des tissus mous (la gencive et le ligament desmodontal) et deux sont des tissus durs (le cément et l’os alvéolaire) (Figure 1). Anatomiquement, les quatre tissus sont faciles à distinguer dans la mesure où la gencive constitue le parodonte superficiel et les trois autres le parodonte profond [9]. La gencive est un tissu kératinisé reposant sur un conjonctif riche en fibres de collagène dont la fonction principale est de constituer une barrière physique contre les bactéries et les fluides de la cavité buccale et ainsi protéger les tissus du parodonte profond [10]. Le tissu gingival est riche en cellules immunitaires qui sont susceptibles de réagir rapidement en cas d’agression bactérienne marginale autour des dents [9]. L’interface entre la gencive et les autres tissus du parodonte se situe autour du collet anatomique de la dent, c’est-à-dire au niveau de la jonction amélo-cémentaire, et prend la forme d’un épithélium sulculaire, qui tire son nom d’un espace situé le long de la gencive autour de l’émail : le sulcus. En conditions physiologiques, cet épithélium est étanche pour continuer de conférer à la gencive son rôle protecteur des tissus du parodonte profond. Le sulcus est baigné d’un fluide, dit fluide gingival, riche en ions, débris cellulaires et microorganismes, notamment, qui ne peut pas traverser la barrière épithéliale [11]. L’effet de châsse salivaire emporte régulièrement le fluide gingival dans la cavité orale des individus, éliminant ainsi les éléments indésirables présents autour des tissus dentaires.
Le cément, tissu dur du parodonte profond, recouvre la racine de la dent et présente deux zones distinctes : une zone acellulaire, dite cément primaire, et une zone cellulaire, dite cément secondaire [9]. Ce second type de cément, situé autour de la partie apicale de la racine de la dent, présente la particularité de pouvoir être formé tout au long de la vie, pour compenser l’usure occlusale naturelle des dents ou l’absence de contacts occlusaux antagonistes [12]. Le cément est majoritairement composé de fibres de collagène minéralisées, de matrice extracellulaire et d’autres protéines comme le CGF (cementum-derived growth factor) ou la CAP (cementum attachment protein) [13]. Radiologiquement, le cément présente une épaisseur trop fine pour être distingué des tissus de la dent (Figure 2).
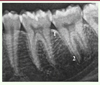 |
Figure 2. Extrait d’une radiographie panoramique montrant les dents #35, 36 et 37. La corticale de l’os alvéolaire est clairement identifiable (1), ainsi que l’espace radio-clair autour des racines correspondant au desmodonte (2). |
Autour des racines dentaires et donc du cément, se situe l’os alvéolaire, principal responsable du volume tissulaire dessinant le contour des dents et la morphologie des arcades. Cet os est composé d’une fine corticale distinguable tout autour des dents, encerclant de plus importants volumes trabéculaires (Figure 2). La vascularisation de cet os provient à la fois des vaisseaux de son réseau trabéculaire et des micro-vaisseaux présents dans le ligament parodontal. L’apposition osseuse dépend largement des sollicitations masticatoires, c’est pourquoi son volume décroît lorsque les dents sont extraites [14]. Il est commun de dire que l’os alvéolaire vit et meurt avec les dents. Anatomiquement, il est impossible de distinguer une limite entre les bases osseuses (os maxillaire et mandibule) et l’os alvéolaire. Seuls les festons osseux présents autour et entre les dents sont clairement identifiables.
Les fibres du ligament parodontal, ou desmodonte, font le lien entre l’os alvéolaire et le cément avec, pour intérêt, d’amortir les forces reçues par les dents au cours des mouvements masticatoires et de les transmettre au tissu osseux environnant [15]. Au niveau du cément acellulaire, ces fibres forment un réseau appelé fibres de Sharpey. Le ligament est vascularisé et richement innervé, ce qui le rend responsable de la proprioception péri-dentaire [15]. La matrice interfibrillaire du desmodonte assure également un rôle majeur dans l’homéostasie parodontale et la réponse à d’éventuelles agressions. Elle est en effet riche en cellules, notamment en fibroblastes, en cellules stromales mésenchymateuses de desmodonte ainsi qu’en cellules immunitaires.
L’architecture des tissus dentaires et parodontaux est donc riche et diversifiée. La capacité de ces tissus à répondre à des agressions bactériennes est cependant très variable, certains étant pourvus de cellules et d’autres pas.
Les atteintes de la dent et le risque d’infection à distance
D’après l’OMS (Organisation mondiale de la santé), la carie est l’affection bucco-dentaire la plus présente dans la population mondiale [16], bien qu’elle soit aussi la plus évitable. Il s’agit d’une affection complexe qui dépend de l’équilibre entre les différents facteurs produits par les bactéries du biofilm dentaire, dont les facteurs d’agression des bactéries cariogènes, influencé par les défenses de l’hôte mais aussi par l’alimentation [17, 18. La rupture de cet équilibre, ou dysbiose, est en effet associée à une consommation excessive de sucres ou à une mauvaise hygiène bucco-dentaire. Les caries sont à l’origine de la déminéralisation des tissus durs de la dent. La cavité ainsi créée peut se limiter à l’émail mais aussi atteindre des tissus plus profonds, jusqu’à la dentine (Figure 3), pouvant alors entraîner les premières sensibilités en réponse aux changements de température, ou lors de la consommation de sucre, par exemple. À ce stade, la prise en charge est simple et se fait au fauteuil, par simple éviction carieuse suivie d’une restauration de la dent. Lorsque la lésion carieuse progresse, elle peut léser la pulpe provoquant une pulpite irréversible : les sensibilités deviennent alors des douleurs continues très importantes, spontanées, augmentant au décubitus. Le traitement d’urgence consiste en l’éviction carieuse ainsi qu’en l’exérèse complète de la pulpe inflammatoire, ou pulpotomie. Par la suite, le traitement endodontique permettra de pérenniser la survie de la dent sur l’arcade.
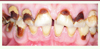 |
Figure 3. Lésions carieuses dentinaires des faces vestibulaires des dents chez un patient de 30 ans. |
Si la pulpotomie n’est pas réalisée et/ou le processus se chronicise, la pulpe risque d’être contaminée par les bactéries cariogènes, entraînant sa nécrose. La prolifération bactérienne jusqu’à l’apex de la racine peut provoquer un abcès apical, dont les stades, très variés, conduisent peu ou prou aux mêmes symptômes de douleurs à la mastication, de gonflement de la gencive, voire d’extension au visage, d’apparition de ganglions lymphatiques cliniquement perceptibles, ou encore de fièvre. Devant de telles infections, alors localisées dans le tissus osseux autour des dents, le recours à une antibiothérapie devient nécessaire, en plus d’un acte thérapeutique, comme le drainage de la collection suppurée par exemple. Par la suite et toujours afin de pérenniser la survie de la dent sur l’arcade, un traitement endodontique devra être effectué. Ces épisodes infectieux peuvent se produire sur une dent déjà dévitalisée, en cas de nouvelle colonisation bactérienne, au niveau du matériau d’obturation de la racine. La gravité des infections (primaires ou réinfections) au niveau dentaire n’est pas anodine. Elles peuvent constituer la source bactérienne de nombreuses infections à distance, telles qu’une sinusite d’origine dentaire [19], l’infection de prothèses orthopédiques [20] ou un abcès cérébral [21]. La cavité buccale serait également la source d’endocardite infectieuse dans 10 à 35 % des cas [22]. Chez les patients à haut risque d’endocardite infectieuse, de nombreux actes dentaires et chirurgicaux sont donc contre-indiqués ou nécessiteront la mise en place d’une antibioprophylaxie [23].
Pour la prévention de la maladie carieuse, les méthodes d’hygiène bucco-dentaire et les comportements alimentaires sont essentiels. Un brossage régulier biquotidien avec une brosse à dents souple et un dentifrice contenant du fluor ainsi qu’une alimentation peu sucrée, peu acide et sans grignotage, sont les conseils à prodiguer aux patients, y compris aux enfants dès leur plus jeune âge. La carie touche en effet les dents de lait avec des symptômes similaires à ceux de l’adulte. Lorsque la carie est prise en charge rapidement, son éviction et la mise en place d’une restauration peuvent être suffisantes. Toutefois, chez l’enfant, la nécrose pulpaire est plus rapide que chez l’adulte. Elle peut être à l’origine d’infections importantes de la face, conduisant souvent à une cellulite d’origine dentaire (Figure 4). Sa prise en charge repose alors sur une antibiothérapie, suivie de l’avulsion de la dent causale, ou de son traitement endodontique, lorsque cela est possible. Il est important d’informer les patients et les parents de la nécessité du traitement de l’infection d’une dent temporaire car celle-ci pourrait avoir des répercussions sur les dents définitives sous-jacentes.
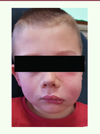 |
Figure 4. Cellulite génienne haute de l’hémiface gauche d’un enfant de six ans automédiqué par ses parents avec de l’ibuprofène sans couverture antibiotique. |
Les maladies du parodonte et leur incidence sur la santé générale
Un biofilm bactérien se développe dans la cavité buccale, à la surface des dents et des muqueuses [24] (→).
(→) Voir la Synthèse de D. Lebeaux et J.M. Ghigo, m/s n° 8-9, août-septembre 2012, page 727
Dans certaines conditions, notamment lorsque l’hygiène bucco-dentaire est perfectible, la composition de ce biofilm se modifie. Il se minéralise, étant alors à l’origine de la formation de tartre. Le brossage des dents permet de désorganiser ce biofilm lorsqu’il est fraîchement formé mais il devient inefficace lorsque le tartre est produit. La prolifération, plus importante et prolongée, de certaines espèces bactériennes, au niveau du tartre, conduit à une inflammation gingivale, ou gingivite (Figure 5A).
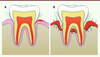 |
Figure 5. Représentations schématiques des deux principales affections parodontales. (A) La gingivite concerne uniquement la gencive marginale, alors que la parodontite (B) (qu’elle qu’en soit sa forme) est liée à une destruction de tous les tissus de soutien de la dent. |
La persistance de l’état de dysbiose du microbiote en contact avec le parodonte est l’une des premières conditions au développement des parodontites, des affections immuno-infectieuses liées à un déséquilibre entre le facteur étiologique bactérien et les défenses immunitaires de l’hôte [25]. Les bactéries infectent alors l’espace sous-gingival, entraînent l’apparition de poches parodontales, et entretiennent un état inflammatoire qui se traduit par des saignements des gencives (Figure 5B). Les parodontites conduisent toutes à la destruction progressive des tissus de soutien des dents, au déchaussement et la mobilité dentaires, voire à la perte des dents dans le plus avancé des cas (Figure 6) [26]. Leur classification très ramifiée [27, 28 a été remaniée depuis 2017 afin d’y adjoindre les relations existant entre troubles de la cavité buccale et maladies systémiques associées [29, 30. Le parodonte est en effet désormais considéré comme le reflet de la santé générale des patients. La maladie parodontale est par exemple la sixième complication du diabète [31] et certaines maladies parodontales nécrotiques (gingivite ulcéro-nécrotique, parodontite ulcéro-nécrotique) peuvent être la traduction d’une affection sous-jacente plus grave, telle qu’une leucémie ou un syndrome d’immunodéficience acquise.
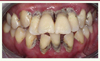 |
Figure 6. Photographie endobuccale de la denture d’une patiente souffrant d’une parodontite. |
L’existence de liens entre le développement ou l’aggravation de maladies systémiques et la survenue d’une dysbiose de la flore orale a été montrée [4]. Ces relations reposeraient sur un état inflammatoire de bas grade, entretenu au niveau de l’organisme, dont la résolution est rendue difficile par la présence d’une inflammation active des tissus de la cavité orale. Certains auteurs suggèrent que des microorganismes présents dans la cavité orale pourraient se propager à d’autres organes par la circulation sanguine, ou libérer certains composés qui migreraient et induiraient des complications à distance [32], comme le lipopolysaccharide (LPS), une endotoxine des bactéries Gram négatif responsable de réactions inflammatoires.
De nombreuses maladies ont ainsi été reliées à une dysbiose orale. C’est le cas, par exemple, de la polyarthrite rhumatoïde [33], de la bronchopneumopathie chronique obstructive [34], de complications obstétricales [35, 36, de la maladie d’Alzheimer [37], des maladies inflammatoires chroniques de l’intestin [38] et, surtout, des maladies métaboliques et des maladies cardiovasculaires.
Les maladies métaboliques regroupent un ensemble de troubles qui affectent les fonctions cellulaires impliquées dans la production et le stockage énergétiques. Le syndrome métabolique est défini par l’existence chez un patient d’au moins trois des troubles que sont l’obésité, l’hypertriglycéridémie, l’hypertension artérielle, l’hyperglycémie, un faible taux sanguin de cholestérol HDL (high-density lipoproteins). La corrélation entre maladies métaboliques et maladies parodontales a été confirmée par plusieurs équipes [39]. Comparés à des sujets sains, chez les patients diabétiques [40], ou chez les patients obèses [41], on observe en effet des différences de composition de flore buccale (avec des distinctions selon le genre). Bien que les mécanismes moléculaires permettant d’expliquer ces relations restent encore incompris [42], il semble que le maintien d’une inflammation de la cavité buccale participe à l’entretien d’une inflammation systémique, elle-même à l’origine d’une insulino-résistance, de troubles vasculaires et de troubles métaboliques. Inversement, la résolution d’une inflammation orale s’avère plus compliquée en présence d’une inflammation systémique persistante [43]. Chez des patients diabétiques, le traitement d’une parodontite n’est cependant pas suffisant pour améliorer l’équilibre glycémique [44].
Les maladies cardiovasculaires (MCV) représentent la première cause de décès dans le monde. Elles sont associées à de nombreux facteurs de risques, comme le genre, l’âge, le statut alcoolo-tabagique ou encore le surpoids et l’obésité [45]. Récemment, un lien entre MCV et dysbiose du microbiote oral a été mis en évidence faisant de la dysbiose orale un facteur de risque de développer des troubles cardiovasculaires [46]. Des agents pathogènes parodontaux (Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, Tannerella forsythia, Prevotella intermedia, Treponema denticola et Fusobacterium nucleatum) ont en effet été retrouvés dans des plaques d’athérome de patients [47, 48, augmentant la morbidité de leur maladie athérosclérosique. De même, l’inflammation des tissus du parodonte est à l’origine d’une augmentation des concentrations systémiques de cytokines pro-inflammatoires, telles que l’IL (interleukine)-1β, l’IL-6, l’IL-8, le TNF-α (tumor necrosis factor alpha) et MCP-1 (monocyte chemoattractant protein-1, ou CCL2 [C-C motif chemokine ligand 2]) avec pour conséquence une production importante de la CRP sanguine (protéine C réactive) [49].
Conclusion
Des liens étroits existent entre l’organe dentaire et ses tissus de soutien et la santé globale de l’individu. L’essentiel des interactions établies entre la cavité orale et le reste de l’organisme est lié à une inflammation déclenchée par la prolifération de certaines espèces bactériennes qui ont profité d’un déséquilibre de l’état de symbiose existant entre espèces peuplant le microbiote oral. Un bilan bucco-dentaire, voire la réalisation de soins par un chirurgien-dentiste, sont désormais préconisés pour optimiser la réponse du patient à sa maladie.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Fåk F, Tremaroli V, Bergström G, et al. Oral microbiota in patients with atherosclerosis. Atherosclerosis 2015; 243 : 573–8. [CrossRef] [PubMed] [Google Scholar]
- Feres M, Teles F, Teles R, et al. The subgingival periodontal microbiota of the aging mouth. Periodontol 2000 2016; 72 : 30–53. [CrossRef] [PubMed] [Google Scholar]
- Selwitz RH, Ismail AI, Pitts NB. Dental caries. Lancet 2007; 369 : 51–9. [CrossRef] [Google Scholar]
- Lamont RJ, Koo H, Hajishengallis G. The oral microbiota : dynamic communities and host interactions. Nat Rev Microbiol 2018; 16 : 745–59. [CrossRef] [PubMed] [Google Scholar]
- Zhang YF, Zheng J, Yu JX, et al. Impact of strain rate on the hardness and elastic modulus of human tooth enamel. J Mech Behav Biomed Mater 2018; 78 : 491–5. [CrossRef] [PubMed] [Google Scholar]
- Lignon G, Dure-Molla M de la, Dessombz A, et al. L’émail — Un autoassemblage unique dans le monde du minéral. Med Sci (Paris) 2015; 31 : 515–21. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Goldberg M, Kulkarni AB, Young M, et al. Dentin : structure, composition and mineralization. Front Biosci 2011; 3 : 711–35. [CrossRef] [Google Scholar]
- Maurin JC, Couble ML, Thivichon-Prince B, et al. L’odontoblaste — Un acteur incontournable de la perception de la douleur dentinaire. Med Sci (Paris) 2013; 29 : 293–9. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Nanci A, Bosshardt DD. Structure of periodontal tissues in health and disease. Periodontol 2000 2006; 40 : 11–28. [CrossRef] [PubMed] [Google Scholar]
- Preshaw PM. Antibiotics in the treatment of periodontitis. Dent Update 2004; 31 : 448–56. [CrossRef] [PubMed] [Google Scholar]
- Taylor JJ, Preshaw PM. Gingival crevicular fluid and saliva. Periodontology 2000 2016; 70 : 7–10. [CrossRef] [PubMed] [Google Scholar]
- Foster BL. On the discovery of cementum. J Periodontal Res 2017; 52 : 666–85. [CrossRef] [PubMed] [Google Scholar]
- Arzate H, Zeichner-David M, Mercado-Celis G. Cementum proteins : role in cementogenesis, biomineralization, periodontium formation and regeneration. Periodontol 2000 2015; 67 : 211–233. [CrossRef] [PubMed] [Google Scholar]
- Lindhe J, Lang NP. Clinical Periodontology and Implant Dentistry, 2 Volume Set. 6th Edition. Chichester, West Sussex; Ames, Iowa : Wiley-Blackwell, 2015 : 1480 p. [Google Scholar]
- Jong T de, Bakker AD, Everts V, et al. The intricate anatomy of the periodontal ligament and its development : Lessons for periodontal regeneration. J Periodontal Res 2017; 52 : 965–74. [CrossRef] [PubMed] [Google Scholar]
- OMS. Santé bucco-dentaire. https://www.who.int/fr/news-room/fact-sheets/detail/oral-health. [Google Scholar]
- Marsh PD, Zaura E. Dental biofilm : ecological interactions in health and disease. J Clin Periodontol 2017; 44 : S12–S22. [CrossRef] [PubMed] [Google Scholar]
- Takahashi N, Nyvad B. The Role of Bacteria in the Caries Process : Ecological Perspectives. J Dent Res 2011; 90 : 294–303. [CrossRef] [PubMed] [Google Scholar]
- Aukštakalnis R, Simonavičiūxtė R, Simuntis R. Treatment options for odontogenic maxillary sinusitis : a review. Stomatologija 2018; 20 : 22–6. [PubMed] [Google Scholar]
- Coll PP, Lindsay A, Meng J, et al. The Prevention of Infections in Older Adults : Oral Health. J Am Geriatr Soc 2020; 68 : 411–6. [CrossRef] [PubMed] [Google Scholar]
- Mylonas AI, Tzerbos FH, Mihalaki M, et al. Cerebral abscess of odontogenic origin. J Craniomaxillofac Surg 2007; 35 : 63–7. [CrossRef] [PubMed] [Google Scholar]
- Deppe H, Reitberger J, Behr AV, et al. Oral bacteria in infective endocarditis requiring surgery : a retrospective analysis of 134 patients. Clin Oral Investig 2022; 26 : 4977–85. [CrossRef] [PubMed] [Google Scholar]
- Wang A, Gaca JG, Chu VH. Management Considerations in Infective Endocarditis : A Review. JAMA 2018; 320 : 72–83. [CrossRef] [PubMed] [Google Scholar]
- Lebeaux D, Ghigo J-M. Infections associées aux biofilms — Quelles perspectives thérapeutiques issues de la recherche fondamentale ? Med Sci (Paris) 2012; 28 : 727–39. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Kinane DF, Bartold PM. Clinical relevance of the host responses of periodontitis. Periodontol 2000 2007; 43 : 278–93. [CrossRef] [PubMed] [Google Scholar]
- Highfield J. Diagnosis and classification of periodontal disease. Aust Dent J 2009; 54 : S11–S26. [CrossRef] [PubMed] [Google Scholar]
- Caton JG, Armitage G, Berglundh T, et al. A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Periodontol 2018; 89 : S1–S8. [CrossRef] [PubMed] [Google Scholar]
- G Caton J, Armitage G, Berglundh T, et al. A new classification scheme for periodontal and peri-implant diseases and conditions - Introduction and key changes from the 1999 classification. J Clin Periodontol 2018; 45 : S1–S8. [CrossRef] [Google Scholar]
- Albandar JM, Susin C, Hughes FJ. Manifestations of systemic diseases and conditions that affect the periodontal attachment apparatus : Case definitions and diagnostic considerations. J Clin Periodontol 2018; 45 : S171–S89. [CrossRef] [PubMed] [Google Scholar]
- Holmstrup P, Plemons J, Meyle J. Non – plaque-induced gingival diseases. J Clin Periodontol 2018; 45 : S28–S43. [CrossRef] [PubMed] [Google Scholar]
- Löe H. Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care 1993; 16 : 329–34. [CrossRef] [PubMed] [Google Scholar]
- Hettne KM, Weeber M, Laine ML, et al. Automatic mining of the literature to generate new hypotheses for the possible link between periodontitis and atherosclerosis : lipopolysaccharide as a case study. J Clin Periodontol 2007; 34 : 1016–24. [CrossRef] [PubMed] [Google Scholar]
- Pablo P de, Dietrich T, McAlindon TE. Association of periodontal disease and tooth loss with rheumatoid arthritis in the US population. J Rheumatol 2008; 35 : 70–6. [PubMed] [Google Scholar]
- Takeuchi K, Matsumoto K, Furuta M, et al. Periodontitis Is Associated with Chronic Obstructive Pulmonary Disease. J Dent Res 2019; 98 : 534–40. [CrossRef] [PubMed] [Google Scholar]
- Thomas C, Timofeeva I, Bouchoucha E, et al. Oral and periodontal assessment at the first trimester of pregnancy : The PERISCOPE longitudinal study. Acta Obstet Gynecol Scand 2023; 102 : 669–80. [CrossRef] [PubMed] [Google Scholar]
- Vergnes J-N, Sixou M. Preterm low birth weight and maternal periodontal status : a meta-analysis. Am J Obstet Gynecol 2007; 196 : 135.e1–7. [CrossRef] [PubMed] [Google Scholar]
- Kamer AR, Craig RG, Niederman R, et al. Periodontal disease as a possible cause for Alzheimer’s disease. Periodontology 2000 2020; 83 : 242–71. [CrossRef] [PubMed] [Google Scholar]
- Mortada I, Leone A, Gerges Geagea A, et al. Oral manifestations of inflammatory bowel disease. J Biol Regul Homeost Agents 2017; 31 : 817–21. [PubMed] [Google Scholar]
- Lamster IB, Pagan M. Periodontal disease and the metabolic syndrome. Int Dent J 2017; 67 : 67–77. [CrossRef] [PubMed] [Google Scholar]
- Xiao E, Mattos M, Vieira GHA, et al. Diabetes Enhances IL-17 Expression and Alters the Oral Microbiome to Increase Its Pathogenicity. Cell Host Microbe 2017; 22 : 120–8.e4. [CrossRef] [PubMed] [Google Scholar]
- Thomas C, Minty M, Canceill T, et al. Obesity Drives an Oral Microbiota Signature of Female Patients with Periodontitis : A Pilot Study. Diagnostics 2021; 11 : 745. [CrossRef] [PubMed] [Google Scholar]
- Fan Y, Pedersen O. Gut microbiota in human metabolic health and disease. Nat Rev Microbiol 2021; 19 : 55–71. [CrossRef] [PubMed] [Google Scholar]
- Nitta H, Katagiri S, Nagasawa T, et al. The number of microvascular complications is associated with an increased risk for severity of periodontitis in type 2 diabetes patients : Results of a multicenter hospital-based cross-sectional study. J Diabetes Investig 2017; 8 : 677–86. [CrossRef] [PubMed] [Google Scholar]
- Vergnes JN, Canceill T, Vinel A, et al. The effects of periodontal treatment on diabetic patients : the DIAPERIO randomized controlled trial. J Clin Periodontol 2018; 45 : 1150–63. [CrossRef] [PubMed] [Google Scholar]
- Virani SS, Alonso A, Aparicio HJ, et al. Heart Disease and Stroke Statistics — 2021 Update : A Report From the American Heart Association. Circulation 2021; 143. [Google Scholar]
- Pietiäinen M, Liljestrand JM, Kopra E, et al. Mediators between oral dysbiosis and cardiovascular diseases. Eur J Oral Sci 2018; 126 : 26–36. [CrossRef] [PubMed] [Google Scholar]
- Mahendra J, Mahendra L, Nagarajan A, et al. Prevalence of eight putative periodontal pathogens in atherosclerotic plaque of coronary artery disease patients and comparing them with noncardiac subjects : A case-control study. Indian J Dent Res 2015; 26 : 189–95. [CrossRef] [PubMed] [Google Scholar]
- Pavlic V, Peric D, Kalezic IS, et al. Identification of Periopathogens in Atheromatous Plaques Obtained from Carotid and Coronary Arteries. Biomed Res Int 2021; 2021 : 9986375. [CrossRef] [PubMed] [Google Scholar]
- Thomas C, Minty M, Vinel A, et al. Oral Microbiota : A Major Player in the Diagnosis of Systemic Diseases. Diagnostics 2021; 11 : 1376. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Représentation schématique de l’anatomie d’une dent et de son parodonte (coupe sagittale). |
| Dans le texte | |
 |
Figure 2. Extrait d’une radiographie panoramique montrant les dents #35, 36 et 37. La corticale de l’os alvéolaire est clairement identifiable (1), ainsi que l’espace radio-clair autour des racines correspondant au desmodonte (2). |
| Dans le texte | |
 |
Figure 3. Lésions carieuses dentinaires des faces vestibulaires des dents chez un patient de 30 ans. |
| Dans le texte | |
 |
Figure 4. Cellulite génienne haute de l’hémiface gauche d’un enfant de six ans automédiqué par ses parents avec de l’ibuprofène sans couverture antibiotique. |
| Dans le texte | |
 |
Figure 5. Représentations schématiques des deux principales affections parodontales. (A) La gingivite concerne uniquement la gencive marginale, alors que la parodontite (B) (qu’elle qu’en soit sa forme) est liée à une destruction de tous les tissus de soutien de la dent. |
| Dans le texte | |
 |
Figure 6. Photographie endobuccale de la denture d’une patiente souffrant d’une parodontite. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




