| Issue |
Med Sci (Paris)
Volume 39, Number 12, Décembre 2023
|
|
|---|---|---|
| Page(s) | 915 - 917 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023167 | |
| Published online | 18 December 2023 | |
Mécanisme d’association de la protéine Tat du VIH à la particule virale
Mechanism enabling HIV Tat association with viral particles
Institut de recherche en infectiologie de Montpellier, UMR 9004, université de Montpellier-CNRS, Montpellier, France
Les virus sont des microorganismes qui ne peuvent se multiplier qu’à l’intérieur de leurs cellules hôtes. Pour cela, ils utilisent ou détournent les machineries cellulaires, en particulier celles de transcription des gènes et de traduction des transcrits, pour produire les protéines virales. Les rétrovirus, notamment le virus de l’immunodéficience humaine (VIH), ont la capacité d’intégrer leur génome ARN dans le génome ADN de la cellule qu’ils infectent : une étape clé de leur cycle viral est donc la synthèse d’une copie ADN de leur génome viral par rétrotranscription de celui-ci (d’où leur nom de rétrovirus).
Si les virus utilisent de nombreuses voies métaboliques de la cellule hôte, ils doivent cependant incorporer dans la particule virale (virion) certaines molécules essentielles, notamment des acides nucléiques et des protéines, leur permettant d’infecter efficacement cette cellule et de déclencher la production des protéines virales. Par exemple, comme pour tous les virus enveloppés, les virions des rétrovirus doivent posséder des protéines membranaires virales qui vont permettre à ces virions de se lier à leurs récepteurs cellulaires. Ils doivent aussi contenir les enzymes spécifiques aux rétrovirus : la transcriptase inverse, qui permet de copier l’ARN du génome viral (sa taille, pour le VIH, est d’environ 10 Kb) en ADN viral, et l’intégrase, qui catalyse l’intégration de cet ADN viral dans l’ADN cellulaire [1]. Pour produire les protéines virales à partir de ce génome viral intégré, les gènes viraux doivent d’abord être transcrits en ARN messagers (ARNm). Dans le cas du VIH-1, la transcription de ses gènes ne repose pas uniquement sur la machinerie cellulaire : elle nécessite également la présence de la protéine Tat (trans-activator of transcription) du virus. Cette protéine est notamment requise pour la synthèse des ARNm viraux longs : son absence conduit en effet à la production d’ARN viraux abortifs très courts [2].
Que se passe-t-il au début du cycle viral, avant que la protéine Tat néosynthétisée par la cellule infectée soit disponible ? Le déclenchement de la transcription des gènes viraux après l’intégration du génome viral dans celui de la cellule hôte semblait impliquer que Tat est présente dans les particules virales qui ont infecté cette cellule. Cependant, même si une analyse protéomique avait détecté la présence de la protéine dans des virions de VIH purifiés [3], la plupart des articles de revue sur ce virus ne mentionnaient pas Tat dans la liste des protéines incorporées dans les virions [1, 4].
Mécanisme d’incorporation de la protéine Tat dans les particules virales du VIH
Nous avons confirmé la présence de Tat dans les virions du VIH par une méthode biochimique (western blot) et par une méthode de microscopie (microscopie à force atomique couplée à la microscopie en fluorescence excitée par onde évanescente) [5]. Nous avons également élucidé le mécanisme permettant l’incorporation de cette protéine dans les virions. Il repose sur la formation d’un complexe à trois protéines (Figure 1A). La première est la protéine de capside virale (CA, ou p24). C’est la protéine majeure du virus, présente à environ 2 500 copies par virion [4], dont 1 500 vont s’assembler pour former la capside virale (capsid core), qui forme un cône caractéristique à l’intérieur du virion et protège les deux copies d’ARN viral. Le résidu proline en position 90 de la séquence de la protéine CA (Pro90), situé dans une boucle exposée de cette protéine, permet le recrutement et donc l’encapsidation d’une prolyl-isomérase cellulaire, la cyclophiline A (CypA) [6]. Les cyclophilines permettent l’isomérisation cis/trans des résidus proline dans les protéines [7]. CypA se fixe sur la Pro90 de la protéine CA via son site actif, et cette interaction permet à Tat d’être recrutée dans ce complexe en se fixant principalement à CypA (Figure 1A). La liaison de Tat à CypA est donc non conventionnelle car elle n’implique pas le site actif de cette protéine chaperone, qui est occupé par la protéine CA. Le complexe tripartite CA-CypA-Tat est stable et peut être purifié par chromatographie d’exclusion. L’analyse des forces d’interaction entre les protéines de ce complexe a montré que la présence de CA promeut la fixation de Tat sur CypA, un résultat d’abord obtenu in vitro en utilisant des protéines purifiées, puis validé dans la cellule. Enfin, nous avons montré que lorsqu’on perturbe la liaison de CypA à CA, en mutant le site de fixation dans CA ou en utilisant un inhibiteur de CypA, la cyclosporine A, qui se fixe sur le site actif de CypA, le complexe tripartite ne se forme plus. L’affinité de l’interaction entre CA et CypA est faible (Kd ~5 µM), tandis que celle de l’interaction entre Tat et le complexe bipartite (CypA-CA) est forte (Kd ~100 nM). Le facteur limitant pour la formation du complexe ternaire CA-CypA-Tat est donc la fixation de CypA sur CA. En accord avec ces mesures d’affinité, le virion contient environ 250 molécules de CypA (soit environ une molécule de CypA pour 10 molécules de CA) [6], et autant de molécules de Tat que de CypA [5].
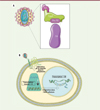 |
Figure 1. A. Mécanisme d’encapsidation de la protéine Tat du VIH. La protéine de capside du VIH (CA) présente à sa surface une boucle contenant un résidu proline (Pro90) reconnu par une prolylisomérase cellulaire, la cyclophiline A (CypA), qui est de ce fait encapsidée dans la particule virale. La protéine Tat, qui se fixe sur le complexe CA-CypA, est donc ainsi encapsidée. B. Rôle de la protéine Tat encapsidée dans le déclenchement du cycle viral. Après la fixation du VIH sur le récepteur CD4 et son corécepteur (CCR5 ou CXCR4), la membrane du virion fusionne avec la membrane plasmique de la cellule. La capside virale est alors injectée dans le cytosol. La protéine Tat encapsidée rend environ deux fois plus efficace la transcription inverse, permettant au virus de transformer son ARN génomique en ADN double brin, et décuple l’efficacité de la transcription des gènes viraux qui se produit après l’intégration de l’ADN viral dans le génome cellulaire. Cela permet de lancer efficacement la production virale, sans attendre la disponibilité de la protéine Tat néosynthétisée [5]. |
Rôle de la protéine Tat encapsidée
Après avoir montré que la protéine Tat était incorporée dans les particules du VIH produites par la cellule infectée, il restait à comprendre à quel(s) stade(s) du cycle viral intervient cette protéine encapsidée. De nombreuses études ont montré que Tat est nécessaire pour une transcription efficace des gènes viraux, et le mécanisme de cet effet est connu [2]. Par ailleurs, quelques études ont montré que Tat favorise la rétrotranscription du génome viral, par un mécanisme qui reste à établir [8]. Pour déterminer l’effet de la protéine Tat encapsidée dans les virions sur l’infectivité virale, nous avons utilisé des virus qui ne peuvent pas réinfecter les cellules après l’infection initiale, ainsi que des temps d’infection courts (6 à 10 heures) afin de limiter la production de protéine Tat par la cellule hôte. Nous avons tout d’abord préparé des virions dépourvus de protéine Tat encapsidée en utilisant la cyclosporine A, et avons ainsi pu montrer que l’absence de cette protéine dans les virions diminue de 5 à 10 fois l’infectivité et la production de particules virales par la cellule hôte. Nous avons également incorporé dans des virus génétiquement dépourvus de Tat des protéines Tat spécifiquement déficientes dans leur activité de transcription ou de rétrotranscription. Cela nous a permis de montrer que la Tat encapsidée permet de doubler l’activité de rétrotranscription des virions entrant, et surtout de décupler l’activité de transcription des gènes viraux lors de l’infection des cellules (Figure 1B). Ce résultat confirme ceux d’études précédentes ayant montré que le rôle de Tat dans le cycle viral est principalement de catalyser la transcription des gènes viraux [2]. Il convient de préciser que la concentration de Tat nécessaire pour permettre la transcription des gènes viraux est très faible (subnanomolaire) [9]. Ainsi, les 250 molécules de Tat encapsidées par virion sont suffisantes pour que l’infection d’une cellule par un seul virion permette une forte activité transcriptionnelle des gènes viraux, et donc déclenche efficacement le cycle viral sans attendre la synthèse de protéine Tat par la cellule hôte [5].
Nos travaux de recherche ont donc permis de montrer que la protéine Tat du VIH était encapsidée grâce à la formation d’un complexe ternaire CA-CypA-Tat [5]. Cette encapsidation est nécessaire à l’infectivité virale, en particulier pour la transcription des gènes viraux au début du cycle viral, avant que la protéine Tat néosynthétisée par la cellule hôte ne devienne disponible. Lors de sa production par la cellule infectée, le virion du VIH incorpore donc les trois protéines qui vont lui permettre de déclencher le cycle de multiplication du virus dans la future cellule hôte : les deux enzymes permettant la rétrotranscription et l’intégration du génome viral dans le génome cellulaire, et la protéine Tat permettant la transcription efficace des gènes viraux.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Cette étude a été financée par la Fondation pour la recherche médicale et Sidaction.
Références
- Swanson CM, Malim MH. SnapShot: HIV-1 proteins. Cell 2008 ; 133 : 742. [CrossRef] [PubMed] [Google Scholar]
- Ott M, Geyer M, Zhou Q. The control of HIV transcription: keeping RNA polymerase II on track. Cell Host Microbe 2011 ; 10 : 426–435. [CrossRef] [PubMed] [Google Scholar]
- Chertova E, Chertov O, Coren LV, et al. Proteomic and biochemical analysis of purified human immunodeficiency virus type 1 produced from infected monocyte-derived macrophages. J Virol 2006 ; 80 : 9039–9052. [CrossRef] [PubMed] [Google Scholar]
- Christensen DE, Ganser-Pornillos BK, Johnson JS, et al. Reconstitution and visualization of HIV-1 capsid-dependent replication and integration in vitro. Science 2020; 370 : eabc9420. [CrossRef] [Google Scholar]
- Schatz M, Marty L, Ounadjela C, et al. A tripartite complex HIV-1 Tat-cyclophilin A-capsid protein enables Tat encapsidation that is required for HIV-1 infectivity. J Virol 2023; 97 : e0027823. [CrossRef] [PubMed] [Google Scholar]
- Gamble TR, Vajdos FF, Yoo S, et al. Crystal structure of human cyclophilin A bound to the amino-terminal domain of HIV-1 capsid. Cell 1996 ; 87 : 1285–1294. [CrossRef] [PubMed] [Google Scholar]
- Hopkins S, Gallay PA. The role of immunophilins in viral infection. Biochim Biophys Acta 2015 ; 1850 : 2103–2110. [CrossRef] [PubMed] [Google Scholar]
- Ulich C, Dunne A, Parry E, et al. Functional domains of Tat required for efficient human immunodeficiency virus type 1 reverse transcription. J Virol 1999 ; 73 : 2499–2508. [CrossRef] [PubMed] [Google Scholar]
- Zhang J, Tamilarasu N, Hwang S, et al. HIV-1 TAR RNA enhances the interaction between Tat and cyclin T1. J Biol Chem 2000 ; 275 : 34314–34319. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. A. Mécanisme d’encapsidation de la protéine Tat du VIH. La protéine de capside du VIH (CA) présente à sa surface une boucle contenant un résidu proline (Pro90) reconnu par une prolylisomérase cellulaire, la cyclophiline A (CypA), qui est de ce fait encapsidée dans la particule virale. La protéine Tat, qui se fixe sur le complexe CA-CypA, est donc ainsi encapsidée. B. Rôle de la protéine Tat encapsidée dans le déclenchement du cycle viral. Après la fixation du VIH sur le récepteur CD4 et son corécepteur (CCR5 ou CXCR4), la membrane du virion fusionne avec la membrane plasmique de la cellule. La capside virale est alors injectée dans le cytosol. La protéine Tat encapsidée rend environ deux fois plus efficace la transcription inverse, permettant au virus de transformer son ARN génomique en ADN double brin, et décuple l’efficacité de la transcription des gènes viraux qui se produit après l’intégration de l’ADN viral dans le génome cellulaire. Cela permet de lancer efficacement la production virale, sans attendre la disponibilité de la protéine Tat néosynthétisée [5]. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




