| Issue |
Med Sci (Paris)
Volume 39, Number 11, Novembre 2023
|
|
|---|---|---|
| Page(s) | 855 - 861 | |
| Section | M/S Revues | |
| DOI | https://doi.org/10.1051/medsci/2023162 | |
| Published online | 29 November 2023 | |
Les fièvres hémorragiques causées par les arénavirus : de récentes avancées vaccinales
Recent advances in the development of vaccines against hemorrhagic fevers caused by arenaviruses
1
Institut Pasteur, Université Paris Cité, Unité de biologie des infections virales émergentes, Paris, France
2
Centre international de recherche en infectiologie (CIRI), université de Lyon, Inserm U1111, école normale supérieure de Lyon, université Lyon 1, CNRS UMR5308, 69-007, Lyon, France
*
Sylvain.baize@pasteur.fr
**
mathieu.mateo@pasteur.fr
Le développement de vaccins contre les arénavirus est un enjeu global. En effet, plusieurs milliers de personnes meurent chaque année de la fièvre de Lassa en Afrique occidentale et les virus Machupo, Guanarito ou Chapare continuent de ré-émerger en Amérique du Sud. Pourtant, il n’existe à ce jour aucun vaccin validé pour une utilisation dans l’espèce humaine pour lutter contre ces arénavirus. Dans cette synthèse, nous présentons les différents arénavirus causant des maladies mortelles chez l’espèce humaine et les principaux candidats vaccins développés au cours des dernières décennies contre ces virus. Nous décrivons plus particulièrement le vaccin rougeole-Lassa, premier vaccin contre la fièvre de Lassa à avoir été testé dans l’espèce humaine, et la plateforme MOPEVAC qui permet de générer avec succès des vaccins mono- ou multivalents contre potentiellement tous les arénavirus pathogènes connus.
Abstract
Arenaviruses are a global threat, causing thousands of deaths each year in several countries around the world. Despite strong efforts in the development of vaccine candidates, vaccines against Lassa fever or Bolivian and Venezuelan hemorrhagic fevers are yet to be licensed for a use in humans. In this synthesis, we present the arenaviruses causing fatal diseases in humans and the main vaccine candidates that have been developed over the past decades with an emphasis on the measles-Lassa vaccine, the first Lassa vaccine ever tested in humans, and on the MOPEVAC platform that can potentially be used as a pan-arenavirus vaccine platform.
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Vignette (© Sylvain Baize).
Les arénavirus : une menace globale
La famille des Arenaviridae est une large famille de virus regroupant les Antennavirus de poissons, les Hartmanivirus et les Reptarénavirus de reptiles, et les Mammarénavirus de mammifères. Plus d’une cinquantaine de Mammarénavirus sont connus à ce jour et circulent sur quasiment tous les continents sauf l’Océanie [1]. On distingue les Mammarénavirus de l’Ancien Monde circulant en Afrique, en Asie et en Europe, des Mammarénavirus du Nouveau Monde circulant en Amérique du Nord et en Amérique du Sud. Malgré la forte diversité des Mammarénavirus, tous partagent la même organisation structurale. Leur génome bisegmenté de polarité négative code quatre protéines structurales. Le segment S code la nucléoprotéine NP et la glycoprotéine GPC, et le segment L code la polymérase ARN ARN-dépendante L et la protéine de matrice Z (Figure 1) [2]. La nucléoprotéine NP protège les ARN génomiques et sert de cofacteur à la polymérase L pour la transcription et la réplication. La glycoprotéine GPC est enchâssée sous forme de trimères dans l’enveloppe lipidique de la particule virale et interagit avec les récepteurs cellulaires spécifiques pour l’entrée et la fusion virales. La protéine Z participe à l’assemblage et au bourgeonnement des particules virales.
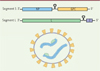 |
Figure 1. Organisation génomique et structurale des Mammarénavirus. Le génome des Mammarénavirus est un génome bisegmenté de polarité ambisens codant quatre protéines. Le segment S code les protéines NP et GPC alors que le segment L code les protéines L et Z. La particule virale des Mammarénavirus est composée des deux segments d’ARN génomiques encapsidés par la nucléoprotéine NP, auxquels est associée la polymérase L. Le génome est contenu dans une enveloppe lipidique dans laquelle sont enchâssés des trimères de glycoprotéines GPC. À l’interface des segments génomiques et de l’enveloppe se trouve la protéine de matrice Z. |
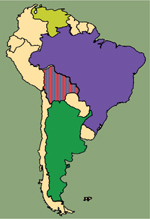
Les rongeurs sont les principaux réservoirs des Mammarénavirus et peuvent occasionnellement contaminer les populations humaines. La plupart des Mammarénavirus ne causent cependant pas de maladie dans l’espèce humaine, mais certains sont responsables de fièvres hémorragiques sévères, comme le virus Lassa (LASV) en Afrique de l’Ouest, le virus Lujo (LUJV) en Afrique Australe et les virus Junín (JUNV), Machupo (MACV), Guanarito (GTOV), Sabiá (SABV) et Chapare (CHAV) en Amérique du Sud (Figure 2).
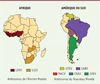 |
Figure 2. Distribution géographique des Mammarénavirus causant des fièvres hémorragiques dans l’espèce humaine. En Afrique, le virus Lassa (LASV) circule en Guinée, au Libéria, en Sierra Leone, au Mali, en Cote d’Ivoire, au Burkina Faso, au Bénin, au Togo, au Ghana et au Nigéria. Le virus Lujo (LUJV) a émergé récemment en Zambie et en Afrique du Sud. En Amérique du Sud, le virus Guanarito (GTOV) circule au Vénézuéla, le virus Sabia au Brésil, les virus Machupo (MACV) et Chapare (CHAV) en Bolivie, et le virus JUNV en Argentine. |
En Afrique, LUJV est moins problématique que LASV. Découvert en 2008 en Afrique du Sud, LUJV fut responsable de quatre décès parmi les cinq personnes qui avaient été infectées [3]. Le cas index avait été rapatrié de Zambie vers Johannesburg en Afrique du Sud. Là, quatre membres du personnel hospitalier qui l’avaient accueilli furent infectés. Depuis cette épidémie, LUJV n’a pas ré-émergé et l’histoire naturelle de ce virus reste peu documentée. En revanche, LASV est endémique dans plusieurs pays d’Afrique de l’Ouest : le Nigéria, la Guinée, la Sierra Leone, et le Libéria, où il est responsable d’épidémies annuelles à l’origine de nombreux décès. Des cas sporadiques ou des épidémies sont également observés dans les pays limitrophes, le Bénin, le Togo, le Mali, le Burkina Faso, la Côte d’Ivoire et le Ghana. LASV fut découvert au Nigéria en 1969. Ce virus circule principalement chez des rongeurs du genre Mastomys (ou rat à mamelles multiples) qui sont responsables des contaminations humaines via des contacts avec des fluides infectés ou l’inhalation de poussières contaminées [4, 5]. Une majorité des personnes infectées ne développent pas d’infection sévère, en la contrôlant, dans les deux à trois semaines suivant l’apparition des symptômes, grâce au développement de réponses lymphocytaires T spécifiques efficaces [6, 7]. Des anticorps neutralisants sont généralement détectés chez les survivants, mais tardivement et avec des titres peu élevés [8, 9], suggérant leur faible contribution dans le contrôle de l’infection virale. Les infections sévères conduisent quant à elles à 20-30 % de décès chez les patients hospitalisés [10]. Les cas mortels de fièvre de Lassa (FL) sont notamment caractérisés par une forte virémie, des concentrations plasmatiques importantes de plusieurs marqueurs de dommages tissulaires, comme des taux élevés d’aspartate aminotransférase (AST), d’interleukine (IL)-6 et de créatine phosphokinase, et une absence de production d’anticorps neutralisants et de réponse lymphocytaire T spécifique du virus [10]. Il n’existe à ce jour aucun vaccin ou traitement validé dans l’espèce humaine contre la fièvre de Lassa. La ribavirine (analogue nucléosidique de la guanosine) est utilisée depuis des décennies chez les patients hospitalisés, mais son bénéfice a sérieusement été remis en cause récemment [11, 12].
En Amérique du Sud, JUNV est le Mammarénavirus posant le plus important problème de santé publique. Responsable de la fièvre hémorragique argentine (FHA), JUNV émergea au milieu des années 1950 et fut responsable d’épidémies annuelles causant plusieurs milliers de morts, principalement chez des agriculteurs en contact avec le réservoir rongeur Calomys musculinus (ou souris du maïs) [13]. Grâce à la mise au point d’un vaccin vivant atténué, Candid#1, le nombre de cas a fortement chuté au cours des années 1990 [13]. Mais ce vaccin n’est pas autorisé pour une utilisation hors Argentine, pour des raisons de sûreté.
MACV est transmis à l’espèce humaine par le rongeur Calomys collosus et est responsable de la fièvre hémorragique bolivienne (FHBo) [14]. La majorité des cas a été recensée entre 1959 et 1964. Le virus a ensuite très peu ré-émergé pendant une quarantaine d’années. Depuis 2007 cependant, plusieurs centaines de cas de fièvre hémorragique bolivienne ont été recensés, avec des épidémies moins étendues ou des cas isolés [15]. GTOV, qui circule naturellement chez les rongeurs Sigmodon alstoni (rat des savanes d’Alston) et Zygodontomys brevicauda (rat des cannes) au Vénézuela, a causé plusieurs centaines de cas de fièvre hémorragique vénézuélienne (FHV) entre 1989 et 2021 [16]. Depuis sa découverte en 1990, SABV n’a causé que cinq cas de fièvre hémorragique brésilienne (FHBr), le dernier datant de 2020 [17]. CHAV, qui circule chez les rongeurs Oligoryzomys microtis (rat du riz à petites oreilles), a été responsable de deux épidémies de fièvre hémorragique dite à virus CHAV (FHC), en 2003 et, plus récemment, en 2019 [14, 18]. Les voies de contamination du rongeur à l’espèce humaine sont similaires à celles observées pour la fièvre de Lassa. Pour les FHA, FHBo et FHV, les cas sévères représenteraient 20 à 30 % des infections. Ils se caractérisent par des syndromes hémorragiques et neurologiques conduisant au décès dans les deux semaines suivant l’apparition des premiers symptômes [19]. En plus d’une thrombocytopénie marquée, une inflammation exacerbée et une forte réponse interféron de type I seraient également des marqueurs de la sévérité de la maladie [20, 21]. Contrairement à la fièvre de Lassa, la production d’anticorps neutralisants est nécessaire à la survie des patients infectés par les virus responsables de ces fièvres. Le transfert passif d’immunoglobulines à partir de sérums de patients convalescents (et contenant ces anticorps neutralisants) a d’ailleurs démontré une efficacité notable contre la FHA, même si 10 % des patients traités ont développé des syndromes neurologiques tardifs [22]. Comme pour la fièvre de Lassa, la ribavirine est prescrite aux patients infectés malgré un manque d’efficacité démontrée. Il n’existe donc pas de traitements ou de vaccins validés pour une utilisation à grande échelle sur le continent sud-américain. Pour la majorité des Mammarénavirus pathogènes pour l’espèce humaine, il n’existe aucune prophylaxie efficace mais de nombreux candidats vaccins ont été développés.
Les vaccins contre la fièvre de Lassa
Au cours des trois dernières décennies, de nombreux candidats vaccins ont été développés contre la fièvre de Lassa. La plupart d’entre eux ont vu leur développement arrêté suite à des problèmes de sûreté, de stabilité, ou encore par manque d’immunogénicité ou d’efficacité chez le primate non humain (PNH) [23] qui reste le modèle animal de référence pour l’épreuve de vaccins contre la fièvre de Lassa [24]. Les rongeurs sont en effet naturellement résistants à l’infection par le LASV à l’exception des cobayes de souche 13 qui ne sont pas disponibles pour la plupart des laboratoires. Seule l’infection des PNH reproduit fidèlement la physiopathogenèse de la fièvre de Lassa observée dans l’espèce humaine. À ce jour, seuls cinq vaccins contre le LASV ont démontré une efficacité chez le PNH. Mais cela ne suffit pas à en faire de bons vaccins. En effet, comme cela est recommandé par le Target Product Profile publié par l’Organisation mondiale de la santé (OMS) en 2017 [25], un vaccin contre la fièvre de Lassa doit être préventif, protégeant préférentiellement après une seule immunisation, et sûr pour toutes les tranches d’âge. Il doit également protéger contre des souches divergentes de LASV. Sept lignages de LASV, génétiquement distincts, sont en effet connus [26], mais tous les vaccins développés à ce jour n’expriment que les antigènes d’une souche, la souche Josiah du lignage IV. Pourtant, au cours d’une même épidémie, des souches de lignages différents peuvent être transmises du rongeur à l’espèce humaine [27]. Il doit finalement induire une protection à long terme.
Le vaccin à ADN INO-4500 est fondé sur l’utilisation d’un plasmide codant la version codon-optimisée de la glycoprotéine du virus LASV [28, 29]. Deux injections intradermiques, à un mois d’intervalle, protègent des PNH contre la fièvre de Lassa. Les PNH immunisés ne développent aucun signe clinique de la maladie, ne présentent pas de fièvre ni de virémie, et leurs concentrations plasmatiques d’ALT (alanine aminotransférase) et d’AST (aspartate aminotransférase) sont normales. L’immunité protectrice induite par INO-4500 est caractérisée, dès six semaines après la première immunisation, par la production d’anticorps, dont des anticorps neutralisants, et le développement d’une réponse lymphocytaire T, contre la glycoprotéine d’enveloppe GPC du virus [29]. Chez les PNH vaccinés, la production d’anticorps neutralisants est augmentée après l’épreuve LASV (qui correspond à une infection par le virus). Bien qu’aucune étude préclinique n’ait testé l’efficacité croisée de l’INO-4500 ou sa protection à long terme, ce vaccin est entré en phases cliniques Ia et Ib, respectivement en 2019 (NCT03805984) et en 2021 (NCT04093076). Les résultats de ces évaluations cliniques sont encore attendus, mais le développement clinique de ce vaccin semble interrompu.
Le virus de la stomatite vésiculeuse (VSV) recombinant est une plateforme utilisée pour le développement de vaccins qui ciblent plusieurs virus responsables de fièvres hémorragiques. Ce type de vaccin a notamment été validé pour une utilisation chez l’homme contre le virus Ebola, avec le vaccin ERVEBO [30]. Le vaccin rVSV∆G-LASV-GPC consiste également en un virus recombinant VSV dans lequel le gène de la glycoprotéine de VSV est remplacé par le gène de la glycoprotéine de LASV [31]. Une simple injection de ce vaccin induit des réponses T spécifiques et des anticorps neutralisants chez les PNH. Il protège contre la souche homologue Josiah, mais aussi contre d’autres souches de la lignée IV et, à court terme, contre une souche de la lignée II [31–33]. Le vaccin limite la réplication virale, l’apparition des signes cliniques de la fièvre de Lassa, ainsi que la modification des niveaux plasmatiques d’AST et d’ALT. Bien que l’efficacité à long terme de rVSV∆G-LASV-GPC ou sa capacité à protéger contre des souches très divergentes n’aient pas encore été démontrées chez le PNH, ce vaccin est entré en essai clinique de phase I en 2019 (NCT04794218/PACTR202106625781067). Alors que les résultats de cette première phase ne sont pas encore connus, une phase II a commencé en août 2023 en Afrique de l’Ouest (PACTR202210840719552).
Le vaccin ML-29 est un virus issu du réassortiment des virus LASV et Mopeia (MOPV) dans des cellules simiennes co-infectées par les deux virus [34]. MOPV est un virus proche du virus LASV, partageant le même réservoir et plus de 75 % de similarité au niveau protéique. Mais contrairement au LASV, MOPV n’a jamais été associé à une maladie dans l’espèce humaine, et l’infection de PNH par MOPV les protège contre une infection subséquente par LASV [35]. ML-29 contient le segment S du virus LASV et le segment L du virus MOPV. Bien que ce virus soit atténué et non pathogène pour le PNH, son utilisation comme vaccin chez l’homme soulève des questions de sûreté. Néanmoins, dans un modèle de PNH, ML-29 induit des réponses anticorps et des réponses T spécifiques [34]. Il protège également des ouistitis contre une infection par le virus LASV après une simple immunisation [36]. Ce vaccin n’a pas été testé en phase clinique. Le caractère « naturel » de ce vaccin, qui possède la moitié du génome du virus LASV, est sans doute un frein à son développement. Le vaccin ML-29 interroge également quant à son innocuité. En effet, la présence de particules infectieuses de ML-29 a été mise en évidence dans les tissus cérébraux et pulmonaires de PNH plusieurs semaines après qu’ils ont été immunisés. La persistance du virus atténué, notamment dans le système nerveux central, représente un obstacle majeur à un développement clinique chez l’homme [36].
MOPEVACLAS est un vaccin recombinant utilisant la plateforme MOPEVAC (Mopeia vaccine). Cette plateforme consiste en l’utilisation d’un clone recombinant du virus MOPV1 dans lequel le gène GPC peut être remplacé par le gène GPC de n’importe quel autre Arénavirus [37] (Figure 3). Bien que MOPV soit naturellement non pathogène, MOPEVAC a été hyperatténué par l’introduction de six mutations dans le site exoribonucléasique (ExoN) de la protéine NP, site qui contrôle l’induction de la réponse interféron (IFN) lors des infections par les virus LASV et MOPV [37, 38] (Figure 3A). Outre l’augmentation de l’atténuation du vaccin, l’abrogation du domaine ExoN de la protéine augmente significativement l’immunogénicité du vecteur, grâce à l’intense réponse IFN de type I qui est induite rapidement après l’infection [37, 39]. MOPEVACLAS expriment la glycoprotéine GPC de LASV en lieu et place de celle de MOPV. Chez le PNH, une injection de MOPEVACLAS induit la production d’anticorps, en partie neutralisants, ainsi que des réponses T dirigées spécifiquement contre les protéines GPC et NP du LASV [37, 39]. Bien que la protéine NP du LASV ne soit pas présente dans le MOPEVACLAS, les homologies entre la NP du LASV et celle du MOPV permettent l’induction de réponses immunitaires humorales et cellulaires croisées. Ces réponses sont fortement amplifiées après une infection par le LASV. Les PNH ne développent pas de signes cliniques ni de virémie et leurs paramètres biologiques restent stables [39] (Figure 4). Ce vaccin prometteur est toujours en phase de développement préclinique.
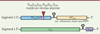 |
Figure 3. La plateforme vaccinale MOPEVAC. La plateforme vaccinale MOPEVAC est dérivée d’un virus recombinant Mopeia (MOPV) dans lequel six mutations ont été introduites dans le domaine DEDDH pour abroger l’activité exoribonucléasique (ExoN) de la nucléoprotéine NP. Dans cette plateforme, la GPC de MOPV peut etre facilement interchangée avec la GPC d’autres Mammarénavirus, tels que LASV, GTOV, SABV, MACV, CHAV ou JUNV. |
Le vaccin rougeole-Lassa (MeV-LASV) est probablement le plus avancé des vaccins contre la fièvre de Lassa. Ce vaccin utilise une souche vaccinale Schwarz recombinante modifiée pour exprimer les protéines GPC et NP de la souche Josiah [39]. Comme pour MOPEVACLAS, le domaine ExoN de la NP a été muté afin de préserver les propriétés immunogéniques du vecteur rougeole. Chez le PNH, une injection de MeV-LASV induit des réponses humorales et cellulaires notables, qui sont fortement augmentées après une épreuve par le LASV. Comme chez les survivants de la fièvre de Lassa, la réponse T CD8 dirigée contre les antigènes de LASV, plus particulièrement la GPC, est essentielle à la protection [40] (→).
(→) Voir la Nouvelle de S. Baize, m/s n° 10, octobre 2020, page 844
En revanche, l’immunisation n’induit pas d’anticorps neutralisants, qui sont toutefois détectés après l’épreuve virale, montrant qu’une réponse humorale avait été initiée par la vaccination. Après une seule immunisation, MeV-LASV protège les PNH contre la souche homologue et des souches hétérologues des lignages II et VII [39, 41] (Figure 4). Il induit également une immunité à long terme après une seule immunisation, qui protège les PNH plus d’un an après l’immunisation [41] et une immunité à court terme chez des PNH vaccinés 16 ou 8 jours avant une épreuve par le LASV, et cela même en présence d’une immunité préexistante contre le virus de la rougeole [42]. MeV-LASV limite donc l’apparition des signes cliniques de la fièvre de Lassa chez le PNH ; il permet un contrôle précoce de la réplication virale et prévient l’augmentation des marqueurs plasmatiques AST et ALT. MeV-LASV est probablement le vaccin contre la fièvre de Lassa le plus avancé en terme préclinique. Entré en phase I en 2019, les résultats de l’essai clinique ont été récemment publiés [43]. Dans une cohorte de 60 adultes, âgés de 18 à 55 ans, l’immunisation par MeV-LASV a été bien tolérée et a induit la production d’anticorps spécifiques dirigés contre les protéines GPC et NP qui ont été détectés jusqu’à un an suivant la première immunisation. Une réponse cellulaire T est également détectée environ deux mois après la première immunisation chez les patients. Comme chez les PNH, il n’a pas été mis en évidence de titre significatif d’anticorps neutralisants après les deux injections de MeV-LASV et l’immunité préexistante contre la rougeole ne diminue pas les propriétés immunogéniques du vaccin. MeV-LASV est donc un candidat prometteur pour la vaccination contre la fièvre de Lassa. Les phases cliniques devraient se poursuivre dans un avenir proche.
 |
Figure 4. Vaccination contre la fièvre de Lassa avec les plateformes recombinantes MOPEVAC et rougeole. Les vaccins MOPEVACLAS et MeV-LASV protègent des primates non humain (PNH) contre le virus LASV après une injection un mois avant l’épreuve par LASV Josiah (lignage IV). Une injection de MeV-LASV protège contre les virus LASV-Nigéria et LASV-Bénin des lignages II et VII. Cette injection confère aussi une immunité protectrice a court et long terme, meme en présence d’immunité préexistante contre le virus de la rougeole. |
Des vaccins contre les arénavirus du Nouveau Monde
Comme pour la fièvre de Lassa, de nombreux candidats vaccins recombinants ont été testés chez le cobaye avec des efficacités variables. Le cobaye ne reproduit cependant pas fidèlement la physiopathogenèse des fièvres hémorragiques dues aux Mammarénavirus du Nouveau Monde. Le PNH reste donc le modèle de référence, reproduisant les signes cliniques observés dans l’espèce humaine pour la FHA et la FHBo. Chez le PNH, une infection par le virus Tacaribe, un Mammarénavirus du Nouveau Monde non pathogène pour l’homme, protège contre la FHA mais son utilisation comme vaccin soulève des problèmes de sûreté [44]. Jusqu’à récemment, le seul vaccin ayant démontré une efficacité chez le PNH était le vaccin Candid#1 contre la FHA. Ce vaccin est issu du passage de la souche sauvage pathogénique XJ dans le cobaye (un passage), dans des cerveaux de souriceaux (44 passages) et dans les cellules de la lignée cellulaire fibroblastique simienne FRhL-2 (19 passages) [13]. La souche résultante, caractérisée par l’acquisition de plusieurs mutations codantes dans son génome, est ainsi hautement atténuée. Elle protège les PNH contre une infection par une souche pathogène du virus JUNV [45]. Sur la base de cette efficacité observée chez l’animal, des essais cliniques de phases I, II et III ont été conduits en Argentine au sein d’une population d’agriculteurs [46]. Les résultats ont démontré une bonne tolérance et une forte efficacité du vaccin. Candid#1 a ainsi été autorisé en 1992 en Argentine pour la vaccination des personnes exposées. Cependant, la crainte de réversion des mutations du vaccin vers un phénotype sauvage a limité l’enthousiasme pour son utilisation hors de l’Argentine. Il n’existe aucun autre vaccin disponible contre la FHA.
Le candidat vaccin le plus prometteur à l’heure actuelle est certainement le vaccin utilisant la plateforme MOPEVAC. En effet, le vaccin MOPEVACMAC, exprimant la GPC du virus Machupo (MACV), induit une immunité stérilisante chez les PNH infectés par une souche létale du virus [47] (Figure 5). Ce vaccin induit la production de forte quantité d’anticorps neutralisants dans les semaines suivant la vaccination, anticorps qui peuvent aussi neutraliser d’autres arénavirus comme GTOV, JUNV ou CHAV. Sur la base de ces résultats très prometteurs, un vaccin MOPEVACNEW a été généré. Ce vaccin a pour objectif de protéger contre tous les Mammarénavirus du Nouveau Monde connus pour être pathogènes dans l’espèce humaine. MOPEVACNEW est un vaccin pentavalent composé de cinq vaccins monovalents en quantités égales : MOPEVACMAC, MOPEVACGUA, MOPEVACJUN, MOPEVACCHA et MOPEVACSAB codant respectivement les GPC de MACV, de GTOV, de JUNV, de CHAV et de SABV. Son efficacité contre la FHBo et la FHV a été démontrée chez les PNH [47] (Figure 5) : après deux immunisations, MOPEVACNEW induit une immunité stérilisante chez les PNH caractérisée par la production d’anticorps qui neutralisent aussi les virus JUNV, SABV et CHAV. Une preuve de son efficacité contre les virus JUNV, SABV, CHAV en ferait un candidat sérieux pour la vaccination contre tous les Mammarénavirus pathogènes du Nouveau Monde.
 |
Figure 5. Vaccination contre les fièvres hémorragiques du Nouveau Monde avec la plateforme MOPEVAC. Des vaccins MOPEVAC exprimant les GPC des virus Machupo (MACV), Guanarito (GTOV), Junin (JUNV), Chapare (CHAV) et Sabia (SABV) sont disponibles en tant que vaccins monovalents et peuvent etre combinés pour générer le vaccin pentavalent MOPEVACNew. MOPEVACMAC protège des PNH contre la fièvre bolivienne après une simple immunisation. MOPEVACNew protège des PNH contre les fièvres boliviennes et vénézuéliennes après deux immunisations. |
Conclusions
Avec leur grande diversité et leur distribution globale, les Mammarénavirus constituent un problème de santé publique majeur à travers le monde. De nouveaux Mammarénavirus émergent, comme le virus LUJV en Afrique du Sud ou le virus Whitewater Arroyo en Amérique du Nord. De nouveaux virus potentiellement pathogènes pour l’espèce humaine sont aussi régulièrement identifiés dans des pays supposés exempts de Mammarénavirus, comme la République Populaire de Chine, avec les virus Wenzhou et Cardamones, ou, plus récemment, le virus Plateau Pika au Tibet. Le développement de vaccins ou de plateformes vaccinales permettant une réponse rapide et efficace contre de potentiels nouveaux Mammarénavirus pathogènes pour l’espèce humaine est de ce fait nécessaire. À ce jour, la plateforme MOPEVAC apparaît comme la plateforme la plus polyvalente pour protéger contre tous les Mammarénavirus pathogènes dans l’espèce humaine. Il semble que les vaccins fondés sur les vecteurs viraux atténués soient très efficaces pour protéger contre les Mammarénavirus. Les réponses immunitaires impliquées dans le contrôle de ces infections diffèrent cependant entre l’Ancien et le Nouveau Monde. En effet, pour les virus de l’Ancien Monde, des réponses humorales et cellulaires bien équilibrées semblent essentielles au contrôle de LASV, et l’utilisation de deux antigènes, GPC et NP, confère une protection efficace permettant de gérer le problème de la grande diversité génétique des souches circulantes de LASV. Les anticorps neutralisants ne semblent par contre pas indispensables pour une vaccination protectrice. Pour les Mammarénavirus du Nouveau Monde, les réponses humorales, composées d’anticorps neutralisants ou pas, sont essentielles, et permettent d’obtenir des immunités stérilisantes. En revanche, les réponses lymphocytaires T spécifiques ne semblent que peu présentes. Un long chemin est encore nécessaire avant de disposer de vaccins mis sur le marché pour combattre les Mammarénavirus, mais il est clair que ces virus pathogènes représentent une menace très importante dans les pays où ils circulent, et que la vaccination est très probablement le moyen le plus efficace et le moins onéreux de lutte à long terme.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Sironi M, Forni D, de la Torre J.-C. Mammarenavirus Genetic Diversity and Its Biological Implications. Cur Top Microbiol Immunol 2023; 439 : 265–303. [Google Scholar]
- Buchmeier MJ, de la Torre JC, and Peters CJ. Arenaviridae. Fields virology. Philadelphia, Pennsylvania, USA. : Lippincott Williams & Wilkins, Wolters Kluwer 2013 : pp. 1283–303. [Google Scholar]
- Briese T, Paweska JT, McMullan LK, et al. Genetic detection and characterization of Lujo virus, a new hemorrhagic fever-associated arenavirus from southern Africa. PLoS Pathog 2009 ; 5 : e1000455. [CrossRef] [PubMed] [Google Scholar]
- Monath TP, Newhouse VF, Kemp GE, et al. Lassa virus isolation from Mastomys natalensis rodents during an epidemic in Sierra Leone. Science 1974 ; 185 : 263–265. [CrossRef] [PubMed] [Google Scholar]
- Olayemi A, Cadar D, Magassouba N, et al. New Hosts of The Lassa Virus. Sci Rep 2016 ; 6 : 25280. [CrossRef] [PubMed] [Google Scholar]
- McCormick JB, Fisher-Hoch SPLassa fever. Cur Top. Microbiol Immunol 2002 ; 262 : 75–109. [Google Scholar]
- Merson L, Bourner J, Jalloh S, et al. Clinical characterization of Lassa fever : A systematic review of clinical reports and research to inform clinical trial design. PLoS Negl Trop Dis 2021; 15 : e0009788. [CrossRef] [PubMed] [Google Scholar]
- Robinson JE, Hastie KM, Cross RW, et al. Most neutralizing human monoclonal antibodies target novel epitopes requiring both Lassa virus glycoprotein subunits. Nat Commun 2016 ; 7 : 11544. [CrossRef] [PubMed] [Google Scholar]
- Ugwu C, Olumade T, Nwakpakpa E, et al. Humoral and cellular immune responses to Lassa fever virus in Lassa fever survivors and their exposed contacts in Southern Nigeria. Sci Rep 2022; 12 : 22330. [CrossRef] [PubMed] [Google Scholar]
- Garry RF. Lassa fever - the road ahead. Nat Rev Microbiol 2023; 21 : 87–96. [CrossRef] [PubMed] [Google Scholar]
- Eberhardt KA, Mischlinger J, Jordan S, et al. Ribavirin for the treatment of Lassa fever : A systematic review and meta-analysis. Int J Infect Dis 2019 ; 87 : 15–20. [CrossRef] [PubMed] [Google Scholar]
- Salam apr., Cheng V, Edwards T, et al. Time to reconsider the role of ribavirin in Lassa fever. PLoS Negl Trop Dis 2021; 15 : e0009522. [CrossRef] [PubMed] [Google Scholar]
- Ambrosio A, Saavedra M, Mariani M, et al. Argentine hemorrhagic fever vaccines. Hum Vaccin 2011 ; 7 : 694–700. [CrossRef] [PubMed] [Google Scholar]
- Silva-Ramos CR, Faccini-Martinez AA, Calixto OJ, Hidalgo M. Bolivian hemorrhagic fever : A narrative review. Travel Med Infect Dis 2021; 40 : 102001. [CrossRef] [PubMed] [Google Scholar]
- Patterson M, Grant A, Paessler S Epidemiology and pathogenesis of Bolivian hemorrhagic fever. Curr Opin Virol 2014 ; 5 : 82–90. [CrossRef] [PubMed] [Google Scholar]
- Silva-Ramos CR, Montoya-Ruiz C, Faccini-Martinez AA, Rodas J.-D. An updated review and current challenges of Guanarito virus infection, Venezuelan hemorrhagic fever. Arch Virol 2022; 167 : 1727–38. [CrossRef] [PubMed] [Google Scholar]
- Nastri AC, Duarte-Neto AN, Casadio LVB, et al. Understanding Sabia virus infections (Brazilian mammarenavirus). Travel Med Infect Dis 2022; 48 : 102351. [CrossRef] [PubMed] [Google Scholar]
- Loayza Mafayle R, Morales-Betoulle ME, Romero C, et al. Chapare Hemorrhagic Fever and Virus Detection in Rodents in Bolivia in 2019. N Engl J Med 2022; 386 : 2283–94. [CrossRef] [PubMed] [Google Scholar]
- Frank MG, Beitscher A, Webb CM, et al. South American Hemorrhagic Fevers : A summary for clinicians. Int J Infect Dis 2021; 105 : 505–15. [CrossRef] [PubMed] [Google Scholar]
- Levis SC, Saavedra MC, Ceccoli C, et al. Endogenous interferon in Argentine hemorrhagic fever. J Infect Dis 1984 ; 149 : 428–433. [CrossRef] [PubMed] [Google Scholar]
- Levis SC, Saavedra MC, Ceccoli C, et al. Correlation between endogenous interferon and the clinical evolution of patients with Argentine hemorrhagic fever. J Interferon Res 1985 ; 5 : 383–389. [CrossRef] [PubMed] [Google Scholar]
- Maiztegui JI, Fernandez NJ, de Damilano AJEfficacy of immune plasma in treatment of Argentine haemorrhagic fever and association between treatment and a late neurological syndrome. Lancet 1979 ; 2 : 1216–1217. [CrossRef] [Google Scholar]
- Salami K, Gouglas D, Schmaljohn C, et al. A review of Lassa fever vaccine candidates. Curr Opin Virology 2019 ; 37 : 105–111. [CrossRef] [Google Scholar]
- Tang-Huau TL, Feldmann H, Rosenke KAnimal models for Lassa virus infection. Curr Opin Virol 2019 ; 37 : 112–117. [CrossRef] [PubMed] [Google Scholar]
- WHO Target Product Profile for Lassa virus Vaccine. https://www.who.int/publications/m/item/who-target-product-profile-for-lassa-virus-vaccine. [Google Scholar]
- Yadouleton A, Picard C, Rieger T, et al. Lassa fever in Benin : description of the 2014 and 2016 epidemics and genetic characterization of a new Lassa virus. Emerg Microbes Infect 2020; 9 : 1761–70. [CrossRef] [PubMed] [Google Scholar]
- Kafetzopoulou LE, Pullan ST, Lemey P, et al. Metagenomic sequencing at the epicenter of the Nigeria 2018 Lassa fever outbreak. Science 2019 ; 363 : 74–77. [Google Scholar]
- Cashman KA, Wilkinson ER, Shaia CI, et al. A DNA vaccine delivered by dermal electroporation fully protects cynomolgus macaques against Lassa fever. Hum Vacc Immunother 2017 ; 13 : 2902–2911. [CrossRef] [PubMed] [Google Scholar]
- Jiang J, Banglore P, Cashman KA, et al. Immunogenicity of a protective intradermal DNA vaccine against lassa virus in cynomolgus macaques. Hum Vacc Immunother 2019 : 1–9. [Google Scholar]
- Ollmann Saphire E. A Vaccine against Ebola Virus. Cell 2020; 181 : 6. [CrossRef] [PubMed] [Google Scholar]
- Geisbert TW, Jones S, Fritz EA, et al. Development of a new vaccine for the prevention of Lassa fever. PLoS Med 2005 ; 2 : e183. [CrossRef] [PubMed] [Google Scholar]
- Cross RW, Woolsey C, Prasad AN, et al. A recombinant VSV-vectored vaccine rapidly protects nonhuman primates against heterologous lethal Lassa fever. Cell Rep 2022; 40 : 111094. [CrossRef] [PubMed] [Google Scholar]
- Safronetz D, Mire C, Rosenke K, et al. A Recombinant Vesicular Stomatitis Virus-Based Lassa Fever Vaccine Protects Guinea Pigs and Macaques against Challenge with Geographically and Genetically Distinct Lassa Viruses. PLoS Negl Trop Dis 2015 ; 9 : e0003736. [CrossRef] [PubMed] [Google Scholar]
- Lukashevich IS, Patterson J, Carrion R, et al. A live attenuated vaccine for Lassa fever made by reassortment of Lassa and Mopeia viruses. J Virol 2005 ; 79 : 13934–13942. [CrossRef] [PubMed] [Google Scholar]
- Kiley MP, Lange JV, Johnson KMProtection of rhesus monkeys from Lassa virus by immunisation with closely related Arenavirus. Lancet 1979 ; 2 : 738. [CrossRef] [Google Scholar]
- Lukashevich IS, Carrion R, Jr, Salvato MS, et al. Safety, immunogenicity, and efficacy of the ML29 reassortant vaccine for Lassa fever in small non-human primates. Vaccine 2008 ; 26 : 5246–5254. [CrossRef] [PubMed] [Google Scholar]
- Carnec X, Mateo M, Page A, et al. A Vaccine Platform against Arenaviruses Based on a Recombinant Hyperattenuated Mopeia Virus Expressing Heterologous Glycoproteins. J Virol 2018 ; 92 : [CrossRef] [PubMed] [Google Scholar]
- Carnec X, Baize S, Reynard S, et al. Lassa virus nucleoprotein mutants generated by reverse genetics induce robust type I IFN response in human dendritic cells and macrophages. J Virol 2011 ; 85 : 12093–12097. [CrossRef] [PubMed] [Google Scholar]
- Mateo M, Reynard S, Carnec X, et al. Vaccines inducing immunity to Lassa virus glycoprotein and nucleoprotein protect macaques after a single shot. Sci Transl Med 2019; 11 : eaaw3163. [PubMed] [Google Scholar]
- Baize S. Une vaccination efficace en dose unique contre la fièvre de Lassa. Med Sci (Paris) 2020; 36 : 844–7. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Mateo M, Reynard S, Journeaux A, et al. A single-shot Lassa vaccine induces long-term immunity and protects cynomolgus monkeys against heterologous strains. Sci Transl Med 2021; 13 : eabf6348. [CrossRef] [PubMed] [Google Scholar]
- Mateo M, Reynard S, Pietrosemoli N, et al. Rapid protection induced by a single-shot Lassa vaccine in male cynomolgus monkeys. Nat Commun 2023; 14 : 1352. [CrossRef] [PubMed] [Google Scholar]
- Tschismarov R, Van Damme P, Germain C, et al. Immunogenicity, safety, and tolerability of a recombinant measles-vectored Lassa fever vaccine : a randomised, placebo-controlled, first-in-human trial. Lancet 2023; 401 : 1267–76. [CrossRef] [PubMed] [Google Scholar]
- Samoilovich SR Pecci Saavedra J, Frigerio MJ, Weissenbacher MC. Nasal and intrathalamic inoculations of primates with Tacaribe virus : protection against Argentine hemorrhagic fever and absence of neurovirulence. Acta Virol 1984 ; 28 : 277–281. [PubMed] [Google Scholar]
- McKee KT J.-R., Oro JG, Kuehne AI, et al. Candid No. 1 Argentine hemorrhagic fever vaccine protects against lethal Junin virus challenge in rhesus macaques. Intervirology 1992 ; 34 : 154–163. [CrossRef] [PubMed] [Google Scholar]
- Maiztegui JI, McKee KT J.-R., Barrera Oro JG, et al. Protective efficacy of a live attenuated vaccine against Argentine hemorrhagic fever. AHF Study Group. J Infect Dis 1998 ; 177 : 277–283. [CrossRef] [PubMed] [Google Scholar]
- Reynard S, Carnec X, Picard C, et al. A MOPEVAC multivalent vaccine induces sterile protection against New World arenaviruses in non-human primates. Nat Microbiol 2023; 8 : 64–76. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Organisation génomique et structurale des Mammarénavirus. Le génome des Mammarénavirus est un génome bisegmenté de polarité ambisens codant quatre protéines. Le segment S code les protéines NP et GPC alors que le segment L code les protéines L et Z. La particule virale des Mammarénavirus est composée des deux segments d’ARN génomiques encapsidés par la nucléoprotéine NP, auxquels est associée la polymérase L. Le génome est contenu dans une enveloppe lipidique dans laquelle sont enchâssés des trimères de glycoprotéines GPC. À l’interface des segments génomiques et de l’enveloppe se trouve la protéine de matrice Z. |
| Dans le texte | |
 |
Figure 2. Distribution géographique des Mammarénavirus causant des fièvres hémorragiques dans l’espèce humaine. En Afrique, le virus Lassa (LASV) circule en Guinée, au Libéria, en Sierra Leone, au Mali, en Cote d’Ivoire, au Burkina Faso, au Bénin, au Togo, au Ghana et au Nigéria. Le virus Lujo (LUJV) a émergé récemment en Zambie et en Afrique du Sud. En Amérique du Sud, le virus Guanarito (GTOV) circule au Vénézuéla, le virus Sabia au Brésil, les virus Machupo (MACV) et Chapare (CHAV) en Bolivie, et le virus JUNV en Argentine. |
| Dans le texte | |
 |
Figure 3. La plateforme vaccinale MOPEVAC. La plateforme vaccinale MOPEVAC est dérivée d’un virus recombinant Mopeia (MOPV) dans lequel six mutations ont été introduites dans le domaine DEDDH pour abroger l’activité exoribonucléasique (ExoN) de la nucléoprotéine NP. Dans cette plateforme, la GPC de MOPV peut etre facilement interchangée avec la GPC d’autres Mammarénavirus, tels que LASV, GTOV, SABV, MACV, CHAV ou JUNV. |
| Dans le texte | |
 |
Figure 4. Vaccination contre la fièvre de Lassa avec les plateformes recombinantes MOPEVAC et rougeole. Les vaccins MOPEVACLAS et MeV-LASV protègent des primates non humain (PNH) contre le virus LASV après une injection un mois avant l’épreuve par LASV Josiah (lignage IV). Une injection de MeV-LASV protège contre les virus LASV-Nigéria et LASV-Bénin des lignages II et VII. Cette injection confère aussi une immunité protectrice a court et long terme, meme en présence d’immunité préexistante contre le virus de la rougeole. |
| Dans le texte | |
 |
Figure 5. Vaccination contre les fièvres hémorragiques du Nouveau Monde avec la plateforme MOPEVAC. Des vaccins MOPEVAC exprimant les GPC des virus Machupo (MACV), Guanarito (GTOV), Junin (JUNV), Chapare (CHAV) et Sabia (SABV) sont disponibles en tant que vaccins monovalents et peuvent etre combinés pour générer le vaccin pentavalent MOPEVACNew. MOPEVACMAC protège des PNH contre la fièvre bolivienne après une simple immunisation. MOPEVACNew protège des PNH contre les fièvres boliviennes et vénézuéliennes après deux immunisations. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




