| Issue |
Med Sci (Paris)
Volume 39, Number 11, Novembre 2023
|
|
|---|---|---|
| Page(s) | 807 - 809 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023147 | |
| Published online | 29 November 2023 | |
Développement précoce du cœur : le film vient de sortir
Early heart development: the movie
Aix-Marseille université, CNRS UMR 7288, Institut de biologie du développement de Marseille, Marseille, France
L’étude de la formation du cœur embryonnaire est essentielle pour comprendre les origines des malformations cardiaques congénitales, qui affectent 1 naissance sur 100 et résultent de défauts dans la morphogenèse cardiaque. Au début de ce processus, les cellules du futur mésoderme cardiaque issues de la gastrulation migrent antérieurement et latéralement vers la région ventrale de l’embryon (Figure 1A). Là, les cellules progénitrices du premier champ cardiaque se différencient en une structure épithéliale appelée le croissant cardiaque, contribuant au myocarde du ventricule gauche et des atriums (oreillettes) du cœur définitif [1]. Le croissant cardiaque se transforme rapidement en tube cardiaque primitif, avec l’apparition des premiers battements. Le tube cardiaque est ainsi le premier organe fonctionnel chez l’embryon, et continue de croître par l’ajout progressif de cellules du deuxième champ cardiaque, qui sont les cellules progénitrices du myocarde du ventricule droit, de la voie efférente et d’une partie du myocarde atrial [1]. Cette croissance intensive du tube cardiaque produit une torsion du tube vers la droite en formant une boucle, et grâce à une étape ultérieure de septation, le simple tube cardiaque est transformé en une pompe à quatre chambres, qui dirige la circulation sanguine générale et pulmonaire. Ainsi, le développement cardiaque précoce fournit une ébauche d’organe essentielle pour les étapes ultérieures du développement, et est contrôlé par des facteurs de transcription impliqués dans les malformations cardiaques congénitales humaines, notamment MESP1 (mesoderm posterior bHLH transcription factor 1), NKX2-5 (NK2 homeobox transcription factor 5) et TBX5 (T-box transcription factor 5). Il est nécessaire d’élucider les mécanismes moléculaires et cellulaires qui distinguent ces différentes populations de cellules progénitrices pour comprendre comment les malformations congénitales, telles que les malformations conotroncales ou de septation atriale, affectent des régions particulières du cœur. En plus, l’identification de ces mécanismes devrait permettre de produire des populations définies de cardiomyocytes afin de modéliser ces anomalies du développement, tester de nouveaux médicaments, ou développer des stratégies de réparation d’un cœur endommagé.
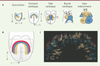 |
Figure 1. Le développement cardiaque précoce. A. Schéma montrant la localisation des cellules progénitrices cardiaques des premier (bleu) et deuxième (beige) champs cardiaques et leurs dérivés dans le cœur embryonnaire. B. Localisation de la population juxta-cardiaque des cellules du premier champ cardiaque (en rouge) et du deuxième champ cardiaque (en beige) au stade du croissant cardiaque (en bleu). C. Imagerie dynamique de la région délimitée par le trait pointillé en B, montrant des mouvements cellulaires très actifs dans le champ juxta-cardiaque, et des mouvements cellulaires du deuxième champ cardiaque vers le pôle artériel du cœur (en haut) et médialement (en bas) pour fermer le tube cardiaque (figure d’après [5] avec la permission d’Elsevier). L : latéral ; M : médial ; A : antérieur ; P : postérieur ; LP : ligne primitive ; TC : tube cardiaque ; AD : atrium droit ; AG : atrium gauche ; VD : ventricule droit ; VG : ventricule gauche ; VE : voie efférente. |
Le développement du cœur est très semblable dans les différentes espèces de mammifères, et la souris constitue un bon modèle pour étudier les mécanismes génétiques et cellulaires de la formation du tube cardiaque. Actuellement, notre compréhension du développement cardiaque précoce repose en grande partie sur l’étude de cœurs conservés par fixation tissulaire et sur des analyses d’expression génique et de lignage cellulaire à des moments définis du développement. En revanche, nous connaissons mal le comportement et les trajectoires de migration des cellules progénitrices cardiaques in vivo lorsqu’elles convergent pour former le tube cardiaque. La microscopie par excitation à deux photons a précédemment été utilisée pour visualiser les premières étapes du développement du cœur murin en culture. Elle a révélé l’existence d’un délai entre la différenciation des cellules des deux champs cardiaques [2]. Les avancées techniques ont récemment permis de suivre des mouvements cellulaires dans l’embryon précoce de souris avec une résolution temporelle et spatiale sans précédent, grâce à la microscopie de fluorescence à feuille de lumière [3] (→) qui permet une acquisition plus rapide des images en trois dimensions et une phototoxicité réduite, et grâce à de nouveaux logiciels qui permettent de traiter la succession au cours du temps d’un grand nombre d’images [4]. Par un tour de force technique, un groupe de chercheurs a maintenant adapté et simplifié cette approche pour produire des films du développement cardiaque précoce. Cette étude révèle le comportement chorégraphié des cellules progénitrices cardiaques individuelles, depuis la gastrulation jusqu’à la formation du tube cardiaque primitif, et fournit de nouvelles informations sur l’acquisition de l’identité cardiaque régionale [5].
→ Voir le Dossier technique de P.P. Girard B.C. Forget, m/s n° 8-9, août‑septembre 2011, page 753
Dominguez et al. ont utilisé un microscope à feuille de lumière commercial ainsi que des progiciels en accès libre, qui ont été simplifiés pour traiter une grande quantité d’images obtenues sur des embryons en culture. Cela leur a permis de tracer rapidement et efficacement les trajectoires des cellules progénitrices cardiaques en utilisant différents rapporteurs fluorescents qui sont activés lors de la gastrulation ou lors de la différenciation cardiaque [5]. Enfin, leurs résultats concernant l’imagerie dynamique de cellules individuelles ont été intégrés avec des données transcriptomiques de cellules uniques pour identifier des sous-populations de cellules progénitrices [5–7].
Que nous apprennent ces nouvelles données ? Le suivi des cellules mésodermiques naissantes a révélé que la densité cellulaire augmente et la vitesse de migration des cellules diminue à mesure que les cellules quittent la ligne primitive et se rapprochent de la région de formation du cœur. Les auteurs font une analogie avec un embouteillage qui se propage le long d’une autoroute, et proposent que ce gradient de densité participe à la croissance postérieure de l’embryon précoce. Des cohortes distinctes de cellules progénitrices précoces et tardives ont été observées, préfigurant les cellules des premier et deuxième champs cardiaques, en cohérence avec des travaux antérieurs sur l’activation séquentielle du facteur de transcription MESP1 [8]. Les auteurs montrent qu’en l’absence de MESP1, le gradient de densité est inversé en raison d’une perte de migration directionnelle, ce qui conduit à l’échec de la formation du tube cardiaque. Même si la direction du mouvement des cellules progénitrices cardiaques est collectivement stéréotypée, en revanche les cellules individuelles s’entremêlent au cours de ce processus, comme en témoignent des trajectoires croisées et la séparation des cellules issues de la même division cellulaire. Cette observation est pertinente pour comprendre quand l’identité régionale cardiaque est établie : le destin régional des cellules ne semble pas être irréversiblement déterminé lors de la gastrulation, mais résulte d’une combinaison du moment de leur naissance durant la gastrulation et de la route de migration qu’elles empruntent. Une fois localisées dans le mésoderme latéral antérieur, ce brassage cellulaire prend fin et les cellules progénitrices cardiaques adoptent un phénotype épithélial. À ce stade, des gènes d’adhérence cellulaire sont activés, et certaines cellules adoptent une position endocardique. Il convient de noter que cette transition mésenchymato-épithéliale semble correspondre à la transition entre une phase de croissance dispersive et une phase cohérente des cellules progénitrices cardiaques, définie auparavant par une analyse clonale rétrospective [9].
Les auteurs ont ensuite mis en évidence deux comportements cellulaires inattendus des cellules qui flanquent le primordium cardiaque, et dont les mouvements « sculptent » la formation du tube cardiaque (Figure 1B, C). Les cellules d’une population latérale, appartenant au champ juxta-cardiaque récemment défini [6] et qui semble être une sous-population du premier champ cardiaque, ont des mouvements chaotiques et rapides et suivent le mouvement du croissant cardiaque vers la partie ventrale de l’embryon. Au contraire, une population de cellules médiales appartenant au deuxième champ cardiaque se déplace soit antérieurement vers le tube cardiaque via une structure en forme de pommeau, qui pourrait correspondre au futur pôle artériel du cœur, soit médialement derrière le tube cardiaque pour former la paroi dorsale du péricarde et assurer la fermeture du tube cardiaque. Les mouvements des cellules médiales sont associés au mouvement de l’endoderme sous-jacent lors de la formation de l’intestin antérieur. Le deuxième champ cardiaque semble donc piloter la morphogenèse du tube cardiaque par des mécanismes de poussée et de traction (Figure 1C).
Ces observations ajoutent une nouvelle dimension à notre compréhension de la cardiogenèse précoce, en fournissant la première visualisation de l’addition dynamique de cellules progénitrices au tube cardiaque. Les nouveaux processus identifiés doivent maintenant être étudiés aux échelles cellulaire et moléculaire. Dominguez et coll. ont montré que les mouvements antérieurs et médiaux des cellules du deuxième champ cardiaque échouaient chez des embryons mutants dépourvus du facteur de transcription ISL1, déjà impliqué dans le développement du deuxième champ. De plus, ils ont révélé des mouvements retardés et désorganisés de l’épithélium cardiaque précoce chez les embryons mutants dépourvus de NKX2-5 [5]. L’imagerie dynamique sera vraisemblablement instructive dans l’analyse d’autres modèles murins de malformations cardiaques congénitales. En outre, le suivi de cellules au cours des étapes ultérieures du déploiement du deuxième champ cardiaque permettra de comprendre comment les cellules sont allouées aux différents pôles du tube cardiaque. Néanmoins, cette exploration posera des défis techniques supplémentaires car il faudra être capable de cultiver des embryons de plus en plus volumineux et d’analyser des ensembles de données encore plus grands.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Buckingham M, Meilhac S, Zaffran S. Building the mammalian heart from two sources of myocardial cells. Nat Rev Genet 2005 ; 6 : 826–835. [CrossRef] [PubMed] [Google Scholar]
- Ivanovitch K, Temino S, Torres M. Live imaging of heart tube development in mouse reveals alternating phases of cardiac differentiation and morphogenesis. eLife 2017; 6. [CrossRef] [PubMed] [Google Scholar]
- Girard PP, Forget BC. Microscopie de fluorescence à feuille de lumière : la face cachée de l’échantillon enfin dévoilée. Med Sci (Paris) 2011 ; 27 : 753–762. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- McDole K, Guignard L, Amat F, et al. In toto imaging and reconstruction of post implantation mouse development at the single-cell level. Cell 2018 ; 175 : 859–76 e33. [CrossRef] [PubMed] [Google Scholar]
- Dominguez MH, Krup AL, Muncie JM, Bruneau BG. Graded mesoderm assembly governs cell fate and morphogenesis of the early mammalian heart. Cell 2023; 186 : 479–96 e23. [CrossRef] [PubMed] [Google Scholar]
- Tyser RCV, Ibarra-Soria X, McDole K, et al. Characterization of a common progenitor pool of the epicardium and myocardium. Science 2021; 371. [Google Scholar]
- Kelly RG. The heart field transcriptional landscape at single-cell resolution. Dev Cell 2023; 58 : 257–66. [CrossRef] [PubMed] [Google Scholar]
- Lescroart F, Chabab S, Lin X, et al. Early lineage restriction in temporally distinct populations of Mesp1 progenitors during mammalian heart development. Nat Cell Biol 2014 ; 16 : 829–840. [CrossRef] [PubMed] [Google Scholar]
- Meilhac SM, Esner M, Kelly RG, et al. The clonal origin of myocardial cells in different regions of the embryonic mouse heart. Dev Cell 2004 ; 6 : 685–698. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Le développement cardiaque précoce. A. Schéma montrant la localisation des cellules progénitrices cardiaques des premier (bleu) et deuxième (beige) champs cardiaques et leurs dérivés dans le cœur embryonnaire. B. Localisation de la population juxta-cardiaque des cellules du premier champ cardiaque (en rouge) et du deuxième champ cardiaque (en beige) au stade du croissant cardiaque (en bleu). C. Imagerie dynamique de la région délimitée par le trait pointillé en B, montrant des mouvements cellulaires très actifs dans le champ juxta-cardiaque, et des mouvements cellulaires du deuxième champ cardiaque vers le pôle artériel du cœur (en haut) et médialement (en bas) pour fermer le tube cardiaque (figure d’après [5] avec la permission d’Elsevier). L : latéral ; M : médial ; A : antérieur ; P : postérieur ; LP : ligne primitive ; TC : tube cardiaque ; AD : atrium droit ; AG : atrium gauche ; VD : ventricule droit ; VG : ventricule gauche ; VE : voie efférente. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




