| Issue |
Med Sci (Paris)
Volume 39, Number 10, Octobre 2023
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 783 - 786 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2023106 | |
| Published online | 09 November 2023 | |
Un shot de synTac pour activer la réponse cytotoxique des lymphocytes T CD8+ spécifiques du VIH
A shot of synTac to activate CD8+ T cells cytotoxic specific response against HIV
1
M2 Immunologie Translationnelle et Biothérapies (ITB), mention BMC, Sorbonne université, Paris, France
2
Institut Pasteur, université de Paris, unité HIV inflammation et persistance, Paris, France
a chfle@live.fr
b alexis.gachon@outlook.fr
c asier.saez-cirion@pasteur.fr
Dans le cadre de leur module d’analyse scientifique, des étudiants des Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (mention biologie moléculaire et cellulaire, parcours immunologie, Sorbonne université) se sont penchés sur la littérature et ont pris la plume pour partager avec les lecteurs de m/s quelques-uns des faits marquants de l’actualité en immunologie. Voici une sélection de ces nouvelles, illustrant certaines des stratégies actuellement développées pour optimiser les immunothérapies.
© 2023 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (mention biologie moléculaire et cellulaire), parcours immunologie, Sorbonne université

Équipe pédagogique
Encarnita Mariotti-Ferrandiz (Maître de Conférences Sorbonne Université, Responsable du Master 2 I2S)
encarnita.mariotti@sorbonne-universite.fr
Véronique Mateo (Maître de Conférences Sorbonne Université, Responsable du Master 2 ITB)
veronique.mateo@sorbonne-universite.fr
Sophie Sibéril (Maître de Conférences Sorbonne Université, Responsable du parcours Immunologie)
sophie.siberil@sorbonne-universite.fr
Toute l’équipe pédagogique remercie également chaleureusement les différents tuteurs, experts dans les domaines se rapportant aux Nouvelles, qui ont accompagné avec bienveillance et enthousiasme le travail de nos étudiants !
Série coordonnée par Sophie Sibéril.
De nos jours, l’éradication du virus de l’immunodéficience humaine (VIH) reste un enjeu de santé publique majeur puisqu’aucun traitement ne permet sa guérison définitive. Les traitements antirétroviraux (TAR) existants permettent de contrôler la charge virale, empêchant ainsi le développement de la maladie. Cependant, ce traitement possède plusieurs inconvénients : traitement à vie, comorbidités persistantes et circulation plus fréquente de souches du virus résistantes à ces traitements.
Les lymphocytes T (LT) CD8+ jouent un rôle majeur dans le contrôle des infections par les virus tels que le cytomégalovirus (CMV) ou le VIH [1]. En phase d’infection chronique par le CMV, les LT CD8+ activés et différenciés vont lyser spécifiquement les cellules infectées, permettant ainsi de maîtriser l’infection. Dans le cas du VIH, lors de la phase aiguë, une forte réponse T est observée, accompagnée par une fréquence élevée de LT CD8+, contrôlant partiellement l’infection, avec une charge virale qui diminue mais ne disparaît pas ; les LT CD8+ sont alors hyper-activés et finissent par avoir un phénotype qu’on qualifie d’épuisement et par perdre leurs fonctions [2].
Certains sujets sont capables de contrôler naturellement l’infection par le VIH via une réponse LT CD8+ très puissante [1]. Bien que minoritaires, ils apportent la preuve que la réponse lymphocytaire cytotoxique peut réprimer efficacement le VIH via la lyse des cellules infectées. Un enjeu important de la recherche sur le VIH est donc d’obtenir un effet similaire chez des sujets « non contrôleurs » en renforçant la réponse des LT CD8+. Dans ce but, Mengyan Li et al. ont développé une protéine immunostimulante, nommée SynTacSTM (synapse immunologique artificielle) (désignée dans cet article synTac), capable de mimer une synapse immunologique entre une cellule présentatrice d’antigène (CPA) et un LT CD8+. Lors de la formation d’une synapse immunologique, différents signaux de stimulation sont délivrés aux LT CD8+ [3]. Le signal 1 est transmis à la suite de la reconnaissance spécifique par le récepteur T de l’antigène (TCR, T cell receptor) d’un peptide antigénique présenté par des molécules du complexe majeur d’histocompatibilité (CMH) de classe I. Le deuxième signal requiert l’interaction entre des molécules de costimulation (par exemple, 4-1BB, CD28, OX-40) exprimés par les LT avec leurs ligands sur la membrane des CPA. Le signal 3 est enclenché à la suite d’une stimulation cytokinique.
La structure de la molécule synTac permet de donner les deux premiers signaux (Figure 1). Le signal 1 est apporté par un complexe moléculaire formé d’un peptide d’intérêt, d’une molécule HLA de classe I et de la bêta-2-microglobuline (β2M). Le peptide est associé de manière covalente à la β2M afin de conserver la spécificité antigénique [4]. Le signal 2 de costimulation est soit délivré par un fragment d’anticorps de type scFv (single chain variable fragment) dirigé contre la molécule de co-stimulation CD28 (scFv αCD28), soit par le ligand à chaîne unique du récepteur 4-1BB (4-1BBL). De plus, une région constante (Fc) d’IgG1 est fusionnée à la molécule du CMH-I, ce qui permet de générer une molécule dimérique bivalente, avec pour chaque monomère un complexe CMH I / peptide et une molécule permettant le recrutement des molécules de co-stimulation sur les LT. La dimérisation de la structure permet ainsi d’augmenter l’avidité pour la cible.
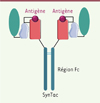 |
Figure 1. Représentation schématique de la structure de la molécule synTac. L’antigène présenté par la molécule est soit le peptide SL9 du VIH soit le peptide pp65 du CMV. La protéine β2M (en bleu clair) stabilise le complexe antigène/CMH-I et est reliée soit à une molécule de costimulation, 4-1BBL ou αCD28, soit à un motif FLAG témoin (en turquoise). β2M, β2 microglobuline. |
Les synTac SL9 et pp65 permettent l’expansion in vitro des LT CD8+ spécifiques du VIH et du CMV
Afin de tester l’efficacité de ces constructions, les auteurs ont analysé l’induction de réponses cytotoxiques CD8+ par des synTac présentant soit le peptide Gag SL9 du VIH (synTac-SL9) soit le peptide pp65 du CMV (synTac-pp65), tous les deux restreints aux molécules du CMH-I [5–6]. Une molécule synTac témoin ne délivrant que le signal 1 aux LT CD8+ (synTac-FLAG) a été utilisée comme contrôle. Dans ces expériences, des cellules du sang périphérique (PBMC, peripheral blood mononuclear cells) de donneurs co-infectés par le VIH et le CMV ont été stimulés par les différentes molécules synTac. Les résultats montrent que les synTac-SL9 induisent une expansion spécifique des LT CD8+ anti-VIH et que les synTac-pp65 stimulent celle des LT CD8+ anti-CMV, avec une efficacité optimale lorsque les molécules synTac-SL9-αCD28 et synTac-pp65-αCD28 sont utilisées. Cependant, le taux de LT CD8+ anti-VIH, obtenu à la suite d’un traitement synTac-SL9, est plus faible que celui de LT CD8+ anti-CMV obtenu après un traitement synTac-pp65. Cette variation de la capacité d’expansion entre les deux populations de LT CD8+ semble corrélée à une plus forte expression de marqueurs d’épuisement, PD-1 et LAG-3, sur les LT CD8+ spécifiques de SL9, affaiblissant l’efficacité des synTac-SL9 [7].
Après stimulation avec les molécules synTac, les LT CD8+ présentent des fonctions cytotoxiques et une production de cytokines accrues in vitro
Les chercheurs ont ensuite étudié l’effet du traitement synTac sur les capacités fonctionnelles des LT CD8+. Après traitement avec les synTac, les LT CD8+ mis en présence de cellules modifiées capables de présenter les peptides SL9 ou pp65, produisent plus de cytokines pro-inflammatoires, telles que l’interféron gamma (IFN-γ) et le TNF-α (tumor necrosis factor alpha) et ont une expression augmentée de la molécule CD107, qui est un marqueur de dégranulation traduisant leur activité cytotoxique. Cet effet a aussi été observé avec les LT CD8+ spécifiques stimulés par synTac-FLAG, en absence donc de co-stimulation, même si les effets associés sont moindres. Les résultats obtenus avec le synTac-FLAG pourraient s’expliquer par le fait que la grande majorité des LT spécifiques ciblés sont des LT effecteurs mémoires, pour lesquels le seul apport du signal 1 est suffisant à leur activation [8]. Cependant, le phénotype « effecteur mémoire », qui correspond à un stade de différenciation avancée, peut être associé chez les patients à une expression importante d’épuisement fonctionnel, il est donc important de développer des molécules thérapeutiques permettant d’apporter à la fois des signaux antigéniques et de co-stimulation.
Les LT CD8+ sont capables in vitro de lyser les cellules infectées par le VIH ou le CMV à la suite d’un traitement synTac
Pour évaluer la capacité des LT CD8+, activés par un traitement synTac, à lyser des cellules infectées par le VIH ou le CMV, les chercheurs ont utilisé des cellules infectées par des virus rapporteurs exprimant la luciférase. Ils ont ensuite mis les cellules infectées par le VIH ou le CMV en co-culture avec des PBMC traités respectivement avec les synTac-SL9 ou les synTac-pp65. Les PBMC traités ont montré une augmentation de leurs fonctions lytiques par rapport à des PBMC non traités avec les synTac. L’utilisation de synTac permet, in vitro, une expansion spécifique de LT CD8+ ciblant l’antigène présenté. Cette expansion est associée à une activation de ces LT CD8+ qui sont alors capables de détruire plus efficacement des cellules infectées.
Les traitements synTac induisent in vivo une expansion des lymphocytes T CD8+, de manière antigène-dépendante, associée à une diminution de l’infection
Les chercheurs ont ensuite évalué les performances des molécules synTac in vivo. Pour cela, ils ont utilisé des souris NOD scid gamma (NSG) humanisées [9]. Ces souris présentent un déficit immunitaire profond et tolèrent ainsi les greffes de cellules humaines. Après la greffe de LT CD8+ spécifiques du VIH et du CMV suivie d’une injection des molécules synTac, une forte expansion des LT CD8+ spécifiques du CMV et du VIH est observée. Comme dans le cas des expériences menées in vitro, plus de 90 % des cellules ayant proliféré se sont avérées être des cellules effectrices mémoires.
Des souris immunodéficientes NSG (Nod SCID gamma) ont alors été greffées avec des cellules fibroblastiques MRC-5 infectées par le CMV ou avec des PBMC humains infectés par le VIH avant d’être traitées ou non par les différents synTac. Le traitement synTac induit une augmentation de l’inhibition de l’infection par le CMV ou le VIH par les LT CD8+, comparativement à des souris non traitées.
Cependant, les expériences évaluant l’efficacité d’inhibition du VIH, in vitro et in vivo, ont été faites à partir de PBMC d’individus sous traitement ART (antiretroviral therapy). Les personnes sous traitement présentent une plus faible fréquence de LT CD8+ spécifiques du VIH. La question se pose donc de savoir si les effets des synTac sont dus à une augmentation de ce faible nombre initial ou si cet effet traduit également une amélioration des propriétés antivirales de ces LT CD8+. Il serait intéressant de comparer l’effet du traitement synTac ainsi observé avec son effet sur des PBMC issus de patients présentant une virémie non contrôlée, accompagnée d’une fréquence de LT CD8+ plus élevée.
Conclusion et perspectives
Les auteurs de l’article ont donc mis au point une molécule, synTac, capable de stimuler spécifiquement l’activation, l’expansion et/ou la différenciation des LT CD8+ antiviraux in vitro et in vivo, se traduisant par une augmentation de l’activité antivirale de ces lymphocytes (Figure 2). L’activation d’une réponse immunitaire spécifique ainsi obtenue, associée à une suppression efficace de l’infection par le VIH et par le CMV dans un modèle murin, positionne les synTac comme possibles molécules à usage thérapeutique, rendant pertinentes des explorations mécanistiques plus approfondies.
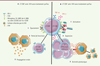 |
Figure 2. Représentation schématique de l’effet des synTacs sur les LT CD8+. A. Sans traitement synTacs, les LT CD8+ anti-VIH sont hyperactivés et finissent par s’épuiser (expression de PD-1). Les LT CD8+ perdent alors leurs fonctions et ne sont plus capables de lyser les cellules infectées. L’infection par le VIH n’est plus contrôlée, la charge virale augmente. B. Le traitement synTac active les LT CD8+ de manière antigène-dépendante. Cela se traduit par l’augmentation de la sécrétion de cytokines pro-inflammatoires, l’expansion des LT CD8+ effecteurs mémoires et une activité cytolytique accrue contre les cellules infectées. |
Cependant, l’expression de points de contrôle immunitaire comme PD-1 par des lymphocytes de sujets présentant une infection chronique par le VIH, peut être un frein à l’efficacité des synTac. Il devient donc important d’explorer si ces défauts persistent suite à l’expansion induite par le traitement synTac. De plus, il serait envisageable de combiner les molécules synTac avec d’autres stratégies, telles que le transfert adoptif de LT CD8+, afin d’obtenir une efficacité anti-virale optimale.
On peut penser qu’à l’avenir, cette stratégie « synTac » peut être facilement adaptée, d’une part en sélectionnant des antigènes reconnus pour stimuler l’expansion ciblée de réponses dominantes et sous-dominantes et d’autre part, en adaptant le choix de ces antigènes en fonction des mutations virales qui permettent aux virus d’échapper au système immunitaire.
Enfin, l’utilisation du CMV dans cette étude en tant que modèle comparatif d’infection a mis en lumière la versatilité de la molécule synTac, dont la structure peut être facilement adaptée afin de cibler d’autres pathogènes, voire des cellules tumorales.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Collins D, Gaiha GD, Walker BD. CD8+ T cells in HIV control, cure and prevention. Nat Rev Immunol 2020; 20 : 471–82. [CrossRef] [PubMed] [Google Scholar]
- Fenwick G, Joo V, Jacquier P, et al. T-cell exhaustion in HIV infection. Immunol Rev 2019 ; 292 : 149–163. [CrossRef] [PubMed] [Google Scholar]
- Watts TH. TNF/TNFR family members in costimulation of T cell responses. Annu Rev Immunol 2005 ; 23 : 23–68. [CrossRef] [PubMed] [Google Scholar]
- Mitaksov V, Truscott SM, Lybarger L, et al. Structural engineering of pMHC reagents for T cell vaccines and diagnostics. Chem Biol 2007 ; 14 : 909–922. [CrossRef] [PubMed] [Google Scholar]
- Ogg GS, Jin X, Bonhoeffer S, et al. Quantitation of HIV-1-specific cytotoxic T lymphocytes and plasma load of viral RNA. Science 1998 ; 279 : 2103–2106. [CrossRef] [PubMed] [Google Scholar]
- Diamond DJ, York J, Sun JY, et al. Development of a candidate HLA A*0201 restricted peptide-based vaccine against human cytomegalovirus infection. Blood 1997 ; 90 : 1751–1767. [CrossRef] [PubMed] [Google Scholar]
- Wykes MN, Lewin SR. Immune checkpoint blockade in infectious diseases. Nat Rev Immunol 2018 ; 18 : 91–104. [CrossRef] [PubMed] [Google Scholar]
- McLane LM, Banerjee PP, Cosma GL, et al. Differential localization of T-bet and Eomes in CD8 T cell memory populations. J Immunol 2013 ; 190 : 3207–3215. [CrossRef] [PubMed] [Google Scholar]
- Flerin NC, Bardhi A, Zheng JH, et al. Establishment of a Novel Humanized Mouse Model To Investigate In Vivo Activation and Depletion of Patient-Derived HIV Latent Reservoirs. J Virol 2019 ; 93(6) : e02051–e02018. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Représentation schématique de la structure de la molécule synTac. L’antigène présenté par la molécule est soit le peptide SL9 du VIH soit le peptide pp65 du CMV. La protéine β2M (en bleu clair) stabilise le complexe antigène/CMH-I et est reliée soit à une molécule de costimulation, 4-1BBL ou αCD28, soit à un motif FLAG témoin (en turquoise). β2M, β2 microglobuline. |
| Dans le texte | |
 |
Figure 2. Représentation schématique de l’effet des synTacs sur les LT CD8+. A. Sans traitement synTacs, les LT CD8+ anti-VIH sont hyperactivés et finissent par s’épuiser (expression de PD-1). Les LT CD8+ perdent alors leurs fonctions et ne sont plus capables de lyser les cellules infectées. L’infection par le VIH n’est plus contrôlée, la charge virale augmente. B. Le traitement synTac active les LT CD8+ de manière antigène-dépendante. Cela se traduit par l’augmentation de la sécrétion de cytokines pro-inflammatoires, l’expansion des LT CD8+ effecteurs mémoires et une activité cytolytique accrue contre les cellules infectées. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




