| Issue |
Med Sci (Paris)
Volume 39, Number 8-9, Août–Septembre 2023
|
|
|---|---|---|
| Page(s) | 599 - 602 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2023091 | |
| Published online | 11 September 2023 | |
Les séquanamycines, puissants macrolides oraux anti-tuberculeux dérivés d’un produit naturel
Discovery of natural product-derived sequanamycins as potent oral anti-tuberculosis agents
1
Sanofi R&D, Infectious diseases unit, 31036 Toulouse, France
2
Evotec ID (LYON) SAS, Lyon, France
3
Sanofi R&D, Integrated drug discovery, Vitry-sur-Seine, France
La tuberculose, une infection causée par la mycobactérie Mycobacterium tuberculosis, reste une menace de santé publique avec l’émergence de souches de M. tuberculosis résistantes aux traitements actuels [1]. Il est donc urgent de découvrir et de produire de nouveaux antibiotiques anti-tuberculeux efficaces, actifs sur les souches multi-résistantes et avec des durées de traitement plus courtes. La séquanamycine A (SEQ-A), un macrolide d’origine naturelle produit par la bactérie Allokutzneria albata, a été découverte en 1969. Ce macrolide présentait une activité prometteuse contre M. tuberculosis avec une CMI (concentration minimale inhibant 80 % de la réplication du bacille) de 1,4 µM, contrairement aux macrolides classiques, tels que l’érythromycine (CMI : 128 µM) et la clarithromycine (CMI : 8 µM), qui sont très peu efficaces. L’arrivée sur le marché de la rifampicine à la même époque a rendu le développement pharmaceutique de nouveaux médicaments anti-tuberculeux moins pertinent, et SEQ-A a été oubliée. Plus récemment, la résistance de M. tuberculosis aux anti-tuberculeux de première ligne a relancé l’intérêt de trouver de nouvelles familles d’antibiotiques actives contre cette mycobactérie.
Le ribosome bactérien, la cible des macrolides (sous-unité 50S), a récemment été validé comme cible thérapeutique contre la tuberculose par l’utilisation du linézolide, qui a permis de traiter les formes les plus résistantes de la maladie et de réduire la durée de traitement [2, 3]. Dans la course aux nouvelles classes d’agents anti-tuberculeux, nous nous sommes réintéressés à SEQ-A, même si plusieurs projets de recherche visant à optimiser l’activité des macrolides classiques contre la tuberculose avaient échoué précédemment [4]. Notre programme d’optimisation de SEQ-A, mené dans le cadre d’un partenariat entre six laboratoires privés et publics, a conduit à concevoir un analogue prometteur de la séquanamycine naturelle : SEQ-9 [5].
SEQ-A est un macrocycle à 14 chaînons, comme l’érythromycine, dont elle se différencie par le nombre de sucres latéraux (trois au lieu de deux) et par leur nature (mycarose en position C3, kétoallose en C5, et mycinose en C13). La première co-cristallisation de deux séquanamycines avec le ribosome de la bactérie Thermus thermophilus a mis en évidence le site ribosomique d’interaction avec les séquanamycines dans le tunnel de sortie des peptides en cours de synthèse : les séquanamycines interagissent avec l’ARN ribosomique 23S et la protéine L22 du ribosome, tout comme l’érythromycine [6]. Des liaisons hydrogènes spécifiques aux séquanamycines permettent un ancrage supplémentaire au ribosome et contribuent à leur forte affinité pour cette organelle.
Les macrolides classiques induisent l’expression du gène erm37 codant une méthyltransférase qui méthyle l’ARN ribosomique 23S mycobactérien sur l’adénine en position 2058 (A2058) [7]. Leur affinité pour le ribosome méthylé s’en trouve réduite, ce qui se traduit par une perte d’activité contre M. tuberculosis [8]. Les séquanamycines induisent également cette méthylation, mais leur liaison au ribosome reste forte et l’inhibition de la synthèse protéique est maintenue (tandis qu’elle devient 100 fois moindre avec l’érythromycine lorsque le ribosome est méthylé). La co-cristallisation des séquanamycines avec le ribosome méthylé ou non méthylé de M. tuberculosis a permis de comprendre pourquoi elles conservent cette forte affinité pour le ribosome malgré la méthylation, contrairement à l’érythromycine. En effet, la méthylation de A2058 induit une interaction stérique défavorable avec le groupe diméthylamino (SP3) du sucre désosamine des macrolides classiques, mais elle ne modifie que très légèrement l’orientation du dérivé méthyloxime (SP2) de la kétolamine des séquanamycines, ce qui leur permet de rester liées au ribosome mycobactérien.
Le programme d’optimisation chimique de SEQ-A et la conception des molécules dérivées ont été guidés par les données structurales obtenues chez Thermus thermophilus [6, 9], par celles de la co-cristallisation avec le ribosome, et par la faisabilité des transformations chimiques. Le macrocycle et les sucres ont été particulièrement travaillés par hémisynthèse à partir de SEQ-A. Des modifications du ketoallose en C5 et l’introduction d’un groupe carbamate en C8 ont permis d’améliorer l’activité in vitro (la CMI) et la stabilité chimique. Toutefois, l’efficacité in vivo de ces composés restait modeste. Par ailleurs, l’introduction d’une amine substituée sur le mycarose a permis, grâce à la basicité (pKa : 8,3) et la lipophilicité globale de la molécule, d’augmenter son accumulation dans les macrophages, qui constituent un important réservoir de M. tuberculosis [10], entraînant une activité dix fois supérieure contre le bacille contenu dans ces cellules. Une efficacité in vivo dépendante de la dose fut alors obtenue. La combinaison des groupes optimisés a conduit au composé SEQ-9, à l’activité et aux propriétés pharmaco-cinétiques améliorées.
SEQ-9 a été co-cristallisée avec le ribosome de M. tuberculosis (Figure 1). SEQ-9 inhibe fortement la synthèse de protéines avec une CI50 (concentration inhibant 50 % de la traduction de M. tuberculosis) de 75 nM, que le ribosome soit méthylé ou non. Elle est active dans différentes conditions in vitro simulant des états et environnements physiologiques : contre des bacilles réplicatifs (CMI de 0,7 µM contre la souche M. tuberculosis de laboratoire H37Rv), ou non réplicatifs mimant l’état hypoxique au cœur des granulomes pulmonaires (concentration bactéricide de 6,3 µM, réduisant d’un facteur 100 le nombre de colonies mycobactériennes), dans les macrophages (CMI de 0,15 µM), contre des souches cliniques de M. tuberculosis sensibles et représentatives des différents lignages actuels circulants dans le monde (CMI comprises entre 0,6 et 1,4 µM), et contre des souches résistantes aux anti-tuberculeux traditionnels (CMI comprises entre 0,5 et 0,8 µM). La synthèse de SEQ-9 a également permis d’optimiser les propriétés d’absorption, de distribution, de métabolisation, d’élimination (ADME) du médicament, et de réduire considérablement l’inhibition du cytochrome CYP3A4, responsable d’interactions médicamenteuses. Des analyses pharmacocinétiques in vivo chez la souris après une administration par voie orale de SEQ-9 ont montré une très bonne distribution de la molécule dans les poumons, l’organe principal où réside et se multiplie M. tuberculosis. L’administration de SEQ-9 par voie orale s’est révélée très efficace dans des modèles murins d’infection par M. tuberculosis. Dès la dose de 37,5 mg/kg, SEQ-9 réduit, d’une façon dépendante de la dose, la charge bactérienne dans différents modèles d’infection aiguë, et avec une activité bactéricide dès la dose de 75 mg/kg dans un modèle d’infection chronique. Lorsqu’elle est utilisée en association avec les antibiotiques les plus puissants actuellement utilisés contre la tuberculose chez l’homme, la bédaquiline, la prétomanide, le linézolide et la pyrazinamide, SEQ-9 augmente leur bactéricidie de façon additive (Figure 2), réduisant d’un facteur 10 les UFC (unités formant des colonies) après quatre semaines d’administration quotidienne à la dose de 300 mg/kg en suspension (dans le méthylcellulose et le tween). Une première optimisation de la formulation de SEQ-9 a montré que la même activité pouvait être obtenue à une dose inférieure à 100 mg/kg (en formulation lipidique). L’ajout de SEQ-9 à la combinaison prétomanide/bédaquiline entraîne une accélération notable de l’élimination de la charge bactérienne pulmonaire des souris infectées par M. tuberculosis. Après huit semaines d’administration, la charge bactérienne restante est réduite à 1 ou 2 bactéries par poumon avec la trithérapie SEQ-9/ prétomanide/bédaquiline contre 50 bactéries sans SEQ-9 (Figure 2). Il convient de noter que des études précédentes avec le même modèle pharmacologique murin avaient montré une contribution similaire du linézolide ajouté à la combinaison prétomanide/bédaquiline [11], et que la puissance de cette trithérapie avait été confirmée chez des patients présentant une tuberculose multi-résistante, dès six mois de traitement [3].
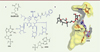 |
Figure 1. Structure de SEQ-9 et son interaction avec le ribosome de M. tuberculosis. Représentation en 2D (a) et en 3D (b) des interactions du mycinose C13 et du kétoallose C5 de SEQ-9 avec, respectivement, la base G748 et la base A2058 de l’ARN 23S du ribosome de M. tuberculosis. Les lignes en traits pointillés représentent les liaisons hydrogènes. |
 |
Figure 2. Administration de SEQ-9 par voie orale en combinaison avec des agents anti-tuberculeux dans un modèle de souris infectées par M. tuberculosis. Les graphiques représentent la moyenne des UFC (unités formant des colonies) dans les poumons de 4 à 5 souris par bras de l’essai thérapeutique, après 4 et 8 semaines de traitement avec différents médicaments anti-tuberculeux utilisés isolément ou en association avec SEQ-9. Doses administrées : SEQ-9 300 mg/kg/jour, bédaquiline (B) 25 mg/kg/jour, prétomanide (Pa) 100 mg/kg/jour, linézolide (L) 100 mg/kg/jour, pyrazinamide (Z) 150 mg/kg/jour. La ligne en traits pointillés indique la moyenne des UFC dans les poumons au début du traitement (jour 0). |
En résumé, les séquanamycines sont les premiers macrolides véritablement actifs contre la tuberculose. Leur utilisation thérapeutique chez les personnes présentant une tuberculose résistante au traitement conventionnel pourrait être une alternative à celle du linézolide, trop toxique pour être largement utilisé, et pourrait contribuer à réduire considérablement la durée du traitement.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- World Health Organization. Global Tuberculosis Report. 2019; https://www.who.int/publications/i/item/9789241565714. [Google Scholar]
- Lee M, Cho SN, Barry CE, et al. Linezolid for XDR-TB–final study outcomes. N Engl J Med 2015 ; 373 : 290–291. [CrossRef] [PubMed] [Google Scholar]
- Conradie F, Everitt D, Crook AM. Treatment of highly drug resistant pulmonary tuberculosis. N Engl J Med 2020; 382 : 2377. [Google Scholar]
- Falzari K, Zhu Z, Pan D, et al. In vitro and in vivo activities of macrolide derivatives against Mycobacterium tuberculosis. Antimicrob Agents Chemother 2005 ; 49 : 1447–1454. [CrossRef] [PubMed] [Google Scholar]
- Zhang J, Lair C, Roubert C, et al. Discovery of natural-product-derived sequanamycins as potent oral anti-tuberculosis agents. Cell 2023; 186 : 1013–25. [CrossRef] [PubMed] [Google Scholar]
- Bulkley D, Innis CA, Blaha G, et al. Revisiting the structures of several antibiotics bound to the bacterial ribosome. Proc Natl Acad Sci USA 2010 ; 107 : 17158–17163. [CrossRef] [PubMed] [Google Scholar]
- Andini N, Nash KA. Intrinsic macrolide resistance of the Mycobacterium tuberculosis complex is inducible. Antimicrob Agents Chemother 2006 ; 50 : 2560–2562. [CrossRef] [PubMed] [Google Scholar]
- Madsen CT, Jakobsen L, Buriankova K, et al. Methyltransferase Erm37 slips on rRNA to confer atypical resistance in Mycobacterium tuberculosis. J Biol Chem 2005 ; 280 : 38942–38947. [CrossRef] [PubMed] [Google Scholar]
- Arenz S, Wilson DN. Blast from the past: reassessing forgotten translation inhibitors, antibiotic selectivity, and resistance mechanisms to aid drug development. Mol Cell 2016 ; 61 : 3–14. [CrossRef] [PubMed] [Google Scholar]
- Dartois V. The path of anti-tuberculosis drugs: from blood to lesions to mycobacteri.al cells. Nat Rev Microbiol 2014 ; 12 : 159–167. [CrossRef] [PubMed] [Google Scholar]
- Tasneen R, Betoudji F, Tyagi S, et al. Contribution of oxazolidinones to the efficacy of novel regimens containing bedaquiline and pretomanid in a mouse model of tuberculosis. Antimicrob Agents Chemother 2016 ; 60 : 270–277. [CrossRef] [PubMed] [Google Scholar]
© 2023 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Structure de SEQ-9 et son interaction avec le ribosome de M. tuberculosis. Représentation en 2D (a) et en 3D (b) des interactions du mycinose C13 et du kétoallose C5 de SEQ-9 avec, respectivement, la base G748 et la base A2058 de l’ARN 23S du ribosome de M. tuberculosis. Les lignes en traits pointillés représentent les liaisons hydrogènes. |
| Dans le texte | |
 |
Figure 2. Administration de SEQ-9 par voie orale en combinaison avec des agents anti-tuberculeux dans un modèle de souris infectées par M. tuberculosis. Les graphiques représentent la moyenne des UFC (unités formant des colonies) dans les poumons de 4 à 5 souris par bras de l’essai thérapeutique, après 4 et 8 semaines de traitement avec différents médicaments anti-tuberculeux utilisés isolément ou en association avec SEQ-9. Doses administrées : SEQ-9 300 mg/kg/jour, bédaquiline (B) 25 mg/kg/jour, prétomanide (Pa) 100 mg/kg/jour, linézolide (L) 100 mg/kg/jour, pyrazinamide (Z) 150 mg/kg/jour. La ligne en traits pointillés indique la moyenne des UFC dans les poumons au début du traitement (jour 0). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




