| Issue |
Med Sci (Paris)
Volume 38, Number 10, Octobre 2022
|
|
|---|---|---|
| Page(s) | 766 - 768 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2022119 | |
| Published online | 11 October 2022 | |
Rôle délétère des lymphocytes B de la zone marginale de la rate dans le remodelage ventriculaire après un infarctus du myocarde
Deleterious role of spleen marginal zone B lymphocytes in ventricular remodeling after myocardial infarction
1
Université Paris Cité, Inserm, PARCC, Paris, France
2
Division of cardiovascular medicine, Cambridge University, Cambridge, Royaume-Uni
L’infarctus du myocarde représente la principale cause de morbidité et de mortalité dans le monde, entraînant des conséquences socio-économiques majeures [1]. Malgré les thérapies disponibles, la mortalité après un infarctus du myocarde reste élevée (taux à 5 ans de l’ordre de 20 %), et la très grande majorité des décès survient après la sortie de l’hôpital, ce qui indique qu’ils sont dus aux conséquences des lésions myocardiques causées par l’infarctus. En effet, la diminution spectaculaire de la mortalité à la phase aiguë de l’infarctus au cours des dernières décennies n’a pas été accompagnée d’une diminution équivalente de l’incidence de l’insuffisance cardiaque. Le nombre de personnes vivant avec une insuffisance cardiaque chronique a d’ailleurs augmenté en raison de l’augmentation du taux de survie après un infarctus et du vieillissement de la population. La prise en charge de l’insuffisance cardiaque est responsable de 1 à 2 % de l’ensemble des dépenses de santé de la population adulte dans les pays industrialisés à revenu élevé, et jusqu’à 10 % de ces dépenses dans une population âgée de plus de 70 ans. Enfin, la phase aiguë de l‘infarctus du myocarde a été liée à l’accélération de l’athérosclérose post-infarctus et à la survenue d’évènements athéro-thrombotiques récurrents. Il est donc nécessaire de développer des nouvelles thérapies pour limiter les conséquences de l’infarctus du myocarde.
Lymphocytes B et réparation cardiaque après un infarctus du myocarde
La réponse immunitaire joue un rôle considérable dans le développement des effets indésirables après un infarctus du myocarde. En particulier, les lymphocytes B produisent la chimiokine CCL7 (C-C chemokine ligand 7) et favorisent le recrutement de monocytes inflammatoires, ce qui entraîne une augmentation des lésions tissulaires et un dysfonctionnement du myocarde [2]. Des lymphocytes B ont également été identifiés dans le tissu adipeux épicardique de patients atteints de maladie coronarienne et de souris présentant un infarctus du myocarde. La déplétion des lymphocytes B réduit l’infiltration des granulocytes neutrophiles cardiaques ainsi que la fibrose interstitielle, et préserve la fraction d’éjection systolique du ventricule gauche après un infarctus du myocarde [3]. Inversement, les lymphocytes B producteurs d’interleukine 10 localisés dans le tissus adipeux péricardique déclenchent la résolution de l’inflammation induite par l’infarctus du myocarde [4]. Ainsi, ces résultats indiquent que les lymphocytes B contrôlent le remodelage du ventricule gauche et la fonction cardiaque après un infarctus du myocarde, mais les mécanismes cellulaires régissant les multiples effets des sous-types de lymphocytes B d’origines tissulaires diverses restent à comprendre.
L’inflammation locale et générale associée à l’infarctus du myocarde est caractérisée par un remodelage marqué des réseaux de cellules de l’immunité innée et de l’immunité adaptative dans le cœur, le sang et les organes lymphoïdes. La rate est un site important d’activation du système immunitaire, avec des changements cellulaires et tissulaires qui sont compatibles avec, d’une part, l’activation de la réponse innée générale, et d’autre part, l’augmentation du traitement des antigènes et le déclenchement d’une mémoire immunitaire. Il existe plusieurs sous-populations de lymphocytes B incluant majoritairement les lymphocytes B1 de type inné et les lymphocytes B2, qui comprennent les lymphocytes B de la zone marginale (lymphocytes MZB) et les lymphocytes B folliculaires. Les lymphocytes MZB et les lymphocytes B folliculaires sont localisés dans le réservoir splénique, mais les étapes de leur développement ainsi que leurs propriétés fonctionnelles sont différentes.
Les lymphocytes B de la zone marginale splénique ont un rôle délétère sur le remodelage et la fonction cardiaques après un infarctus du myocarde
Nous avons donc cherché à définir l’importance des lymphocytes B d’origine splénique et de leurs voies spécifiques de signalisation dans le contrôle du remodelage et de la fonction cardiaque après un infarctus du myocarde. Nous avons montré que la suppression, par génie génétique, des lymphocytes MZB spléniques améliorait le remodelage ventriculaire et la fonction cardiaque après un infarctus du myocarde induit chirurgicalement chez la souris. Bien qu’insoupçonné jusqu’à présent, ce nouveau rôle des lymphocytes MZB dans la réponse aux lésions ischémiques aiguës est cohérent avec leurs propriétés innées et leur situation stratégique à l’interface entre le sang et les tissus lymphoïdes, où ils peuvent détecter les changements dans l’environnement tissulaire et mettre en place rapidement des réponses immunitaires innées. L’effet délétère des lymphocytes MZB est corrélé à l’activation de la signalisation intracellulaire dépendante du micro-ARN 21 (miR21) et du facteur de transcription HIF-1α (hypoxia-inducible factor 1 alpha). L’infarctus du myocarde accroît l’expression de miR21 dans les lymphocytes MZB, ce qui a pour effet d’augmenter la concentration de HIF-1α. La suppression, par génie génétique, de miR21 ou de HIF-1α neutralise les effets délétères des lymphocytes MZB sur le tissu cardiaque [5]. Nous avons également montré le rôle déterminant de la voie de signalisation miR21/HIF-1α dans le contrôle de la production de CCL7 par les lymphocytes MZB. CCL7 contrôle la mobilisation des monocytes pro-inflammatoires de la moelle osseuse vers le compartiment sanguin et leur recrutement dans le tissu cardiaque infarci [5]. Les monocytes pro-inflammatoires sont responsables de l’élimination des débris cellulaires, de la sécrétion de cytokines pro-inflammatoires et de protéases dégradant la matrice extracellulaire, qui, de concert, contribuent à la lésion myocardique [2, 6]. Des analyses bio-informatiques et des expériences d’immuno-précipitation de la chromatine ont permis de montrer que le gène Ccl7 murin est une cible directe de HIF-1α, en révélant l’existence de trois éléments fonctionnels de réponse à l’hypoxie dans le promoteur de ce gène [7].
Stratégies thérapeutiques ciblant les lymphocytes B dans l’infarctus du myocarde
Les lymphocytes B sont donc des acteurs importants du contrôle du remodelage cardiaque après un infarctus du myocarde. Nos résultats viennent renforcer d’autres arguments expérimentaux et cliniques suggérant que ces lymphocytes sont une cible prometteuse pour le traitement des maladies cardiovasculaires. Plusieurs médicaments ciblant les lymphocytes B sont déjà disponibles, comme le rituximab, un anticorps monoclonal dirigé contre la protéine CD20, spécifiquement exprimée par ces lymphocytes. Des études cliniques chez les patients traités par le rituximab ont rapporté certains effets bénéfiques sur le système cardiovasculaire, tels qu’une réduction de l’épaisseur de l’intima-média de la carotide, une amélioration de la dilatation vasculaire dépendante du flux sanguin, ou une diminution de l’épaisseur de la paroi artérielle [8]. Dans un essai clinique de phase I/II, nous avons montré que la perfusion de rituximab dans les 24 heures suivant l’infarctus du myocarde permettait d’éliminer efficacement les lymphocytes B circulants et n’entraînait pas d’effets indésirables sévères [9].
Le rôle nuisible des lymphocytes MZB à la phase aiguë de l’infarctus du myocarde contraste avec leurs propriétés protectrices contre l’athérogenèse en rapport avec leur capacité à moduler la fonction des lymphocytes T folliculaires auxiliaires [10]. Quelles sont les implications cliniques de ces propriétés antagonistes ? Nous proposons qu’une stratégie thérapeutique ciblant les lymphocytes MZB devrait être à la fois sélective et limitée à la phase aigüe de l’infarctus, ce qui permettrait un retour du taux de cellules MZB vers des valeurs physiologiques, tout en réduisant la possibilité, à plus long terme, d’un dommage lié à la perte du rôle anti-athérogène de ces cellules. La stratégie de déplétion des lymphocytes B actuellement testée chez l’homme à la phase aiguë de l’infarctus du myocarde utilise une perfusion unique de rituximab [9]. Cet anticorps cible à la fois les lymphocytes B folliculaires et les MZB. Notons cependant que des lymphocytes B transitoires ayant des propriétés d’immunité innée semblent réapparaître quelques mois après l’administration d’une seule dose faible de rituximab [9]. Ainsi, une faible dose de ce médicament pourrait limiter la perte de lymphocytes B protecteurs contre l’athérogenèse. En outre, le ciblage sélectif de la signalisation miR21 ou HIF-1α dans les lymphocytes MZB, qui n’aurait probablement pas d’impact sur leur propriété anti-athérogène, pourrait constituer une alternative thérapeutique de choix après un infarctus du myocarde.
Conclusion
En conclusion, nos travaux ont révélé le rôle prépondérant de la voie de signalisation miR21/HIF-1α dans l’orientation de la fonction des lymphocytes B de la zone marginale de la rate, qui, en réponse à un infarctus du myocarde, activent la mobilisation et l’infiltration des monocytes pro-inflammatoires dans le myocarde ischémique (Figure 1).
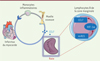 |
Figure 1. Effet délétère des lymphocytes B de la zone marginale de la rate sur le remodelage et la fonction ventriculaires après un infarctus du myocarde. La signalisation miR21/HIF-1α ajuste la capacité des lymphocytes B de la zone marginale à moduler la sécrétion de CCL7, et influe ensuite sur le remodelage cardiaque dépendant des monocytes inflammatoires après l’infarctus. CCL7 : ligand 7 de la famille des C-C-chimiokines ; HIF-1α : facteur induit par l’hypoxie de type 1a ; miR21 : micro-ARN 21. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Timmis A, Townsend N, Gale C, et al. European society of cardiology: Cardiovascular disease statistics 2017. Eur Heart J 2018 ; 39 : 508–579. [CrossRef] [PubMed] [Google Scholar]
- Zouggari Y, Ait-Oufella H, Bonnin P, et al. B lymphocytes trigger monocyte mobilization and impair heart function after acute myocardial infarction. Nat Med 2013 ; 19 : 1273–1280. [CrossRef] [PubMed] [Google Scholar]
- Horckmans M, Bianchini M, Santovito D, et al. Pericardial adipose tissue regulates granulopoiesis, fibrosis, and cardiac function after myocardial infarction. Circulation 2018 ; 137 : 948–960. [CrossRef] [PubMed] [Google Scholar]
- Wu L, Dalal R, Cao CD, et al. IL-10-producing B cells are enriched in murine pericardial adipose tissues and ameliorate the outcome of acute myocardial infarction. Proc Natl Acad Sci USA 2019 ; 116 : 21673–21684. [CrossRef] [PubMed] [Google Scholar]
- Sun Y, Pinto C, Camus S, et al. Splenic marginal zone B lymphocytes regulate cardiac remodeling after acute myocardial infarction in mice. J Am Coll Cardiol 2022; 79 : 632–47. [CrossRef] [PubMed] [Google Scholar]
- Nahrendorf M, Swirski FK. Monocyte and macrophage heterogeneity in the heart. Circ Res 2013 ; 112 : 1624–1633. [PubMed] [Google Scholar]
- Qi D, Wei M, Jiao S, et al. Hypoxia inducible factor 1alpha in vascular smooth muscle cells promotes angiotensin II-induced vascular remodeling via activation of CCL7-mediated macrophage recruitment. Cell Death Dis 2019 ; 10 : 544. [CrossRef] [PubMed] [Google Scholar]
- Porsch F, Binder CJ. Impact of B-cell-targeted therapies on cardiovascular disease. Arterioscl Thromb Vasc Biol 2019 ; 39 : 1705–1714. [CrossRef] [PubMed] [Google Scholar]
- Zhao TX, Aetesam-Ur-Rahman M, Sage AP, et al. Rituximab in patients with acute ST-elevation myocardial infarction: an experimental medicine safety study. Cardiovasc Res 2022; 118 : 872–82. [CrossRef] [PubMed] [Google Scholar]
- Nus M, Sage AP, Lu Y, et al. Marginal zone B cells control the response of follicular helper T cells to a high-cholesterol diet. Nat Med 2017 ; 23 : 601–610. [CrossRef] [PubMed] [Google Scholar]
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Effet délétère des lymphocytes B de la zone marginale de la rate sur le remodelage et la fonction ventriculaires après un infarctus du myocarde. La signalisation miR21/HIF-1α ajuste la capacité des lymphocytes B de la zone marginale à moduler la sécrétion de CCL7, et influe ensuite sur le remodelage cardiaque dépendant des monocytes inflammatoires après l’infarctus. CCL7 : ligand 7 de la famille des C-C-chimiokines ; HIF-1α : facteur induit par l’hypoxie de type 1a ; miR21 : micro-ARN 21. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




