| Issue |
Med Sci (Paris)
Volume 38, Number 6-7, Juin–Juillet 2022
|
|
|---|---|---|
| Page(s) | 524 - 525 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2022073 | |
| Published online | 29 June 2022 | |
L’acétylation de PAX7 contrôle l’auto-renouvellement des cellules souches musculaires
PAX7 acetylation controls muscle stem cell self-renewal
1
Institut NeuroMyoGene (INMG-PGNM), CNRS/UCBL1 UMR5261 - Inserm U1315, Lyon, France
2
Centre Armand-Frappier santé biotechnologie, Institut national de la recherche scientifique (INRS), Unité de recherche mixte INRS-UQAC en santé durable, Laval, Canada
Les cellules souches musculaires, aussi appelées cellules satellites, permettent de régénérer le muscle squelettique adulte en réponse à une blessure [1]. Toutes les cellules satellites expriment le facteur de transcription PAX7 (paired box 7), qui contrôle l’expression de gènes nécessaires à la survie de ces cellules, à leur prolifération et à leur détermination [2]. PAX7 est donc indispensable à la capacité régénérative du muscle tout au long de la vie, et plusieurs études s’appliquent désormais à définir les facteurs qui modifient son expression ou son activité, un objectif crucial pour le développement de nouvelles cibles thérapeutiques en médecine régénérative.
Les modifications post-traductionnelles des protéines peuvent directement influencer leur fonction. Par spectrométrie de masse, nous avons déterminé que la protéine PAX7 possède deux résidus lysine (K) acétylés, K105 et K193. Si K105 est conservé dans la famille des protéines PAX, K193 est unique à PAX7, suggérant un rôle spécifique de l’acétylation de ce résidu sur son activité [3]. Le remplacement expérimental de ces résidus K par des résidus arginine (R) empêche leur acétylation, ce qui diminue fortement la capacité de PAX7 à se lier à l’ADN, particulièrement aux motifs appelés homéodomaines. Cela entraîne une diminution de l’activité transcriptionnelle de PAX7 et une baisse d’expression de ses gènes cibles, notamment de Myf5 (myogenic factor 5), qui code une protéine clé de la détermination myogénique des cellules [2]. L’expression de Myf5 dans les cellules souches musculaires permet donc de tracer leur destin au cours de la régénération.
En effet, les cellules satellites représentent une population hétérogène, dont une petite proportion n’a jamais exprimé Myf5 [4]. L’analyse du mode de division de cette sous-population de cellules satellites dépourvue d’expression de Myf5 (Myf5-) reflète les propriétés d’auto-renouvellement et de détermination des cellules satellites : leur division symétrique produit deux cellules souches filles Myf5-, alors que leur division asymétrique engendre une cellule souche Myf5- et une cellule progénitrice musculaire exprimant Myf5 (Myf5+). Un équilibre entre ces deux modes de division assure le maintien du réservoir de cellules souches et la régénération du tissu musculaire. Il n’est donc pas surprenant qu’une rupture de cet équilibre contribue à l’altération du processus régénératif au cours du vieillissement [5] ou dans des maladies musculaires, telles que la dystrophie de Duchenne [6, 7] (→).
(→) Voir la Nouvelle de C.E. Brun et N.A. Dumont, m/s n° 10, octobre 2016, page 800
En appliquant la technique CRISPR-Cas9 (clustered regularly interspaced short palindromic repeats-CRISPR associated protein 9), nous avons produit des souris mutantes Pax7KR, chez lesquelles le résidu K193 de PAX7 a été remplacé par une arginine (R193) [3]. L’absence d’acétylation de ce résidu n’affecte pas la survie, la prolifération et la différenciation des cellules satellites, mais elle entraîne un déséquilibre entre divisions symétriques et asymétriques des cellules souches, ce qui affecte leur capacité d’auto-renouvellement. La régénération du muscle squelettique induite par des injections répétées d’un agent myonécrotique, la cardiotoxine, est ainsi altérée chez ces souris : les fibres musculaires régénérées sont plus petites et le nombre de cellules satellites est diminué (Figure 1).
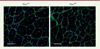 |
Figure 1. La perte d’acétylation du facteur de transcription PAX7 diminue progressivement le réservoir de cellules souches musculaires. Après des injections répétées de cardiotoxine (qui induit une nécrose des cellules musculaires) à une souris témoin (Pax7WT) et à une souris mutante (Pax7KR) chez laquelle un des deux résidus lysine (K) acétylables de PAX7 a été remplacé par une arginine (R) non acétylable, les tissus musculaires de ces souris ont été immunomarqués à l’aide d’anticorps dirigés contre la dystrophine (en vert) et contre PAX7 (en rouge). Les noyaux cellulaires sont colorés en bleu par le DAPI. Noter la différence d’aspect des fibres musculaires régénérées chez la souris mutante par rapport à la souris témoin. La barre d’échelle représente 50 μm. |
Notre équipe a identifié les enzymes responsables du dépôt et de la suppression des marques d’acétylation sur la protéine PAX7 : l’acétyltransférase MYST1 (Moz, Ybf2/Sas3, Sas2, Tip60 family member 1) et la désacétylase SIRT2 (silencing information regulator 2). Les activités respectives de ces deux enzymes déterminent le statut d’acétylation de PAX7 dans les cellules satellites sur fibres musculaires isolées, autant que dans les cellules progénitrices musculaires en culture. En modifiant l’expression ou l’activité de ces enzymes, nous avons constaté que, par leur contrôle de l’acétylation de PAX7, elles peuvent moduler l’expression de ses gènes cibles, notamment Myf5. Ces enzymes peuvent également influencer le mode de division, symétrique ou asymétrique, des cellules satellites, donc leur auto-renouvellement. Ainsi, ces résultats montrent que MYST1 et SIRT2 contrôlent les niveaux d’acétylation de PAX7 pour moduler son activité transcriptionnelle et conséquemment, l’auto-renouvellement des cellules souches musculaires (Figure 2).
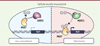 |
Figure 2. L’acétyltransférase MYST1 et la désacétylase SIRT2 régulent l’expression des gènes cibles de PAX7 et l’auto-renouvellement des cellules souches musculaires. Au cours de l’auto-renouvellement de la cellule souche musculaire (cellule satellite), PAX7 est désacétylé par SIRT2, ce qui empêche sa liaison à l’ADN. Dans la cellule commise vers la lignée myogénique (détermination), MYST1 acétyle PAX7, ce qui entraîne sa liaison à l’ADN et l’expression de gènes cibles tels que Myf5. |
Afin d’identifier les gènes cibles de PAX7 affectés par la perte d’acétylation de K193, nous avons analysé le transcriptome des cellules satellites des souris mutantes Pax7KR. Tout d’abord, nous avons montré qu’un nombre important de gènes cibles de PAX7 ont une expression dérégulée dans ces cellules, confirmant le rôle essentiel de l’acétylation de PAX7 pour son activité sur la transcription des gènes cibles. En outre, plusieurs gènes, dont l’expression est modulée par l’acétylation de PAX7, sont impliqués dans les processus de polarité cellulaire et dans l’interaction des cellules souches musculaires avec leur environnement, c’est-à-dire leur niche. L’interaction avec la matrice extracellulaire est notamment essentielle à leur survie, à leur prolifération, à leur auto-renouvellement et à leur différenciation [1, 8]. Certaines protéines contrôlant l’adhérence des cellules satellites à la matrice extracellulaire, telles que la fibronectine et la dystrophine, régulent l’auto-renouvellement de ces cellules en modifiant les proportions de leurs divisions symétriques et asymétriques [6, 9]. Un défaut d’acétylation de PAX7 modifierait donc l’expression de gènes qui contrôlent différents processus moléculaires associés à la polarité cellulaire et à l’adhérence, modulant les propriétés d’auto-renouvellement des cellules souches musculaires.
La fonction des cellules satellites est conditionnée par leur métabolisme. En absence de lésion musculaire, ces cellules sont quiescentes et ont donc de faibles besoins énergétiques [1]. Leur activation modifie la voie principale de production d’énergie [10]. Ce changement s’accompagne d’une disponibilité accrue de l’acétyl-CoA (acetyl coenzyme A) et d’une diminution de la disponibilité de NAD+ (nicotinamide adenine dinucleotide). Or, l’activité de MYST1 est stimulée par l’acétyl-CoA, alors que celle de SIRT2 est stimulée par le NAD+. Il avait été précédemment rapporté que la disponibilité de l’acétyl-CoA et du NAD+ influence la modification post-traductionnelle des histones lors de l’activation des cellules satellites. Nos travaux ont donc montré que les changements métaboliques qui accompagnent cette activation peuvent également avoir des conséquences sur l’acétylation de protéines non histones telles que PAX7.
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Dumont NA, Bentzinger CF, Sincennes MC, Rudnicki MA. Satellite cells and skeletal muscle regeneration. Compr Physiol 2015 ; 5 : 1027–1059. [CrossRef] [PubMed] [Google Scholar]
- Sincennes MC, Brun CE, Rudnicki MA. Concise review: Epigenetic regulation of myogenesis in health and disease. Stem Cells Transl Med 2016 ; 5 : 282–290. [CrossRef] [PubMed] [Google Scholar]
- Sincennes MC, Brun CE, Lin AYT, et al. Acetylation of PAX7 controls muscle stem cell self-renewal and differentiation potential in mice. Nat Commun 2021; 12 : 3253. [CrossRef] [PubMed] [Google Scholar]
- Kuang S, Kuroda K, Le Grand F, Rudnicki MA. Asymmetric self-renewal and commitment of satellite stem cells in muscle. Cell 2007 ; 129 : 999–1010. [CrossRef] [PubMed] [Google Scholar]
- Bernet JD, Doles JD, Hall JK, et al. p38 MAPK signaling underlies a cell-autonomous loss of stem cell self-renewal in skeletal muscle of aged mice. Nat Med 2014 ; 20 : 265–271. [CrossRef] [PubMed] [Google Scholar]
- Dumont NA, Wang YX, von Maltzahn J, et al. Dystrophin expression in muscle stem cells regulates their polarity and asymmetric division. Nat Med 2015 ; 21 : 1455–1463. [CrossRef] [PubMed] [Google Scholar]
- Brun CE, Dumont NA. Déficits intrinsèques des cellules satellites dans la dystrophie musculaire de Duchenne. Med Sci (Paris) 2016 ; 32 : 800–802. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Yennek S, Burute M, Théry M, Tajbakhsh S. Cell adhesion geometry regulates non-random DNA segregation and asymmetric cell fates in mouse skeletal muscle stem cells. Cell Rep 2014 ; 7 : 961–970. [CrossRef] [PubMed] [Google Scholar]
- Bentzinger CF, Wang YX, von Maltzahn J, et al. Fibronectin regulates Wnt7a signaling and satellite cell expansion. Cell Stem Cell 2013 ; 12 : 75–87. [CrossRef] [PubMed] [Google Scholar]
- Ryall JG, Dell’Orso S, Derfoul A, et al. The NAD+-dependent SIRT1 deacetylase translates a metabolic switch into regulatory epigenetics in skeletal muscle stem cells. Cell Stem Cell 2015 ; 16 : 171–183. [CrossRef] [PubMed] [Google Scholar]
© 2022 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. La perte d’acétylation du facteur de transcription PAX7 diminue progressivement le réservoir de cellules souches musculaires. Après des injections répétées de cardiotoxine (qui induit une nécrose des cellules musculaires) à une souris témoin (Pax7WT) et à une souris mutante (Pax7KR) chez laquelle un des deux résidus lysine (K) acétylables de PAX7 a été remplacé par une arginine (R) non acétylable, les tissus musculaires de ces souris ont été immunomarqués à l’aide d’anticorps dirigés contre la dystrophine (en vert) et contre PAX7 (en rouge). Les noyaux cellulaires sont colorés en bleu par le DAPI. Noter la différence d’aspect des fibres musculaires régénérées chez la souris mutante par rapport à la souris témoin. La barre d’échelle représente 50 μm. |
| Dans le texte | |
 |
Figure 2. L’acétyltransférase MYST1 et la désacétylase SIRT2 régulent l’expression des gènes cibles de PAX7 et l’auto-renouvellement des cellules souches musculaires. Au cours de l’auto-renouvellement de la cellule souche musculaire (cellule satellite), PAX7 est désacétylé par SIRT2, ce qui empêche sa liaison à l’ADN. Dans la cellule commise vers la lignée myogénique (détermination), MYST1 acétyle PAX7, ce qui entraîne sa liaison à l’ADN et l’expression de gènes cibles tels que Myf5. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




