| Issue |
Med Sci (Paris)
Volume 38, Number 5, Mai 2022
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 497 - 500 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2022064 | |
| Published online | 24 May 2022 | |
Les lipases de Mycobacterium tuberculosis, nouvelles cibles pour lutter contre la tuberculose
Mycobacterium tuberculosis lipases, new targets in the fight against tuberculosis
1
Master 2 Microbiologie intégrative et fondamentale, Aix Marseille Université, Marseille, France
2
Aix Marseille Université, CNRS, LCB UMR, 7283, IMM, Marseille, France
a gwendoline.degre@etu.univ-amu.fr
b jonas.desjardins@etu.univ-amu.fr
c julien.garcia.3@etu.univ-amu.fr
d clement.vanderstraeten@etu.univ-amu.fr
e jeremy.wozniak@etu.univ-amu.fr
f latifi@imm.cnrs.fr
Avec un quart de la population mondiale infectée et 1,5 millions de décès en 2020, la tuberculose est considérée par l’Organisation mondiale de la santé (OMS) comme une urgence sanitaire mondiale [1]. Cette infection est provoquée par l’agent pathogène Mycobacterium tuberculosis (ou bacille de Koch) [2], une mycobactérie appartenant à l’ordre des Actinomycètes. Ce genre bactérien est caractérisé par la présence d’une paroi cellulaire, appelée mycomembrane, épaisse, très hydrophobe et riche en glycolipides et en acides mycoliques [3].
La tuberculose se transmet par voie aérienne via des gouttelettes contenant les bacilles rejetés par les malades lors des expectorations [4] (Figure 1A). Elle est caractérisée par deux phases : une phase active, pendant laquelle l’individu est contagieux, et une phase latente. Au cours de cette phase de latence, la bactérie va chercher à déjouer le système immunitaire en rentrant en phase de dormance avec, notamment, la formation de granulomes tuberculeux. En effet, lors de l’infection, des cellules immunitaires s’agrègent pour former des structures complexes portant le nom de granulomes tuberculeux, comprenant des macrophages riches en lipides, dits macrophages spumeux. Les individus porteurs de ces granulomes ne sont pas contagieux. Mais les bactéries dormantes peuvent être réactivées, ce qui aboutit à la reprise de la phase active [5].
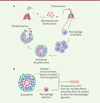 |
Figure 1. Cycle de vie de Mycobacterium tuberculosis et modèles utilisés pour l’obtention d’inclusions lipidiques intracytosoliques. A. Représentation du cycle infectieux de M. tuberculosis. Les bacilles sont expectorés des voies respiratoires du malade via des gouttelettes. Les bactéries vont ensuite contaminer un nouvel hôte en se logeant dans ses alvéoles pulmonaires. Les macrophages alvéolaires vont venir phagocyter la bactérie, et le recrutement de cellules immunitaires aboutit à la formation du granulome tuberculeux. Après un certain temps, le granulome peut se rompre, entrainant la dissémination des bacilles dans l’organisme, rendant l’hôte de nouveau malade et contagieux. B. Au centre du granulome, les bactéries peuvent être libres dans le caséum, un milieu riche en lipides ou être présentes dans les lysosomes de macrophages spumeux riches en corps lipidiques. Lors de la phase de dormance, les bactéries vont accumuler des réserves lipidiques sous forme d’inclusions lipidiques intracytosoliques (ILI) (représentation graphique créée avec BioRender). |
Bien que la tuberculose pulmonaire soit la plus répandue, il existe d’autres formes de la maladie dans lesquelles les bacilles peuvent se propager dans d’autres tissus ou organes, tels que le foie et les os. Ces formes sont connues sous le terme de tuberculose extrapulmonaire. La maladie est dite miliaire ou disséminée lorsque plusieurs tissus sont infectés simultanément [6].
Depuis 1921, un traitement préventif contre la tuberculose existe. Il consiste en un vaccin, le BCG (bacille de Calmette et Guérin), très efficace chez l’enfant. L’efficacité de ce vaccin est toutefois plus limitée chez l’adolescent et l’adulte pour prévenir la tuberculose pulmonaire, qui est la forme la plus courante [1].
Les traitements actuels, composés d’un cocktail d’antibiotiques administré pendant six mois à deux ans, peuvent être à l’origine de l’apparition de souches résistantes1, qui nécessitent des traitements beaucoup plus coûteux. Aussi, la recherche s’oriente vers l’identification de nouvelles stratégies thérapeutiques ciblant des molécules nécessaires à la survie de M. tuberculosis chez son hôte.
Des inclusions lipidiques essentielles à la réactivation de M. tuberculosis
Au cours de l’infection, les bactéries ont la capacité d’accumuler dans leur cytoplasme des lipides sous forme d’inclusions lipidiques intracytosoliques, ou ILI, caractéristiques de la phase de latence au cours de laquelle le métabolisme bactérien est ralenti. Durant cette phase, un arrêt de la division cellulaire bactérienne et une élongation des cellules sont observés [7]. La formation des ILI chez M. tuberculosis a lieu dans le granulome. Lorsqu’elles sont phagocytées par les macrophages, certaines bactéries induisent leur différenciation en macrophages spumeux, riches en lipides [5]. Ces corps lipidiques fusionnent avec le phagosome contenant M. tuberculosis, fournissant à la bactérie des lipides sous la forme de triacylglycérol (TAG). Ces TAG seront ensuite hydrolysés par les lipases bactériennes en glycérol puis en acides gras libres, qui s’accumulent sous forme d’ILI dans les bactéries et servent de source de nutriments et d’énergie, indispensable lors de la réactivation des bactéries [8].
Des bactéries peuvent également se retrouver libres dans le caséum, un environnement pauvre en nutriments mais riche en sources lipidiques, situé au centre du granulome (Figure 1B). Dans les deux cas, les bactéries sont capables d’utiliser les acides gras pour former des ILI dans leur cytoplasme. Il a été montré récemment que la faible biodisponibilité en nutriments (condition rencontrée dans le caséum) induisait la formation d’ILI, ce qui contribue à la survie des bactéries et à leur persistance dans les granulomes [7].
Afin d’étudier la formation des ILI dans les deux localisations (macrophage et caséum), deux modèles ont été développés (Figure 1B). Dans le premier modèle, les bactéries sont cultivées dans un milieu riche en glycérol et pauvre en azote, imitant les conditions du caséum [7]. L’autre modèle mime le macrophage spumeux : des macrophages infectés par M. bovis, la souche responsable de la tuberculose bovine, sont incubés en présence de lipoprotéines de très faibles densités (VLDL) très riches en TAG [8] qui vont être internalisées par les cellules, permettant la formation des macrophages spumeux. La dégradation de ces VLDL dans les lysosomes permet la formation de corps lipidiques qui servent de réserves de lipides. Les mycobactéries contenues dans les phagosomes vont alors hydrolyser ces lipides et produire des acides gras libres, qui vont être utilisés pour former les ILI.
Des travaux récents montrent l’implication des lipases mycobactériennes dans la formation et la dégradation des ILI et décryptent leur mécanisme d’action.
La lipase LipY
M. tuberculosis produit un grand nombre de lipases, les enzymes qui hydrolysent les TAG en glycérol et acides gras libres, ces derniers pouvant être internalisés et stockés par le microorganisme pathogène. La lipase LipY, par exemple, est considérée comme un acteur majeur de la dégradation bactérienne des TAG. LipY appartient au groupe des protéines proline-glutamate (PE), caractérisées par un domaine N-terminal long d’une centaine d’acides aminés et contenant les résidus proline et glutamate, respectivement en position 9 et 10 [9]. LipY existe sous deux formes chez M. tuberculosis, une forme entière, intracellulaire, et une forme tronquée, extracellulaire, dépourvue de son domaine N-terminal et donc du domaine PE [9]. Afin de comprendre les mécanismes de maturation et d’action de cette enzyme, les chercheurs ont étudié l’activité lipolytique de différentes formes de LipY et ont montré que la forme entière de LipY présentait une activité réduite en comparaison de la forme dépourvue du domaine PE (LipYΔPE) [8]. En effet, une analyse structure-fonction de cette lipase a révélé que le domaine PE provoquait un encombrement stérique au niveau du site de liaison du substrat, impactant négativement l’activité lipasique de LipY [9].
Afin de mieux comprendre comment LipY est sécrétée, différents variants de cette protéine ont été produits, soit par délétion du domaine PE, soit par substitution de résidus clés dans le signal de sécrétion. Ces études ont révélé la présence d’un signal de sécrétion du type YXXXD/E dans le domaine PE, permettant à LipY d’être sécrétée par le système ESX-5, un des systèmes de sécrétion de type VII [9]. Après reconnaissance du signal de sécrétion, la protéine est clivée par la protéase MycP5 qui reconnaît les résidus 148, 149 et 150 de la lipase. LipY dépourvue de son domaine PE est ensuite ancrée à la face externe de la membrane bactérienne, et peut ainsi hydrolyser les TAG présents dans la lumière du phagosome des cellules hôtes ou dans le caséum [9] (Figure 2).
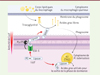 |
Figure 2. Mécanismes d’actions intracellulaire et extracellulaire de LipY. 1. La lipase LipY est sécrétée par le système de sécrétion de type VII ESX-5, et le domaine PE est clivé par la protéase MycP5. 2. La protéine sécrétée est ancrée à la mycomembrane. 3. Les corps lipidiques de l’hôte fusionnent avec le phagosome, libérant dans ce dernier des TAG. 4. Les TAG du phagosome sont dégradés en acides gras libres par LipY membranaire. 5. Les acides gras libérés sont internalisés par la bactérie et permettent la formation d’ILI (eux-mêmes composés de TAG) dans le cytoplasme bactérien. 6. En cas de carence, les ILI sont dégradés par la forme intracellulaire de LipY, ce qui permet la libération d’acides gras fournissant l’énergie nécessaire à la sortie de la phase de dormance (représentation graphique créée avec BioRender). |
Entretien avec Stéphane Canaan

Stéphane Canaan est directeur de recherche au CNRS et responsable de l’équipe « Lipolysis & Bacterial Pathogenicity » au Laboratoire d’Ingénierie des Systèmes Macromoléculaires (LISM) à Marseille. Son équipe a démontré l’importance de ces enzymes dans la virulence, la propagation de la maladie, mais aussi dans la dormance et le diagnostic de la tuberculose, ce qui en fait un des leaders dans le domaine des enzymes lipolytiques mycobactériennes.
Avez-vous des scientifiques qui vous ont inspiré dans votre carrière ?
Il en existe beaucoup, mais le principal qui me vient à l’esprit est mon mentor, Robert Verger, qui m’a inculqué toutes les bases de la recherche ainsi que le début des connaissances que j’ai pu acquérir dans mon métier et qui m’a donné envie de continuer dans ce métier.
Quelles sont vos plus grandes fiertés ?
D’avoir réussi à former un très grand nombre d’étudiants, qu’il s’agisse de masters, de techniciens, de doctorants ou de post-doctorants. Et qu’ils aient tous un métier qu’ils pratiquent et qu’ils continuent de pratiquer depuis qu’ils sont partis du laboratoire.
Si je vous dis le mot « chercheur », quels sont les trois premiers mots qui vous viennent en tête ?
«Chercheur » est un mot qui est très vaste, mais ce qui me viendrait à l’esprit, c’est la motivation, la passion et le dévouement à une cause scientifique.
Aimez-vous votre métier ? Et êtes-vous aussi passionné qu’à vos débuts ?
Oui, je pense que j’aime toujours autant mon métier, je suis toujours aussi passionné, si ce n’est encore plus puisqu’au fur et à mesure des années, de l’avancée des recherches que l’on fait, on a envie de connaître davantage la thématique sur laquelle on travaille.
Quel est le point de votre métier que vous détestez le plus ?
Le plus embêtant dans notre métier, c’est de quémander de façon permanente de l’argent pour pouvoir travailler correctement et souvent on n’arrive pas à trouver suffisamment d’argent pour faire tout ce qui nous passe par la tête.
En quelques mots, parlez-nous de votre équipe.
L’équipe que j’ai pu réunir depuis maintenant quelques années, j’en suis particulièrement fier parce qu’elle a des compétences qui vont de l’étude d’un génome jusqu’à des études cliniques, et chaque personne dans le laboratoire a sa place, avec ses savoirs et ses savoir-faire. Ce sont tous des gens extrêmement compétents dans les domaines dans lesquels ils évoluent. C’est pour cela que je suis particulièrement content de travailler avec cette équipe.
Pouvez-vous nous dire sur quoi porte actuellement votre recherche ?
On travaille sur des mycobactéries pathogènes, c’est-à-dire des bactéries qui infectent l’homme au niveau des poumons (Mycobacterium tuberculosis et Mycobacterium abscessus) ou au niveau de la peau (Mycobacterium ulcerans). Cette souche fait d’ailleurs des ravages en Afrique. Nous essayons de décrypter le métabolisme des lipides de ces mycobactéries pathogènes et de comprendre l’implication de ces molécules dans le phénomène de transfert de la maladie, pour son diagnostic, et ses effets métaboliques afin de trouver des solutions pour essayer de réduire l’impact de la maladie.
Modes d’action de LipY
LipY a deux modes d’action : le premier, dans le milieu extracellulaire, permet la production d’ILI par la bactérie ; le deuxième, à l’intérieur de la bactérie, assure la dégradation des ILI, fournissant ainsi une source d’énergie nécessaire à la sortie de la phase de dormance.
Action extracellulaire
Dans le but de mieux comprendre l’implication de LipY dans la formation d’ILI, des macrophages spumeux ont été exposés à un inhibiteur de lipases bactériennes. L’observation microscopique des macrophages traités montre une absence d’ILI de grande taille, comparativement aux macrophages non exposés à l’inhibiteur [8]. Ceci démontre le rôle des lipases mycobactériennes, dont LipY, dans la dégradation des lipides de l’hôte et dans l’accumulation d’ILI.
Action intracellulaire
Les ILI servent de source lipidique pour les bactéries lorsque les ressources de la cellule hôte viennent à manquer. Afin d’étudier l’implication de LipY dans l’utilisation de ces ILI, des inhibiteurs de cette enzyme ont été utilisés dans des conditions où les macrophages sont cultivés en absence de VLDL, donc présentant peu de TAG, imposant ainsi aux bactéries d’utiliser les ILI. L’inhibition de LipY bloque la dégradation des ILI par la bactérie, démontrant ainsi que l’activité intracellulaire des LipY est nécessaire pour fournir une source d’énergie dépendante des ILI à la bactérie, permettant une sortie de la phase de dormance [8].
Conclusion
Les études présentées dans cette nouvelle ont mis en exergue l’importance des lipases bactériennes dans la vie et le maintien en phase de dormance des mycobactéries. Elles ont ainsi révélé l’importance des inhibiteurs de ces enzymes sur la formation d’ILI. Ces résultats sont très encourageants pour la recherche d’alternatives aux traitements actuels dans la lutte contre la tuberculose. Le développement d’autres molécules inhibitrices représente ainsi un axe de recherche prometteur. Au-delà de la tuberculose, qui représente encore de nos jours un enjeu de santé publique majeur, le genre mycobactérien, au sein duquel ces lipases sont conservées, est à l’origine de plusieurs autres risques sanitaires considérables. À ce titre, nous pouvons citer M. abscessus qui est un microorganisme pathogène opportuniste redouté, notamment par les patients atteints de mucoviscidose, et qui, de par sa prédominance dans le milieu hospitalier, est une source fréquente d’infections nosocomiales [10].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Global tuberculosis report 2021. Geneva: World Health Organization 2021; Licence : CC BY-NC-SA 3.0 IGO. [Google Scholar]
- Koch R., Die Atiologie der Tuberkulose. Berl Klinischen Wochenschr 1882 ; 15 : 221–230. [Google Scholar]
- Chiaradia L, Lefebvre C, Parra J, et al. Dissecting the mycobacterial cell envelope and defining the composition of the native mycomembrane. Sci Rep 2017 ; 7 : 12807. [CrossRef] [PubMed] [Google Scholar]
- Churchyard G, Kim P, Shah NS, et al. What We Know About Tuberculosis Transmission: An Overview. J Infect Dis 2017 ; 216 : 629–635. [Google Scholar]
- Dutta NK, Karakousis PC. Latent tuberculosis infection: myths, models, and molecular mechanisms. Microbiol Mol Biol Rev 2014 ; 78 : 343–371. [CrossRef] [PubMed] [Google Scholar]
- Marjorie P. Golden, Holenarasipur R Vikram. Extrapulmonary Tuberculosis: An Overview. Am Fam Physician 2005 ; 72 : 1761–1768. [PubMed] [Google Scholar]
- Santucci P, Johansen MD, Point V, et al. Nitrogen deprivation induces triacylglycerol accumulation, drug tolerance and hypervirulence in mycobacteria. Sci Rep 2019 ; 9 : 8667. [CrossRef] [PubMed] [Google Scholar]
- Santucci P, Diomandé S, Poncin I, et al. Delineating the Physiological Roles of the PE and Catalytic Domains of LipY in Lipid Consumption in Mycobacterium-Infected Foamy Macrophages. Infect Immun 2018 ; 86 : e00394–e00318. [CrossRef] [PubMed] [Google Scholar]
- Santucci P, Smichi N, Diomandé S, et al. Dissecting the membrane lipid binding properties and lipase activity of Mycobacterium tuberculosis LipY domains. FEBS J 2019 ; 286 : 3164–3181. [CrossRef] [PubMed] [Google Scholar]
- Roux AL, Girard-Misguich F, Herrmann JL. Mycobactéries et mucoviscidose : état des lieux et recommandations récentes. Journal des Anti-infectieux 2016 ; 8 : 187–192. [CrossRef] [Google Scholar]
© 2022 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Cycle de vie de Mycobacterium tuberculosis et modèles utilisés pour l’obtention d’inclusions lipidiques intracytosoliques. A. Représentation du cycle infectieux de M. tuberculosis. Les bacilles sont expectorés des voies respiratoires du malade via des gouttelettes. Les bactéries vont ensuite contaminer un nouvel hôte en se logeant dans ses alvéoles pulmonaires. Les macrophages alvéolaires vont venir phagocyter la bactérie, et le recrutement de cellules immunitaires aboutit à la formation du granulome tuberculeux. Après un certain temps, le granulome peut se rompre, entrainant la dissémination des bacilles dans l’organisme, rendant l’hôte de nouveau malade et contagieux. B. Au centre du granulome, les bactéries peuvent être libres dans le caséum, un milieu riche en lipides ou être présentes dans les lysosomes de macrophages spumeux riches en corps lipidiques. Lors de la phase de dormance, les bactéries vont accumuler des réserves lipidiques sous forme d’inclusions lipidiques intracytosoliques (ILI) (représentation graphique créée avec BioRender). |
| Dans le texte | |
 |
Figure 2. Mécanismes d’actions intracellulaire et extracellulaire de LipY. 1. La lipase LipY est sécrétée par le système de sécrétion de type VII ESX-5, et le domaine PE est clivé par la protéase MycP5. 2. La protéine sécrétée est ancrée à la mycomembrane. 3. Les corps lipidiques de l’hôte fusionnent avec le phagosome, libérant dans ce dernier des TAG. 4. Les TAG du phagosome sont dégradés en acides gras libres par LipY membranaire. 5. Les acides gras libérés sont internalisés par la bactérie et permettent la formation d’ILI (eux-mêmes composés de TAG) dans le cytoplasme bactérien. 6. En cas de carence, les ILI sont dégradés par la forme intracellulaire de LipY, ce qui permet la libération d’acides gras fournissant l’énergie nécessaire à la sortie de la phase de dormance (représentation graphique créée avec BioRender). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




