| Issue |
Med Sci (Paris)
Volume 37, Number 12, Décembre 2021
Vésicules extracellulaires
|
|
|---|---|---|
| Page(s) | 1116 - 1118 | |
| Section | Vésicules extracellulaires | |
| DOI | https://doi.org/10.1051/medsci/2021203 | |
| Published online | 20 December 2021 | |
Les vésicules extracellulaires tumorales favorisent la formation de niches pré-métastatiques
Ral-dependent tumor extracellular vesicles induce premetastatic niches in secondary organs
1
Biomécanique des tumeurs ( Tumor biomechanics), Inserm UMRS1109, Strasbourg, France
2
Université de Strasbourg, Strasbourg, France
3
Fédération de médecine translationnelle de Strasbourg (FMTS), Strasbourg, France
4
CNRS, SNC5055, Strasbourg, France
5
Équipe labellisée par la Ligue contre le cancer
Vignette (© Guillaume van Niel, Aurélie di Cicco, Graça Raposo, Daniel Levy).
Vésicules extracellulaires et cancer
La communication entre les cellules tumorales et les cellules stromales façonne un microenvironnement permissif à la progression métastatique. Les vésicules extracellulaires favorisent cet échange en modifiant le comportement de cellules qu’elles ciblent, stimulant ainsi la progression de la tumeur, mais également la formation de métastases [1]. Lorsqu’elles sont sécrétées par les cellules tumorales, les vésicules extracellulaires peuvent stimuler localement la prolifération, l’invasion ou la résistance aux traitements anti-tumoraux des cellules tumorales voisines [1]. Elles peuvent également agir sur des cellules non tumorales du microenvironnement et, par exemple, promouvoir la néo-vascularisation de la tumeur ou activer les fibroblastes résidents, modifiant ainsi la composition de la matrice extracellulaire. Elles jouent, par ailleurs, un rôle crucial dans la réponse immunitaire anti-tumorale, et peuvent l’activer en servant, par exemple, de source d’antigènes tumoraux ou, au contraire, peuvent favoriser « l’évasion » immunitaire de la tumeur en inhibant les lymphocytes T ou en réduisant la cytotoxicité des cellules NK (natural killer) [2]. Outre cette action locale, les vésicules extracellulaires tumorales agissent également à distance de la tumeur primaire, dans des organes ou des tissus qu’elles atteignent en empruntant les circulations sanguine ou lymphatique. Elles pré-conditionnent ainsi de futurs organes à recevoir des métastases, avant même l’arrivée des cellules tumorales, en formant des niches pré-métastatiques [3]. Ces niches, qui favorisent l’arrivée et la croissance de cellules tumorales, donc l’implantation de métastases, présentent des caractéristiques communes : des barrières endothéliales fragiles et poreuses, une activation des cellules stromales, un recrutement de cellules myéloïdes et un microenvironnement globalement pro-inflammatoire et immunosuppresseur [2, 3]. Si ce nouveau paradigme impliquant les vésicules extracellulaires dans le développement métastasique est porteur d’espoir sur un plan diagnostique voire thérapeutique, de nombreuses zones d’ombre limitent encore sa compréhension et freinent son exploitation. Par exemple, si la fonction pro-métastatique de certains cargos (protéines et micro-ARN) présents dans les vésicules extracellulaires tumorales a été rapportée [1, 3], l’identité moléculaire du contenu des vésicules extracellulaires induisant l’apparition des niches pré-métastatiques est encore mal connue. On ignore également la nature précise des mécanismes permettant l’accumulation de ces cargos dans les vésicules extracellulaires et la sécrétion de ces vésicules par les cellules de la tumeur primaire. Par ailleurs, alors que les niches pré-métastatiques et les métastases se forment dans des organes déterminés, qui varient selon le type tumoral, on comprend encore mal les processus qui régissent cette spécificité [3]. Comprendre les mécanismes de la biodistribution des vésicules extracellulaires tumorales pourrait aider à expliquer ce phénomène. De manière générale, une meilleure compréhension de ces processus et des molécules mises en jeu permettrait de mieux détecter et combattre la formation de métastases, une étape critique de l’agressivité d’une tumeur cancéreuse. Sonder le répertoire moléculaire des vésicules extracellulaires par des biopsies liquides permettrait de développer des outils pour détecter la maladie plus tôt et entreprendre des approches thérapeutiques ciblées.
Notre équipe de recherche vient d’apporter un éclairage nouveau sur ces questions en identifiant une nouvelle voie de biogenèse des vésicules extracellulaires tumorales et en décrivant, par une approche moléculaire « multi-modèle », son implication dans la formation de niches pré-métastatiques dans le contexte du cancer du sein métastatique [4].
Biogenèse des vésicules extracellulaires tumorales
Bien que représentant un ensemble très hétérogène, les vésicules extracellulaires sont classées en deux catégories selon leur voie de biogenèse : exosomes ou microvésicules. Les exosomes proviennent de la sécrétion des vésicules intraluminales présentes au sein d’un endosome tardif particulier, le corps multi-vésiculaire. Lorsque celui-ci fusionne avec la membrane plasmique de la cellule, les vésicules intraluminales sécrétées dans le milieu extracellulaire sont alors appelées exosomes [5] (Figure 1). Les microvésicules, quant à elles, proviennent du bourgeonnement de la membrane plasmique de la cellule [5]. Certains mécanismes moléculaires contrôlant la sécrétion des vésicules extracellulaires tumorales et participant directement à la formation de métastases ont été récemment identifiés [1, 5]. Par exemple, la GTPase Rab27a permet l’ancrage des corps multi-vésiculaires à la membrane plasmique, et contrôle ainsi la sécrétion d’exosomes, ce qui favorise notamment les métastases de carcinomes mammaires et de mélanomes chez la souris [6, 7]. Afin de mieux comprendre comment la sécrétion de vésicules extracellulaires contrôle l’apparition de métastases, nous avons choisi de nous concentrer sur les GTPases RalA et RalB car nous avions préalablement mis en évidence le rôle de leur orthologue, RAL-1, dans la sécrétion d’exosomes chez le nématode Caenorhabditis elegans [8]. Ces protéines étaient alors connues pour leur fonction dans différents processus cellulaires (sécrétion, migration, prolifération, etc.) et pour leur rôle pro-tumoral dans plusieurs types de cancers [9]. Pour évaluer leur importance dans les processus de métastases induits par les vésicules extracellulaires, nous avons étudié les effets de l’inhibition de l’expression de ces GTPases dans un modèle de carcinome mammaire murin particulièrement agressif [4]. Ce modèle cellulaire, appelé 4T11, mime fidèlement, après injection à des souris BALB/c, la maladie humaine (cancer du sein « triple négatif ») et permet de réaliser des études de tumorigenèse et de métastases expérimentales dans un contexte syngénique. Nous avons constaté que la réduction de l’expression de RalA ou de RalB (par la technique de shARN [short hairpin RNA]), ou leur inhibition pharmacologique, diminuent la sécrétion des vésicules extracellulaires tumorales. Les inhibiteurs chimiques des GTPases Ral diminuent également la sécrétion de vésicules extracellulaires par d’autres types de cellules tumorales (cellules de mélanome et de carcinome pancréatique), ce qui indique que la fonction de ces protéines n’est pas restreinte au cancer du sein. Une analyse subcellulaire des organelles a également permis de montrer que RalA et RalB affectent la sécrétion d’exosomes en contrôlant la densité cellulaire des corps multi-vésiculaires (Figure 1) [4]. Ainsi, nous avons mis en évidence une nouvelle voie de sécrétion d’exosomes tumoraux dépendant des GTPases Ral, pour laquelle il conviendra de déterminer comment elle s’articule avec les mécanismes de biogenèse des exosomes décrits précédemment [5].
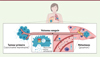 |
Figure 1. Modèle expliquant le rôle des GTPases Ral dans la sécrétion d’exosomes tumoraux et dans la formation de niches pré-métastatiques. Les GTPases RalA et RalB contrôlent la densité de corps multi-vésiculaires (multivesicular body, MVB) dans les cellules tumorales et la sécrétion de vésicules extracellulaires par ces cellules. Elles contrôlent également le chargement de CD146 dans les vésicules extracellulaires, une protéine d’adhérence qui favorise leur accumulation dans les organes destinés à recevoir des métastases et la formation de niches pré-métastatiques (figure créée sur BioRender.com). |
Vésicules extracellulaires tumorales et niche pré-métastatique
Afin d’évaluer l’importance de cette voie de sécrétion d’exosomes dans la progression tumorale et la formation de métastase, nous avons entrepris d’injecter les cellules 4T1 dans la glande mammaire de souris syngéniques immunocompétentes. Alors que les GTPases RalA et RalB perturbent la croissance des tumeurs primaires de manière opposée, toutes deux sont requises pour la formation de métastases pulmonaires. On retrouve d’ailleurs une expression plus élevée de ces GTPases chez des patientes atteintes de cancer du sein et présentant des métastases [4, 9]. Les résultats que nous avons obtenus montrent ainsi, d’une part, que les GTPases Ral contrôlent la sécrétion d’exosomes tumoraux et, d’autre part, que ces GTPases sont nécessaires à la formation de métastases. Afin d’établir un lien entre ces deux phénotypes, nous avons évalué la capacité des vésicules extracellulaires tumorales à induire la formation de niches pré-métastatiques dans un modèle de métastases expérimentales chez la souris. Nous avons observé que les vésicules extracellulaires issues de cellules dans lesquelles l’expression des GTPases Ral a été inhibée perdent leur potentiel pro-métastatique. Ces vésicules perdent également la capacité de cibler les organes destinés à recevoir des métastases (le foie et le poumon), une propriété essentielle à la formation des niches pré-métastatiques. Les GTPases Ral sont donc nécessaires à la sécrétion d’une sous-population de vésicules extracellulaires capables de cibler efficacement un organe destiné à recevoir des métastases et d’y former des niches pré-métastatiques.
Nous avons ensuite analysé le contenu des vésicules extracellulaires tumorales par une approche « multi-omique ». Nous avons observé que les GTPases Ral contrôlent le contenu de ces vésicules en protéines, en ARN (ARNm et ARN non-codants) et en lipides. Une découverte majeure de cette analyse comparative a été l’identification d’une protéine d’adhérence intercellulaire, CD146 (aussi appelée MCAM pour molécule d’adhérence cellulaire du mélanome), dont l’enrichissement dans les vésicules extracellulaires tumorales dépend des GTPases Ral (Figure 1). L’inhibition de CD146 à l’aide d’un anticorps anti-CD146 a montré que cette protéine est nécessaire au ciblage pulmonaire de ces vésicules ainsi qu’à la formation de niches prémétastatiques. L’identification de CD146 dans ce contexte vient s’ajouter à celle des tétraspanines (TSPAN8 et CD151) et des couples d’intégrines (a6b4, avb4 et a6b1), dont l’impact sur l’accumulation des vésicules extracellulaires tumorales dans des organes spécifiques et sur la formation de niches pré-métastatiques a été établi [10, 11]. Ces découvertes suggèrent que la combinaison de l’expression de molécules d’adhérence à la surface de vésicules extracellulaires détermine leur capacité à s’accumuler dans un organe déterminé. Décrypter cette combinaison de récepteurs et en identifier les ligands permettraient de développer des thérapies ciblées bloquant les étapes initiales de la formation des niches pré-métastatiques, ce qui constituerait un outil innovant et d’action précoce dans la lutte contre la formation de métastases.
Conclusion
Nos travaux, que nous présentons ici dans le cadre du numéro thématique de médecine/sciences dédié aux vésicules extracellulaires, ont donc permis de mettre en évidence une nouvelle voie de biogenèse d’exosomes tumoraux dépendant des GTPases RalA et RalB. Nous avons montré que cette voie contrôle l’enrichissement des vésicules extracellulaires tumorales en certaines molécules cargos étroitement liées à leur capacité pro-métastatique (en particulier la protéine CD146). D’autres cargos (ARN, protéines, etc.) de ces vésicules contribuent cependant également à la mise en place des niches pré-métastatiques [1, 3], mais leur rattachement à des voies de sécrétion particulières dans les cellules tumorales reste à déterminer. L’identification simultanée de molécules pro-métastatiques portées par les vésicules extracellulaires et de leurs mécanismes moléculaires de sécrétion respectifs permettrait l’élaboration de stratégies thérapeutiques ciblées « à double-tranchant », en agissant à la fois sur la quantité et sur l’identité des vésicules extracellulaires tumorales. Une meilleure connaissance des marqueurs moléculaires présents à la surface de ces vésicules pourrait finalement favoriser l’émergence de nouveaux outils diagnostiques multimoléculaires à partir de biopsies liquides réalisées chez les patients.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Ce travail a été soutenu par des bourses individuelles de l’IDEX (université de Strasbourg), de l’Association pour la recherche sur le cancer (ARC) et de la Fondation pour la recherche médicale (FRM) pour BM et SG, par des financements obtenus par JGG et VH auprès de la Ligue contre le cancer, le Cancéropôle Grand-Est, l’INCa (PLBIO19-291) et le Plan cancer (Nanotumor and Vesmatic), ainsi que par des financements institutionnels de l’université de Strasbourg et de l’Inserm accordés à JGG.
Références
- Xu R, Rai A, Chen M et al. Extracellular vesicles in cancer: implications for future improvements in cancer care. Nat Rev Clin Oncol 2018 ; 15 : 617–638. [CrossRef] [PubMed] [Google Scholar]
- Marar C, Starich B, Wirtz D. Extracellular vesicles in immunomodulation and tumor progression. Nat Immunol 2021; 22 : 560–70. [CrossRef] [PubMed] [Google Scholar]
- Peinado H, Zhang H, Matei IR et al. Pre-metastatic niches: organ-specific homes for metastases. Nat Rev Cancer 2017 ; 17 : 302–317. [CrossRef] [PubMed] [Google Scholar]
- Ghoroghi S, Mary B, Larnicol A, et al. Ral GTPases promote breast cancer metastasis by controlling biogenesis and organ targeting of exosomes. eLife 2021; 10 : e61539. [CrossRef] [PubMed] [Google Scholar]
- van Niel G, D’Angelo G, Raposo GShedding light on the cell biology of extracellular vesicles. Nat Rev Mol Cell Biol 2018 ; 19 : 213–228. [CrossRef] [PubMed] [Google Scholar]
- Bobrie A, Krumeich S, Reyal F et al. Rab27a supports exosome-dependent and -independent mechanisms that modify the tumor microenvironment and can promote tumor progression. Cancer Res 2012 ; 72 : 4920–4930. [CrossRef] [PubMed] [Google Scholar]
- Peinado H, Ale´ckovi´c M, Lavotshkin S, et al. Melanoma exosomes educate bone marrow progenitor cells toward a pro-metastatic phenotype through MET. Nat Med 2012 ; 18 : 883–891. [CrossRef] [PubMed] [Google Scholar]
- Hyenne V, Apaydin A, Rodriguez D et al. RAL-1 controls multivesicular body biogenesis and exosome secretion. J Cell Biol 2015 ; 211 : 27–37. [CrossRef] [PubMed] [Google Scholar]
- Yan C, Theodorescu DRAL GTpases: Biology and potential as therapeutic targets in cancer. Pharmacol Rev 2018 ; 70 : 1–11. [CrossRef] [PubMed] [Google Scholar]
- Hoshino A, Costa-Silva B, Shen T-L et al. Tumour exosome integrins determine organotropic metastasis. Nature 2015 : 1–19. [Google Scholar]
- Yue S, Mu W, Erb U et al. The tetraspanins CD151 and Tspan8 are essential exosome components for the crosstalk between cancer initiating cells and their surrounding. Oncotarget 2015 ; 6 : 2366–2384. [CrossRef] [PubMed] [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Modèle expliquant le rôle des GTPases Ral dans la sécrétion d’exosomes tumoraux et dans la formation de niches pré-métastatiques. Les GTPases RalA et RalB contrôlent la densité de corps multi-vésiculaires (multivesicular body, MVB) dans les cellules tumorales et la sécrétion de vésicules extracellulaires par ces cellules. Elles contrôlent également le chargement de CD146 dans les vésicules extracellulaires, une protéine d’adhérence qui favorise leur accumulation dans les organes destinés à recevoir des métastases et la formation de niches pré-métastatiques (figure créée sur BioRender.com). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




