| Issue |
Med Sci (Paris)
Volume 37, Number 12, Décembre 2021
Vésicules extracellulaires
|
|
|---|---|---|
| Page(s) | 1186 - 1188 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2021178 | |
| Published online | 20 December 2021 | |
Comment l’épissage alternatif contribue au contrôle de la plasticité des structures de clathrine
How alternative splicing contributes to clathrin’s structural plasticity
Sorbonne Université, Inserm, Association Institut de myologie, Centre de recherche en myologie, UMRS 974, 47 boulevard de l’Hôpital, 75013 Paris, France
Dans les neurones, où la rapidité de l’endocytose est primordiale pour le recyclage des vésicules synaptiques [1], la machinerie d’endocytose coopère pour former de petites vésicules calibrées recouvertes de clathrine dont le diamètre ne dépasse pas 80 nm. À l’inverse, dans le muscle squelettique, cette machinerie forme des plaques qui recouvrent jusqu’à plusieurs μm2 de membrane plasmique et apparaissent dès le début de la différenciation musculaire [2, 3]. Ces plaques sont associées au cytosquelette cortical et permettent l’adhérence des cellules à leur substrat par l’intermédiaire d’intégrines spécifiques, comme l’intégrine β5, qui est abondante dans ces structures. Plusieurs facteurs peuvent influencer la formation de vésicules ou de plaques de clathrine mais, étonnamment, les déterminants génétiques qui contrôlent la façon dont les cellules produisent ces différents types de structures restent mal connus.
Modèle d’assemblage des triskèles de clathrine
Les chaînes lourdes et légères de clathrine s’assemblent en trimères pour former un manteau autour de la membrane. Ces triskèles1 de clathrine sont recrutés par des protéines adaptatrices qui déclenchent l’assemblage de la clathrine et le bourgeonnement de la vésicule. Le mécanisme par lequel les triskèles de clathrine s’assemblent pour former différentes structures a fait l’objet d’un débat, et deux modèles différents ont été proposés pour expliquer la formation des puits de clathrine [4, 5]. Dans le modèle canonique, dit « de courbure constante » [5], les triskèles de clathrine ont une forme courbée et la courbure du manteau reflète leur forme [6]. Le recrutement de la clathrine cytosolique au bord d’un assemblage de clathrine en formation produit des structures sphériques dont la courbure augmente avec la polymérisation de triskèles supplémentaires. Dans le second modèle, dit « de courbure variable », la clathrine s’assemble initialement en polygones plats, qui sont ensuite remodelés pour former un puits de clathrine. En produisant des répliques de platine de la surface interne des cellules, nous avons pu visualiser, en microscopie électronique à transmission (uPREM)2, et comparer les assemblages de clathrine formés par différents types de cellules en culture. Nous avons observé que la clathrine s’assemble en plaques dans la lignée de cellules cancéreuses HeLa3 ou dans les cellules musculaires différenciées, les myotubes (Figure 1). En revanche, la clathrine produit uniquement des structures courbes et ne forme pas de plaques dans les neurones, dans la cellule souche musculaire (myoblaste), ainsi que dans les cellules d’autres lignées cellulaires produisant uniquement des puits sphériques. Bien que les différents modèles ne s’excluent pas mutuellement, aucun ne peut expliquer à lui seul la diversité des structures de clathrine observées dans les cellules. On ignore la raison pour laquelle la clathrine s’assemble en plaques dans certains types cellulaires alors qu’elle produit des structures sphériques dans d’autres, et comment cette plasticité est contrôlée au cours de la différenciation.
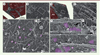 |
Figure 1. Comparaison entre les structures de clathrine à la surface de neurones et celles de clathrine de myotubes en culture. (A-C) Images de microscopie electronique à transmission (obtenues à des grossissements croissants) de répliques de platine du soma d’un neurone d’hippocampe de rat décapé par sonication. En (C), on peut distinguer les puits de clathrine sphériques par leur manteau de clathrine formant des polygones autour de la vésicule de membrane plasmique. (D-F) Images de microscopie electronique d’un myotube murin décapé par sonication. En (F), on peut distinguer les plaques de clathrine plates qui constitutent la majorité des structures de clathrine présentes à la face cytoplasmique de la membrane plasmique de myotubes en culture. En (A) et (D), les régions de la réplique qui correspondent au substrat sur lequel sont cultivées les cellules sont en rouge, et en (C) et (F), les structures de clathrine sont en violet. (C’) et (F’) sont des agrandissements des zones encadrées en (C) et (F). |
Épissage alternatif des transcrits codant les protéines de l’endocytose au cours du développement
Au cours du développement embryonnaire, l’expression de différents gènes codant des protéines impliquées dans le trafic membranaire est contrôlée de manière spécifique à chaque tissu par l’épissage alternatif de leurs transcrits [7, 8]. De nombreux évènements d’épissage alternatif dans le cerveau et les muscles squelettiques concernent des gènes codant les protéines d’endocytose [9, 10], et leur contrôle au cours du développement, afin d’assurer la transition des isoformes fœtales aux isoformes adultes, implique les facteurs d’épissage appartenant aux familles CELF (CUGPB/Elav-like) et MBNL (muscleblind-like) [11]. Nous avons montré que l’exon 31 du gène CLTC codant la chaîne lourde de la clathrine humaine est inclus dans le transcrit mature de ce gène par épissage alternatif au cours de la différenciation musculaire [12]. Nous avons cherché à évaluer le lien entre l’épissage alternatif de cet exon et la diversité des structures de la clathrine présentes à la membrane plasmique. Nous avons montré que différents types cellulaires produisent différentes structures de clathrine, et que la capacité à former des plaques augmente avec l’inclusion de l’exon 31 dans le transcrit mature. Les neurones, les cellules souches induites à la pluripotence (iPSC), et les cellules de la lignée BS-C-1, des cellules rénales de singe vert, qui produisent exclusivement des structures en puits, expriment peu ou pas l’isoforme incluant l’exon 31, tandis que les myotubes qui forment des plaques expriment fortement cette isoforme [12]. L’analyse in silico montre que l’inclusion de l’exon 31 dans l’ARN messager (ARNm) de CLTC ajoute sept acides aminés qui prolongent et maintiennent les hélices α impliquées dans la structure du domaine de trimérisation de la clathrine. En conséquence, l’amphiphilie des hélices est augmentée, ainsi que leur capacité à former des superhélices. Une interaction accrue entre les trois triskèles de clathrine pourrait rigidifier chaque triskèle en réduisant l’angle du domaine de trimérisation, ce qui conduirait à l’aplatissement des triskèles et favoriserait la formation de structures plates.
Manipulation de la structure de la clathrine par saut ou inclusion d’exon
Afin de démontrer le rôle de l’épissage alternatif de l’exon 31 de CLTC sur la formation de plaques par rapport à la formation de puits de clathrine, nous avons développé une stratégie de « saut d’exon » dans les myotubes, inhibant ainsi l’inclusion de l’exon 31 dans le transcrit mature de ce gène lors de la différenciation de ces cellules. Pour cela, nous avons infecté des myotubes avec un vecteur viral adéno-associé (AAV-U7-CLTCex31) codant un petit ARN nucléaire U7, dont la séquence antisens a été modifiée pour couvrir les sites donneur et accepteur d’épissage de l’exon 31 de CLTC. La visualisation de l’ultrastructure de la clathrine par uPREM a permis de montrer que l‘absence de l’exon 31 dans l’ARNm de CLTC obtenue par cette stratégie est corrélée à une réduction du nombre et de la taille des plaques au profit de la formation de puits de clathrine. A contrario, forcer l’inclusion de l’exon 31 dans l’ARNm de CLTC par inhibition du facteur d’épissage CELF dans les myoblastes favorise l’assemblage de la clathrine en plaques [12].
Épissage alternatif de la clathrine et dystrophie myotonique de type 1
Au cours du développement musculaire, le domaine de trimérisation de la clathrine passe d’une forme ubiquitaire, l’isoforme de clathrine embryonnaire, à l’isoforme musculaire CLTC-ex31 chez l’adulte, qui contient les sept acides aminés supplémentaires codés par l’exon 31. En forçant le saut de cet exon lors de l’épissage du transcrit dans des muscles de souris, nous avons montré que l’absence de l’isoforme musculaire CLTC-ex31 est délétère pour l’architecture du muscle et la capacité des fibres musculaires à produire de la force musculaire [12]. L’absence des sept acides aminés codés par l’exon 31 a un impact direct sur la fonction de la clathrine dans le muscle, et produit un phénotype semblable à celui précédemment observé lors de la déplétion de la clathrine in vivo [3].
Nous avons recherché si un défaut d’inclusion ou d’exclusion d’exons dans les transcrits codant des protéines impliquées dans la machinerie de l’endocytose était impliqué dans certaines maladies musculaires. Un criblage de nombreuses protéines de l’endocytose a révélé un épissage anormal du transcrit codant l’isoforme CLTC-ex31 dans les cellules et tissus de patients atteints de dystrophie myotonique congénitale de type 1 [12]. Cette myopathie, particulièrement fréquente, est causée par l’expression de répétitions de séquences microsatellites dans le gène DMPK (dystrophia myotonica 1 protein kinase)4, et est associée à une altération de l’activité des facteurs d’épissage MBNL et CELF. Parmi les défauts d’épissage, nous avons observé une corrélation entre l’absence d’épissage de l’exon 31 de CLTC et la sévérité de l’atteinte musculaire chez les patients atteints de formes congénitales sévères de cette myopathie. L’analyse de l’ultrastructure de la clathrine et de l’activité d’endocytose dans les myotubes de ces patients a confirmé leur phénotype de myoblastes immatures, similaire à celui observé en supprimant expérimentalement l’exon 31 de l’ARNm de CLTC dans des myotubes témoins. Cette observation montre l’implication d’un défaut d’épissage du transcrit de CLTC dans le phénotype musculaire immature précédemment décrit dans les formes congénitales de la dystrophie myotonique congénitale de type 1 [13]. Des anomalies ultrastructurales observées dans les fibres musculaires dans lesquelles le transcrit de CLTC est dépourvu de l’exon 31, telles que le détachement de l’appareil contractile et des désorganisations sous-sarcolemmales en fibres annelées (ringed fibers) qui présentent des groupes de myofibrilles périphériques orientées perpendiculairement, ont été mises en évidence dans plusieurs dystrophies musculaires, dont la dystrophie myotonique congénitale de type 1 [14]. Cependant, la présence des détachements entre le sarcolemme et les sarcomères sous-jacents s’est révélée être une caractéristique de la déplétion des chaînes lourdes de clathrine dans les muscles squelettiques [3], suggérant que ce phénotype pourrait être associé à une perte de fonction d’adhérence de la clathrine et à la formation défectueuse des plaques.
Alors que les évènements d’épissage alternatif qui ont lieu au cours du développement semblent jouer un rôle majeur dans le remodelage des structures de clathrine présentes dans des cellules à l’état indifférencié, de nombreuses questions restent en suspens quant aux mécanismes impliqués. Les résultats obtenus sur le rôle de l’exon 31 du gène CLTC codant la chaîne lourde de la clathrine suggèrent que certains facteurs d’épissage des transcrits, tels que CELF1, sont spécifiquement impliqués dans la transition entre une cellule en prolifération et une cellule différenciée, et que cette transition met en jeu un certain nombre d’évènements d’épissage alternatif qui confèrent aux protéines de l’endocytose des propriétés nouvelles. Outre les contraintes mécaniques et chimiques qui modulent la fonction de la clathrine, nous avons ainsi mis en évidence que l’équilibre entre la quantité de puits et de plaques de clathrine est aussi contrôlé au niveau post-transcriptionnel, ce qui permet d’expliquer la plasticité fonctionelle entre endocytose et adhérence au cours de la différenciation de types cellulaires distincts.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Une séquence microsatellite est une séquence d’ADN formée par une répétition continue de motifs composés de 1 à 4 nucléotides le plus souvent. Ces motifs répétés sont présents en grand nombre dans le génome de tous les eucaryotes. La mutation du gène DMPK en cause dans la dystrophie myotonique de type 1 est une expansion de la répétition du triplet CTG, dont le nombre dépasse 37 chez les personnes atteintes.
Références
- Saheki Y, De Camilli P. Synaptic vesicle endocytosis. Cold Spring Harb Perspect Biol 2012 ; 4 : a005645. [CrossRef] [PubMed] [Google Scholar]
- Franck A, Lainé J, Moulay G, et al. Clathrin plaques and associated actin anchor intermediate filaments in skeletal muscle. Mol Biol Cell 2019 ; 30 : 579–590. [CrossRef] [PubMed] [Google Scholar]
- Vassilopoulos S, Gentil C, Lainé J, et al. Actin scaffolding by clathrin heavy chain is required for skeletal muscle sarcomere organization. J Cell Biol 2014 ; 205 : 377–393. [CrossRef] [PubMed] [Google Scholar]
- Heuser J.. Three-dimensional visualization of coated vesicle formation in fibroblasts. J Cell Biol 1980 ; 84 : 560–583. [CrossRef] [PubMed] [Google Scholar]
- Kirchhausen T.. Imaging endocytic clathrin structures in living cells. Trends Cell Biol 2009 ; 19 : 596–605. [CrossRef] [PubMed] [Google Scholar]
- Kirchhausen T, Harrison SC, Heuser J. Configuration of clathrin trimers: evidence from electron microscopy. J Ultrastruct Mol Struct Res 1986 ; 94 : 199–208. [CrossRef] [PubMed] [Google Scholar]
- Dillman AA, Hauser DN, Gibbs JR, et al. mRNA expression, splicing and editing in the embryonic and adult mouse cerebral cortex. Nat Neurosci 2013 ; 16 : 499–506. [CrossRef] [PubMed] [Google Scholar]
- Giudice J, Loehr JA, Rodney GG, et al. Alternative splicing of four trafficking genes regulates myofiber structure and skeletal muscle physiology. Cell Rep 2016 ; 17 : 1923–1933. [CrossRef] [PubMed] [Google Scholar]
- Merkin J, Russell C, Chen P, et al. Evolutionary dynamics of gene and isoform regulation in mammalian tissues. Science 2012 ; 338 : 1593–1599. [CrossRef] [PubMed] [Google Scholar]
- Redlingshöfer L, McLeod F, Chen Y, et al. Clathrin light chain diversity regulates membrane deformation in vitro and synaptic vesicle formation in vivo. Proc Natl Acad Sci USA 2020; 117 : 23527–38. [CrossRef] [PubMed] [Google Scholar]
- Kalsotra A, Cooper TA. Functional consequences of developmentally regulated alternative splicing. Nat Rev Genet 2011 ; 12 : 715–729. [CrossRef] [PubMed] [Google Scholar]
- Moulay G, Lainé J, Lemaître M, et al. Alternative splicing of clathrin heavy chain contributes to the switch from coated pits to plaques. J Cell Biol 2020; 219 : e201912061. [CrossRef] [PubMed] [Google Scholar]
- Farkas-Bargeton E, Barbet JP, Dancea S, et al. Immaturity of muscle fibers in the congenital form of myotonic dystrophy: its consequences and its origin. J Neurol Sci 1988 ; 83 : 145–159. [CrossRef] [PubMed] [Google Scholar]
- Harper PS. Myotonic dystrophy. 3rd ed. New York : W.B. Saunders, 2001 : 273–5. [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Comparaison entre les structures de clathrine à la surface de neurones et celles de clathrine de myotubes en culture. (A-C) Images de microscopie electronique à transmission (obtenues à des grossissements croissants) de répliques de platine du soma d’un neurone d’hippocampe de rat décapé par sonication. En (C), on peut distinguer les puits de clathrine sphériques par leur manteau de clathrine formant des polygones autour de la vésicule de membrane plasmique. (D-F) Images de microscopie electronique d’un myotube murin décapé par sonication. En (F), on peut distinguer les plaques de clathrine plates qui constitutent la majorité des structures de clathrine présentes à la face cytoplasmique de la membrane plasmique de myotubes en culture. En (A) et (D), les régions de la réplique qui correspondent au substrat sur lequel sont cultivées les cellules sont en rouge, et en (C) et (F), les structures de clathrine sont en violet. (C’) et (F’) sont des agrandissements des zones encadrées en (C) et (F). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




