| Issue |
Med Sci (Paris)
Volume 37, Novembre 2021
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 15 - 18 | |
| Section | Prix SFM | |
| DOI | https://doi.org/10.1051/medsci/2021184 | |
| Published online | 08 December 2021 | |
Cibler les macrophages dans les dystrophies musculaires ?
Targeting macrophages in muscular dystrophies?
Institut NeuroMyoGène, Université Claude Bernard Lyon 1, CNRS UMR 5310, Inserm U1217, Université de Lyon, 69007 Lyon, France
Les macrophages jouent un rôle essentiel au cours de la régénération musculaire. L’altération de leurs propriétés est observée lors de pathologies chroniques telles que les dystrophies musculaires où ils contribuent au développement de la fibrose musculaire. La modulation du statut inflammatoire des macrophages représente une stratégie thérapeutique pertinente pour améliorer l’homéostasie musculaire.
Abstract
Macrophages play an essential role during muscle regeneration. Alteration of their properties is observed in chronic diseases such as degenerative myopathies, where they contribute to muscle fibrosis. Modulation of macrophage inflammatory status represents a relevant therapeutic strategy to improve muscle homeostasis.
© 2021 médecine/sciences – Inserm

© Servier Medical Art/Creative Commons
Le muscle strié squelettique est capable de se régénérer complètement grâce aux propriétés des cellules souches musculaires, les cellules satellites, qui sont normalement localisées à la périphérie des myofibres dans un état quiescent. Après une lésion, les cellules satellites sont activées, elles prolifèrent, se différencient, et fusionnent pour remplacer les fibres musculaires endommagées [1]. Bien qu’indispensables au processus de régénération musculaire, elles nécessitent une coopération étroite avec d’autres types cellulaires, parmi lesquelles les cellules immunes [2]. En effet, le processus de régénération musculaire est associé à une réaction inflammatoire qui doit être étroitement contrôlée en termes d’intensité et de durée. La résolution de cette inflammation est une étape essentielle car elle permet de contenir la réaction inflammatoire afin d’éviter d’endommager le tissu sain alentour, et de démarrer la phase de récupération au cours de laquelle le muscle se régénère. Des défauts de résolution de l’inflammation sont observés dans certaines pathologies chroniques telles que les dystrophies musculaires où des lésions musculaires permanentes et asynchrones induisent des signaux inflammatoires contradictoires. Ceux-ci altérent la réponse inflammatoire et peuvent conduire, entre autres phénomènes, au développement d’une fibrose [3].
Macrophages et régénération musculaire
Parmi les cellules inflammatoires impliquées dans la régénération musculaire survenant après une lésion aigüe, les macrophages jouent un rôle particulièrement important. Chez la souris, la déplétion des monocytes circulants bloque totalement la régénération consécutive à une blessure induite par une myotoxine dans le muscle tibialis anterior [4]. Rapidement après la lésion, les monocytes sanguins infiltrent le muscle endommagé et se différencient en macrophages pro-inflammatoires [4] dotés de multiples fonctions (Figure 1A) : ils favorisent la prolifération des cellules satellites [5], limitent la production trop précoce de matrice extracellulaire en induisant la mort par apoptose des fibroblastes [6, 7], et constituent les principaux effecteurs de l’efferocytose, la phagocytose des débris cellulaires. L’efferocytose est une étape-clé de la résolution de l’inflammation car elle déclenche une cascade moléculaire qui aboutit à une reprogrammation transcriptionnelle permettant aux macrophages d’acquérir un profil anti-inflammatoire [4] favorisant la différenciation et la fusion des cellules myogéniques [5], ainsi que la production de collagènes par les cellules fibroblastiques, reconstituant ainsi la matrice extracellulaire [6, 7].
 |
Figure 1. Rôle des macrophages au cours de la régénération musculaire. A. Après une lésion aiguë, des macrophages pro-inflammatoires dérivés des monocytes sanguins envahissent le tissu. Ils stimulent la prolifération des cellules satellites, induisent la mort par apoptose des cellules fibroblastiques et réalisent la phagocytose des débris cellulaires, ou efferocytose. Ceci induit un changement de statut des macrophages, qui acquièrent un profil anti-inflammatoire favorisant alors la différenciation et la fusion des cellules myogéniques ainsi que la production d’éléments de la matrice extracellulaire (comme les collagènes) par les fibroblastes. B. Au niveau moléculaire, l’efferocytose induit l’activation de la protéine AMPK par l’intermédiaire de sa phosphorylation, conduisant à l’extinction du programme pro-inflammatoire parallèlement à l’activation du programme anti-inflammatoire. L’activation de l’AMPK est également médiée via une production autocrine et paracrine de la protéine Annexine A1 (ANXA1) et l’activation de son récepteur FPR2. |
AMPK et changement de statut inflammatoire des macrophages
Des études transcriptomiques chez la souris ont montré que le changement de statut inflammatoire des macrophages est caractérisé par une modification profonde de leur programme transcriptionnel, le tout associé à une reprogrammation métabolique [8]. Le statut pro-inflammatoire est caractérisé par une forte activité glycolytique, contrairement au statut anti-inflammatoire qui est associé à l’oxydation phosphorylative [8]. Cependant, il reste à établir si ce changement de programme métabolique est une conséquence du changement inflammatoire ou s’il en est un des moteurs. Les mécanismes moléculaires régulant le changement de statut inflammatoire des macrophages induit par l’efferocytose au cours de la régénération musculaire sont peu caractérisés [9]. Cependant, notre équipe a montré que la protéine AMPK (AMP-activated kinase) joue un rôle essentiel dans ce processus [10] (Figure 1B). L’AMPK, constituée d’une sous-unité catalytique (α) et de deux sous-unités régulatrices (β et γ), est un régulateur métabolique activé par sa phosphorylation en cas de stress permettant de restaurer l’équilibre énergétique de la cellule grâce à la stimulation de l’oxydation phosphorylative [11]. Chez la souris, l’inactivation spécifique dans les macrophages du gène codant la sous-unité α1 de l’AMPK (seule sous-unité catalytique exprimée dans les macrophages [12]) bloque leur changement de statut inflammatoire in vitro et in vivo, conduisant à un défaut de régénération musculaire [10]. De même, cette inactivation inhibe l’acquisition par les macrophages du statut anti-inflammatoire normalement induit par l’efferocytose in vitro [10]. Plus récemment, notre équipe a mis en évidence un nouveau mécanisme d’activation de l’AMPK dans les macrophages au cours de la régénération musculaire via la sécrétion autocrine et paracrine de l’Annexine A1, une protéine déjà connue pour son rôle dans la résolution de l’inflammation et sa fixation sur le récepteur FPR2 (formyl peptide receptor 2) exprimé à la surface des macrophages pro-inflammatoires [13].
Macrophages et fibrose musculaire
Les dystrophies musculaires, dont la dystrophie musculaire de Duchenne (DMD), sont des pathologies causées par des mutations de gènes codant des protéines de structure comme la dystrophine [3]. Ces mutations induisent une grande fragilité des myofibres conduisant à des cycles continus et asynchrones de régénération musculaire et à une inflammation chronique. Ceci aboutit finalement à l’établissement d’une fibrose, une composante essentielle de la pathologie étant donné la forte corrélation entre son niveau et la perte de fonction musculaire chez les patients [14]. Il n’existe actuellement pas de traitement curatif pour la DMD. Les traitements palliatifs tels que l’administration au long cours de glucocorticoïdes, bien que permettant de retarder la progression de la pathologie [15], sont associés à d’importants effets secondaires comme l’atrophie musculaire [16]. Il est donc nécessaire de rechercher des stratégies thérapeutiques alternatives. Grâce à l’utilisation d’un modèle murin fibrosant de la DMD [17], notre équipe a identifié une population de macrophages pro-fibrosants exprimant des marqueurs pro-inflammatoires et préférentiellement associée aux zones fibrotiques dans le muscle tibialis anterior [7] (Figure 2A). De manière intéressante, ces macrophages sont également observés sur des coupes de muscles issus de patients atteints de DMD, mais également dans les muscles d’un modèle murin de sarcoglycanopathie, suggérant leur implication de façon plus large dans les dystrophies musculaires [7]. L’isolement de ces macrophages à partir de muscle murin fibrotique a révélé une expression anormalement élevée du gène Ltbp4 [7], qui code une protéine nécessaire à la sécrétion de la cytokine pro-fibrosante TGFβ1 sous forme latente, et dont des polymorphismes sont associés à une perte plus ou moins précoce des capacités ambulatoires des patients atteints de DMD [18]. Cette expression conduit à une sécrétion importante par les macrophages de TGFβ1 latent qui, une fois activé, favorise la survie des cellules fibroblastiques et stimule leur synthèse de collagènes, contribuant à l’établissement de la fibrose musculaire [7]. Ceci démontre le rôle majeur des macrophages dans le développement de la fibrose musculaire dans la DMD.
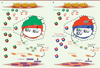 |
Figure 2. Rôle des macrophages dans le développement de la fibrose musculaire. A. Les dystrophies musculaires telles que la DMD sont caractérisées par des cycles permanents et asynchrones de régénération. Ceci est associé à une inflammation chronique caractérisée par une population de macrophages exprimant des marqueurs pro-inflammatoires et possédant des propriétés pro-fibrosantes. En raison d’une expression anormale du gène Ltbp4 codant une protéine nécessaire à la sécrétion de la cytokine TGFβ1, ces macrophages produisent une quantité importante de TGFβ1 latent, associé au peptide LAP (Latency Associated Peptide). Une fois activé, ce TGFβ1 protège les fibroblastes de l’apoptose et stimule fortement leur production de collagènes, contribuant ainsi au développement de la fibrose musculaire. B. Le traitement par des activateurs de l’AMPK force le changement des macrophages vers un profil anti-inflammatoire, diminue l’expression du gène Ltbp4 et la sécrétion de TGFβ1 latent, conduisant à une réduction de la fibrose et à une amélioration globale de l’homéostasie musculaire. |
Activation de l’AMPK et amélioration de l’homéostasie musculaire
L’AMPK étant un élément clé dans le changement inflammatoire des macrophages, nous avons exploré la possibilité de forcer le changement de statut des macrophages pro-fibrosants vers un profil anti-inflammatoire grâce à l’utilisation d’activateurs de l’AMPK (Figure 2B). Ainsi, nous avons montré que le traitement de souris modèles de la DMD par la metformine, un activateur indirect de l’AMPK, réduit l’expression des marqueurs pro-inflammatoires par les macrophages au bénéfice des marqueurs anti-inflammatoires [7]. Ceci est associé à une diminution de l’expression du gène Ltbp4 et à une sécrétion réduite de TGFβ1 par ces macrophages, conduisant à une réduction de la fibrose et à une amélioration importante de la fonction musculaire. L’atténuation des propriétés pro-fibrosantes des macrophages (réduction de l’expression du gène Ltbp4 et de la sécrétion de TGFβ1) est également induite in vitro par l’utilisation du composé 991, un activateur allostérique de l’AMPK, confirmant ainsi son rôle dans ce processus [7]. Plus récemment, notre équipe a montré in vitro que le traitement de macrophages par le NaHS, un donneur du médiateur gazeux H2S, permet l’acquisition d’un statut anti-inflammatoire favorisant la fusion des cellules myogéniques, ceci grâce à l’activation de l’AMPK [19]. En outre, le traitement de souris modèles de la DMD par le NaHS permet de moduler le statut inflammatoire des macrophages dans le muscle in vivo, ce qui est associé à une réduction des lésions et de la fibrose, ainsi qu’à une augmentation de la taille des myofibres, indiquant une amélioration globale de l’homéostasie musculaire [19]. L’ensemble de ces résultats montre que la modulation du statut inflammatoire des macrophages, notamment par l’activation de l’AMPK, représente une stratégie thérapeutique pertinente pour améliorer la fonction musculaire dans les dystrophies musculaires. La caractérisation exhaustive des circuits moléculaires contrôlant le changement de statut inflammatoire des macrophages induits par l’efferocytose au cours de la régénération musculaire permettra d’identifier de nouvelles cibles thérapeutiques potentielles.
Liens d’intérêt
L’auteur déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
L’auteur a reçu le Prix Impulsion de la SFM en 2020 pour l’ensemble de ses travaux de recherche.
Références
- Yin H, Price F, Rudnicki MA. Satellite cells and the muscle stem cell niche. Physiol Rev 2013 ; 93 : 23–67. [Google Scholar]
- Bentzinger CF, Wang YX, Dumont NA, et al. Cellular dynamics in the muscle satellite cell niche. EMBO Rep 2013 ; 14 : 1062–1072. [CrossRef] [PubMed] [Google Scholar]
- Duan D, Goemans N, Takeda S, et al. Duchenne muscular dystrophy. Nat Rev Dis Primers 2021; 7 : 13–19. [CrossRef] [PubMed] [Google Scholar]
- Arnold L, Henry A, Poron F, et al. Inflammatory monocytes recruited after skeletal muscle injury switch into antiinflammatory macrophages to support myogenesis. J Exp Med 2007 ; 204 : 1057–1069. [CrossRef] [PubMed] [Google Scholar]
- Saclier M, Yacoub-Youssef H, Mackey AL, et al. Differentially activated macrophages orchestrate myogenic precursor cell fate during human skeletal muscle regeneration. Stem Cells 2013 ; 31 : 384–396. [CrossRef] [PubMed] [Google Scholar]
- Lemos DR, Babaeijandaghi F, Low M, et al. Nilotinib reduces muscle fibrosis in chronic muscle injury by promoting TNF-mediated apoptosis of fibro/adipogenic progenitors. Nat Med 2015 ; 21 : 786–794. [CrossRef] [PubMed] [Google Scholar]
- Juban G, Saclier M, Yacoub-Youssef H, et al. AMPK activation regulates LTBP4-dependent TGF-beta1 secretion by pro-inflammatory macrophages and controls fibrosis in Duchenne muscular dystrophy. Cell Rep 2018 ; 25 : 2163–2176. [CrossRef] [PubMed] [Google Scholar]
- Varga T, Mounier R, Horvath A, et al. Highly dynamic transcriptional signature of distinct macrophage subsets during sterile inflammation, resolution, and tissue repair. J Immunol 2016 ; 196 : 4771–4782. [PubMed] [Google Scholar]
- Juban G. Transcriptional control of macrophage inflammatory shift during skeletal muscle regeneration. Semin Cell Dev Biol 2021; S1084-9521(21)00162-2. [PubMed] [Google Scholar]
- Mounier R, Theret M, Arnold L, et al. AMPKalpha1 regulates macrophage skewing at the time of resolution of inflammation during skeletal muscle regeneration. Cell Metab 2013 ; 18 : 251–264. [PubMed] [Google Scholar]
- Hardie DG. AMP-activated protein kinase: an energy sensor that regulates all aspects of cell function. Genes Dev 2011 ; 25 : 1895–1908. [CrossRef] [PubMed] [Google Scholar]
- Sag D, Carling D, Stout RD, et al. Adenosine 5’- monophosphate-activated protein kinase promotes macrophage polarization to an anti-inflammatory functional phenotype. J Immunol 2008 ; 181 : 8633–8641. [CrossRef] [PubMed] [Google Scholar]
- McArthur S, Juban G, Gobbetti T, et al. Annexin A1 drives macrophage skewing to accelerate muscle regeneration through AMPK activation. J Clin Invest 2020; 130 : 1156–1167. [CrossRef] [PubMed] [Google Scholar]
- Desguerre I, Mayer M, Leturcq F, et al. Endomysial fibrosis in Duchenne muscular dystrophy: a marker of poor outcome associated with macrophage alternative activation. J Neuropathol Exp Neurol 2009 ; 68 : 762–773. [CrossRef] [PubMed] [Google Scholar]
- McDonald CM, Henricson EK, Abresh RT, et al. Long-term effects of glucocorticoids on function, quality of life, and survival in patients with Duchenne muscular dystrophy: a prospective cohort study. Lancet 2018 ; 391 : 451–461. [CrossRef] [PubMed] [Google Scholar]
- Schakman O, Kalista S, Barbé C, et al. Glucocorticoid-induced skeletal muscle atrophy. Int J Biochem Cell Biol 2013 ; 45 : 2163–2172. [CrossRef] [PubMed] [Google Scholar]
- Desguerre I, Arnold L, Vignaud A, et al. A new model of experimental fibrosis in hindlimb skeletal muscle of adult mdx mouse mimicking muscular dystrophy. Muscle Nerve 2012 ; 45 : 803–814. [CrossRef] [PubMed] [Google Scholar]
- Flanigan KM, Ceco E, Lamar KM, et al. LTBP4 genotype predicts age of ambulatory loss in duchenne muscular dystrophy. Ann Neurol 2013 ; 73 : 481–488. [CrossRef] [PubMed] [Google Scholar]
- Saclier M, Ben Larbi S, Ly HM, et al. Interplay between myofibers and pro-inflammatory macrophages controls muscle damage in mdx mice. J Cell Sci 2021; 134. [CrossRef] [Google Scholar]
Liste des figures
 |
Figure 1. Rôle des macrophages au cours de la régénération musculaire. A. Après une lésion aiguë, des macrophages pro-inflammatoires dérivés des monocytes sanguins envahissent le tissu. Ils stimulent la prolifération des cellules satellites, induisent la mort par apoptose des cellules fibroblastiques et réalisent la phagocytose des débris cellulaires, ou efferocytose. Ceci induit un changement de statut des macrophages, qui acquièrent un profil anti-inflammatoire favorisant alors la différenciation et la fusion des cellules myogéniques ainsi que la production d’éléments de la matrice extracellulaire (comme les collagènes) par les fibroblastes. B. Au niveau moléculaire, l’efferocytose induit l’activation de la protéine AMPK par l’intermédiaire de sa phosphorylation, conduisant à l’extinction du programme pro-inflammatoire parallèlement à l’activation du programme anti-inflammatoire. L’activation de l’AMPK est également médiée via une production autocrine et paracrine de la protéine Annexine A1 (ANXA1) et l’activation de son récepteur FPR2. |
| Dans le texte | |
 |
Figure 2. Rôle des macrophages dans le développement de la fibrose musculaire. A. Les dystrophies musculaires telles que la DMD sont caractérisées par des cycles permanents et asynchrones de régénération. Ceci est associé à une inflammation chronique caractérisée par une population de macrophages exprimant des marqueurs pro-inflammatoires et possédant des propriétés pro-fibrosantes. En raison d’une expression anormale du gène Ltbp4 codant une protéine nécessaire à la sécrétion de la cytokine TGFβ1, ces macrophages produisent une quantité importante de TGFβ1 latent, associé au peptide LAP (Latency Associated Peptide). Une fois activé, ce TGFβ1 protège les fibroblastes de l’apoptose et stimule fortement leur production de collagènes, contribuant ainsi au développement de la fibrose musculaire. B. Le traitement par des activateurs de l’AMPK force le changement des macrophages vers un profil anti-inflammatoire, diminue l’expression du gène Ltbp4 et la sécrétion de TGFβ1 latent, conduisant à une réduction de la fibrose et à une amélioration globale de l’homéostasie musculaire. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




