| Issue |
Med Sci (Paris)
Volume 37, Number 8-9, Août–Septembre 2021
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 807 - 811 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2021125 | |
| Published online | 07 September 2021 | |
L9, un nouvel anticorps monoclonal prometteur contre le paludisme
L9, a novel and promising monoclonal antibody against Malaria
1
Master 2 Immunologie Translationnelle et Biothérapies (ITB), Parcours Immunologie, Mention BMC, Sorbonne Université, Paris, France.
2
Sorbonne Université, Inserm, CNRS, Centre d’Immunologie et des Maladies Infectieuses-Paris, CIMI-PARIS, 75013 Paris, France
a theo.cools@orange.fr
b m.jeanpierre08@hotmail.com
c valerie.soulard@sorbonne-universite.fr
Dans le cadre de leur module d’analyse scientifique, des étudiants de la promotion 2020-2021 des Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (Mention Biologie Moléculaire et Cellulaire, Parcours Immunologie, Sorbonne Université) se sont penchés sur la littérature et ont pris la plume pour partager avec les lecteurs de m/s quelques-uns des faits marquants de l’actualité en immunologie. Voici une sélection de quelques-unes de ces nouvelles, illustrant la large palette des axes de recherche en cours sur les mécanismes physiopathologiques des maladies infectieuses, auto-immunes, inflammatoires et tumorales et sur le développement d’immunothérapies pour le traitement de ces maladies.
© 2021 médecine/sciences – Inserm
L’actualité scientifique vue par les étudiants du Master 2 « Immunologie Translationnelle et Biothérapies » (ITB) et « Immunologie Intégrative et Systémique » (I2S) (Mention Biologie Moléculaire et Cellulaire), Parcours Immunologie, Sorbonne Université

Contact Équipe pédagogique
Encarnita Mariotti-Ferrandiz (Maître de Conférences, Sorbonne Université) encarnita.mariotti@sorbonne-universite.fr
Véronique Mateo (Maître de Conférences, Sorbonne Université) veronique.mateo@sorbonne-universite.fr
Sophie Sibéril (Maître de Conférences, Sorbonne Université) sophie.siberil@sorbonne-universite.fr
Le paludisme, ou malaria, est une maladie parasitaire potentiellement mortelle, causée par le parasite protozoaire Plasmodium et transmise par les moustiques du genre Anopheles. En 2018, la moitié de la population mondiale vivait toujours dans une zone d’endémie palustre et plus de 400 000 décès annuels étaient recensés par l’Organisation mondiale de la santé (OMS), dont 94 % en Afrique sub-saharienne [1]. Entre 2001 et 2013, l’intensification des moyens de lutte contre la maladie, comme la distribution massive de moustiquaires imprégnées d’insecticide, a permis un recul de près de 47 % du nombre de décès imputables au paludisme [2]. Cependant, depuis 2015, ce pourcentage stagne. Est en cause, notamment, le développement de résistances du moustique aux insecticides et du parasite aux médicaments antipaludiques. De plus, le vaccin antipaludique le plus avancé (RTS,S)1 ne confère qu’une protection limitée et peu durable : 30 % d’efficacité à 4 ans [3]. Il est donc indispensable de chercher à améliorer les traitements existants et également d’en trouver de nouveaux.
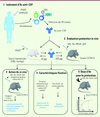 |
Figure 1. Stratégie mise en place pour l’identification de nouveaux anticorps à forte activité neutralisante et corrélation avec l’épitope reconnu. (1-2) Les anticorps spécifiques de la région jonctionnelle de la CSP (sonde peptidique SO2 et protéine entière CSP), issus d’un individu immunisé protégé, ont été isolés et testés pour leur rôle protecteur in vivo. L’anticorps monoclonal (AcM) L9 a montré une efficacité supérieure à celle d’autres AcM injectés à la même dose. Néanmoins, les doses protectrices diffèrent selon le modèle animal utilisé (100 mg versus 10 mg). L’AcM L9, ainsi que d’autres AcM à fort potentiel neutralisant, ont ensuite été étudiés par imagerie afin d’explorer les mécanismes à la base de leur activité neutralisante in vivo (3) ainsi que pour leurs caractéristiques de fixation in vitro vis-à-vis de peptides d’intérêt et de la CSP entière (4). Enfin, la protection conférée par cet AcM a été confirmée en infectant les souris par piqûres de moustiques, un mode d’infection plus proche de la réalité (5). SPZ : sporozoïte ; PfSPZ : sporozoïtes de P. falciparum ; LB : lymphocyte B ; Ac : anticorps ; CSP : circumsporozoite protein ; EC : effective concentration. |
Cinq espèces de Plasmodium infectent l’homme mais c’est Plasmodium falciparum (P. falciparum) qui est responsable de 99,7 % des décès [1]. L’infection débute lorsque les sporozoïtes, la forme invasive et mobile du parasite, sont inoculés dans le derme par le moustique infecté lors d’un repas sanguin [4]. Les sporozoïtes gagnent alors la circulation sanguine et atteignent le foie où ils envahissent les hépatocytes et s’y multiplient. Cette phase du développement parasitaire constitue les stades pré-érythrocytaires. À maturité, les parasites quittent le foie, puis passent dans le sang où ils envahissent les globules rouges pour s’y multiplier et initier le stade érythrocytaire associé aux symptômes (fièvre, céphalée, frissons). Certains parasites se différencient alors en gamétocytes qui, ingérés par un moustique sain lors d’un repas de sang, perpétueront le cycle de vie du parasite chez l’hôte vecteur. Les stades pré-érythrocytaires, et plus particulièrement le stade sporozoïte, extracellulaire, représentent une cible vaccinale de premier choix. En effet, bloquer le développement du parasite avant son entrée dans le foie permettrait d’abolir à la fois les symptômes de la maladie et la transmission du parasite.
La cible du vaccin sous-unitaire RTS,S est la protéine circumsporozoïte ou CSP, protéine de surface majeure du sporozoïte, essentielle à sa motilité et à l’invasion des hépatocytes [5, 6]. Cette protéine est divisée en 3 parties : une partie N-terminale, une partie C-terminale et, entre les deux, des motifs répétés d’acides aminés (NANP, NVDP). Le vaccin RTS,S est composé de certains de ces motifs répétés et de la partie C-terminale de la CSP fusionnée à l’antigène de surface du virus de l’hépatite B : AgHBs.
Récemment, des anticorps monoclonaux (AcM) (l’AcM CIS43, notamment) ciblant la région jonctionnelle entre la partie N-terminale et les motifs répétés de la CSP ont été décrits chez des individus immunisés avec des sporozoïtes de P. falciparum vivants atténués par irradiation (vaccin PfSPZ de Sanaria) (Sanaria® PfSPZ-CVac) [7, 8] et ont montré une efficacité de neutralisation des sporozoïtes supérieure à celle des AcM induits par le vaccin RTS,S et ciblant la région immuno-dominante. La faible efficacité du vaccin pourrait donc être liée à un choix non optimal des motifs antigéniques ciblés sur la CSP. C’est dans l’optique de mieux caractériser ces AcM au potentiel protecteur supérieur que l’équipe de R.A. Seder, grâce à des approches originales, est parvenue à isoler un nouvel AcM prometteur, L9 [9].
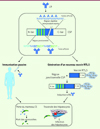 |
Figure 2. Apport de la découverte de l’anticorps L9 à forte activité neutralisante dans le développement de thérapies antipaludiques. En suivant la stratégie expérimentale présentée dans la Figure 1 , les auteurs ont identifié un nouvel AcM neutralisant, L9, conférant chez la souris une protection très supérieure à celle obtenue avec d’autres AcM neutralisants préalablement identifiés. Cet AcM possède plusieurs sites de fixation sur la CSP des sporozoïtes, situés dans la région jonctionnelle et dans la région immuno-dominante. La fixation aux motifs faiblement répétés NPNV de la région jonctionnelle est de plus forte affinité que celle pour la région immuno-dominante. Deux applications thérapeutiques peuvent alors être envisagées pour des traitements prophylactiques antipaludiques : l’immunisation passive avec l’AcM L9 ou l’ajout de la région jonctionnelle au vaccin RTS,S existant, afin d’induire des anticorps ayant les mêmes spécificités mais aussi les mêmes propriétés fonctionnelles que L9 : une activité cytotoxique sur les sporozoïtes conduisant à leur mort et une capacité à inhiber leur traversée des hépatocytes et donc l’infection de ces derniers. CSP : circumsporozoite protein ; Ac : anticorps. |
Mise en évidence d’un nouvel anticorps neutralisant les sporozoïtes de P. falciparum in vivo
À partir de sérums d’individus immunisés avec un nombre élevé de sporozoïtes vivants atténués et protégés de l’infection d’épreuve (infection avec des parasites vivants non atténués pour définir l’efficacité de la protection induite par un vaccin), les auteurs ont identifié les individus exprimant des AcM ciblant la région jonctionnelle de la CSP. L’individu présentant la concentration la plus élevée d’AcM ciblant la sonde S02, mimant le peptide de la région jonctionnelle reconnu par le clone CIS43, a alors été sélectionné et ses lymphocytes B (LB) mémoires clonés. Vingt-huit clones ont ainsi été isolés, puis les AcM ont été testés pour leur rôle protecteur vis-à-vis de l’infection par P. falciparum in vivo. P. falciparum étant strictement spécifique de l’homme, les auteurs ont utilisé deux approches pour déterminer l’effet neutralisant de ces anticorps : les AcM candidats ont été injectés 1) dans des souris C57Bl/6 infectées avec le parasite de rongeurs P. berghei, modifié génétiquement pour exprimer la CSP de P. falciparum (PfCSP) fusionnée avec la GFP (green fluorescent protein) et la luciférase (Luc) (Pb-PfCSP-GFP/Luc) ; 2) dans des souris immunodéficientes humanisées, greffées avec des hépatocytes humains (FRG-huHep-mice), avant infection avec des sporozoïtes de P. falciparum (PfSPZ) [10]. En quantifiant la charge hépatique parasitaire in vivo, par bioluminescence dans le premier modèle et par qPCR (quantitative polymerase chain reaction) dans le second, les auteurs ont identifié un AcM neutralisant, L9. Celui-ci confère une meilleure protection que l’AcM CIS43 déjà décrit [7] et permet d’atteindre un niveau indétectable de parasite après injection de seulement 10 µg d’anticorps.
Première observation in vivo des mécanismes d’action des anticorps neutralisants dans le foie
Les auteurs ont ensuite déterminé par imagerie in vivo les modes d’action de L9 en le comparant à d’autres AcM spécifiques des sporozoïtes de P. falciparum [7, 11-13]. Pour cela, des souris C57BL/6 ont été injectées avec les différents AcM couplés à l’Alexa-405 et avec de la rhodamine-dextran pour marquer les cellules traversées par les parasites, avant d’être inoculées avec des sporozoïtes du parasite Pb-PfCSP-GFP/Luc. Les auteurs ont ainsi pu décrire pour la première fois in vivo l’effet des AcM sur le devenir des parasites dans les sinusoïdes hépatiques et sur la traversée des hépatocytes par les sporozoïtes, étape critique pour l’infection [14]. Ils ont ainsi observé qu’en présence des AcM, les sporozoïtes présents dans les sinusoïdes et traversant les hépatocytes se débarrassent de leur manteau de CSP et se fragmentent, ce qui provoque leur mort, phénomène de « dotty death » déjà rapporté dans la peau [15]. Remarquablement, après fixation de l’AcM L9, ils ont également observé un autre type de mort, par éclatement des parasites, phénomène cytotoxique qui reste néanmoins minoritaire. Grâce à ces expériences, les auteurs concluent à une neutralisation et une activité cytotoxique sur les sporozoïtes de quatre des AcM testés, dont L9, et cela avant que le parasite ne débute son développement dans l’hépatocyte.
Une double spécificité des anticorps corrélée à leur capacité de neutralisation ?
Pour tenter de corréler le potentiel protecteur in vivo des AcM avec leurs sites de fixation, deux méthodes ont été utilisées : l’ELISA (enzyme-linked immunosorbent assay) pour mettre en évidence les motifs de fixation préférentiels des AcM, et la titration calorimétrique isotherme pour préciser la stœchiométrie et l’affinité de liaison des AcM à la CSP. En réalisant ces expériences avec la protéine PfCSP, les auteurs ont pu mettre en évidence que quatre AcM ayant démontré un fort potentiel protecteur in vivo présentaient des caractéristiques de fixation similaires. En effet, ils présentaient tous une double spécificité, d’une part pour un épitope particulier constitué d’acides aminés dans la région jonctionnelle N-terminale, et, d’autre part, pour un épitope localisé dans la région immuno-dominante (NANP). Néanmoins, les affinités de ces AcM pour ces épitopes varient. En effet, les AcM L9 et CIS43 ont montré une plus forte affinité pour les épitopes localisés dans la région jonctionnelle, respectivement NPNV et DPNA, contrairement aux deux autres AcM testés, qui se fixent préférentiellement à l’épitope immuno-dominant (NANP). En conclusion, les résultats obtenus suggèrent une corrélation entre la double spécificité pour les épitopes jonctionnels et immuno-dominant et le haut niveau de protection conféré par ces anticorps in vivo.
Quel futur pour les thérapies antipaludiques à la lumière de ces résultats ?
Ces travaux suggèrent donc que les régions N-terminale et jonctionnelle de la CSP représentent des cibles très prometteuses pour l’amélioration ou le développement de nouvelles thérapies antipaludiques. Plus spécifiquement, la découverte de l’anticorps L9 est importante, car son épitope préférentiel (NPNV) est présent dans 100 % des souches de terrain de P. falciparum testées par les auteurs, indiquant son potentiel pour l’obtention d’une protection croisée « universelle ».
Il est possible d’envisager au moins deux approches thérapeutiques issues de ces travaux. La première approche reposerait sur l’immunisation passive avec l’AcM L9. Ce type de thérapie à base d’anticorps monoclonaux hautement neutralisants est d’ailleurs actuellement testée pour la prise en charge de l’infection par le VIH (virus de l’immunodéficience humaine) [16]. La pharmacocinétique de l’AcM et la dose adéquate à injecter seront des facteurs clefs dans cette démarche. De plus, il sera nécessaire de déterminer quel modèle animal utilisé par les auteurs, les souris humanisées infectées avec des sporozoïtes de P. falciparum ou les souris C57BL/6 infectées avec les sporozoïtes de P. berghei génétiquement modifiés, est le plus pertinent d’un point de vue préclinique, ces deux modèles murins ayant conduit à des valeurs très différentes de concentrations protectrices. La seconde approche reposerait sur l’ajout des séquences N-terminale et jonctionnelle au vaccin RTS,S existant afin d’augmenter son efficacité de protection. Il est important de noter que si l’ajout de ces séquences induit effectivement la production d’anticorps à fort potentiel neutralisant, la durée de vie de cette réponse lymphocytaire B protectrice devra elle aussi être prise en compte car, actuellement, la protection conférée par le vaccin RTS,S n’est que de courte durée.
Enfin, rappelons que l’utilisation de ces thérapies fondées sur la neutralisation des sporozoïtes doit reposer sur une neutralisation totale. En effet, dans le cas où même un seul sporozoïte échapperait à cette neutralisation, compte tenu de la capacité de multiplication massive du parasite au niveau hépatique, cela suffirait à engendrer le stade érythrocytaire, et donc à déclencher la maladie.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- World Health Organization World malaria report 2019, Sl 2019 ; Geneva WHO [Google Scholar]
- World Health Organization Stratégie technique mondiale de lutte contre le paludisme 2016–2030 2015 ; Geneva WHO [Google Scholar]
- RTS.S Clinical trials partnership. efficacy and safety of RTS, S/AS01 malaria vaccine with or without a booster dose in infants and children in Africa: final results of a phase 3, individually randomised, controlled trial. Lancet 2015; 386 : 31–45. [CrossRef] [PubMed] [Google Scholar]
- Cockburn IA Seder RA Malaria prevention: from immunological concepts to effective vaccines and protective antibodies. Nat Immunol 2018 ; 19 : 1199–1211. [CrossRef] [PubMed] [Google Scholar]
- Cohen J Nussenzweig V Vekemans J et al. From the circumsporozoite protein to the RTS. S/AS candidate vaccine. Human Vaccines 2010 ; 6 : 90–96. [Google Scholar]
- Sinnis P Nardin E Sporozoite antigens: biology and immunology of the circumsporozoite protein and thrombospondin-related anonymous protein. Chem Immunol 2002 ;70–96. [CrossRef] [PubMed] [Google Scholar]
- Kisalu NK Idris AH Weidle C et al. A human monoclonal antibody prevents malaria infection by targeting a new site of vulnerability on the parasite. Nat Med 2018 ; 24 : 408–416. [CrossRef] [PubMed] [Google Scholar]
- Murugan R, Scally SW, Costa G, et al. Evolution of protective human antibodies against Plasmodium falciparum circumsporozoite protein repeat motifs. Nat Med 2020; 26 : 1135–45. [CrossRef] [PubMed] [Google Scholar]
- Wang LT, Pereira LS, Flores-Garcia Y, et al. A Potent anti-malarial human monoclonal antibody targets circumsporozoite protein minor repeats and neutralizes sporozoites in the liver. Immunity 2020; 53 : 733–44. [CrossRef] [PubMed] [Google Scholar]
- Vaughan AM Mikolajczak SA Wilson EM et al. Complete Plasmodium falciparum liver-stage development in liver-chimeric mice. J Clin Invest 2012 ; 122 : 3618–3628. [PubMed] [Google Scholar]
- Oyen D Torres JL Wille-Reece U et al. Structural basis for antibody recognition of the NANP repeats in Plasmodium falciparum circumsporozoite protein. Proc Natl Acad Sci USA 2017 ; 114 : 10438–10445. [Google Scholar]
- Tan J Sack BK Oyen D et al. A public antibody lineage that potently inhibits malaria infection through dual binding to the circumsporozoite protein. Nat Med 2018 ; 24 : 401–407. [PubMed] [Google Scholar]
- Imkeller K Scally SW Bosch A et al. Antihomotypic affinity maturation improves human B cell responses against a repetitive epitope. Science 2018 ; 360 : 1358–1362. [PubMed] [Google Scholar]
- Yang ASP O’Neill MT Jennison C et al. Cell traversal activity is important for plasmodium falciparum liver infection in humanized mice. Cell Rep 2017 ; 18 : 3105–3116. [PubMed] [Google Scholar]
- Aliprandini E Tavares J Panatieri RH et al. Cytotoxic anti-circumsporozoite antibodies target malaria sporozoites in the host skin. Nat Microbiol 2018 ; 3 : 1224–1233. [PubMed] [Google Scholar]
- Burton DR Hangartner L Broadly neutralizing antibodies to hiv and their role in vaccine design. Annu Rev Immunol 2016 ; 34 : 635–659. [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Stratégie mise en place pour l’identification de nouveaux anticorps à forte activité neutralisante et corrélation avec l’épitope reconnu. (1-2) Les anticorps spécifiques de la région jonctionnelle de la CSP (sonde peptidique SO2 et protéine entière CSP), issus d’un individu immunisé protégé, ont été isolés et testés pour leur rôle protecteur in vivo. L’anticorps monoclonal (AcM) L9 a montré une efficacité supérieure à celle d’autres AcM injectés à la même dose. Néanmoins, les doses protectrices diffèrent selon le modèle animal utilisé (100 mg versus 10 mg). L’AcM L9, ainsi que d’autres AcM à fort potentiel neutralisant, ont ensuite été étudiés par imagerie afin d’explorer les mécanismes à la base de leur activité neutralisante in vivo (3) ainsi que pour leurs caractéristiques de fixation in vitro vis-à-vis de peptides d’intérêt et de la CSP entière (4). Enfin, la protection conférée par cet AcM a été confirmée en infectant les souris par piqûres de moustiques, un mode d’infection plus proche de la réalité (5). SPZ : sporozoïte ; PfSPZ : sporozoïtes de P. falciparum ; LB : lymphocyte B ; Ac : anticorps ; CSP : circumsporozoite protein ; EC : effective concentration. |
| Dans le texte | |
 |
Figure 2. Apport de la découverte de l’anticorps L9 à forte activité neutralisante dans le développement de thérapies antipaludiques. En suivant la stratégie expérimentale présentée dans la Figure 1 , les auteurs ont identifié un nouvel AcM neutralisant, L9, conférant chez la souris une protection très supérieure à celle obtenue avec d’autres AcM neutralisants préalablement identifiés. Cet AcM possède plusieurs sites de fixation sur la CSP des sporozoïtes, situés dans la région jonctionnelle et dans la région immuno-dominante. La fixation aux motifs faiblement répétés NPNV de la région jonctionnelle est de plus forte affinité que celle pour la région immuno-dominante. Deux applications thérapeutiques peuvent alors être envisagées pour des traitements prophylactiques antipaludiques : l’immunisation passive avec l’AcM L9 ou l’ajout de la région jonctionnelle au vaccin RTS,S existant, afin d’induire des anticorps ayant les mêmes spécificités mais aussi les mêmes propriétés fonctionnelles que L9 : une activité cytotoxique sur les sporozoïtes conduisant à leur mort et une capacité à inhiber leur traversée des hépatocytes et donc l’infection de ces derniers. CSP : circumsporozoite protein ; Ac : anticorps. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




