| Issue |
Med Sci (Paris)
Volume 37, Number 8-9, Août–Septembre 2021
|
|
|---|---|---|
| Page(s) | 706 - 708 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2021104 | |
| Published online | 07 September 2021 | |
L’infarctus du myocarde accentue le phénotype immunosuppresseur et pro-tumoral des monocytes inflammatoires
Un mécanisme d’aggravation du cancer par les maladies cardiovasculaires
Myocardial infarction exacerbates protumoral and immunosuppressive functions of inflammatory monocytes: A link between cardiovascular diseases and cancer
1
Inserm U976, Immunologie humaine, physiopathologie et immunothérapie (HIPI), équipe Physiopathologie des cancers du sein, Hôpital Saint-Louis, 1 avenue Claude Vellefaux, 75475 Paris Cedex 10, France
2
Inserm U970, Paris-Centre de recherche cardiovasculaire (PARCC), 56 rue Leblanc, 75737 Paris Cedex 15, France
En dépit des progrès réalisés dans le diagnostic et le traitement des tumeurs malignes, le cancer compte parmi les premières causes de mortalité dans le monde. Il est aujourd’hui admis que, outre l’implication de modifications génétiques, l’environnement général peut contribuer au développement du cancer. Par exemple, un régime obésogène peut moduler le phénotype des cellules adipocytaires et modifier le microbiote intestinal, des processus dont on sait maintenant qu’ils peuvent accélérer la croissance de tumeurs primaires et le développement de métastases, en particulier par la mise en place d’une inflammation généralisée néfaste [1]. Des taux élevés de monocytes sanguins sont le reflet d’une inflammation générale, qu’elle soit aiguë, donc transitoire, ou chronique, donc durable. Dans le cas de maladies cardiovasculaires, telles que l’athérosclérose, des taux de monocytes circulants élevés entretiennent la maladie athéromateuse [2]. Par ailleurs, il a été montré que la survenue d’un infarctus du myocarde ou d’un accident vasculaire cérébral reprogrammait la production de monocytes, conduisant de fait à une augmentation persistante des taux sanguins de monocytes et à une accélération de la maladie athéromateuse [3]. Dans de nombreux cancers, le taux élevés de monocytes est corrélé à un mauvais pronostic, car ces monocytes infiltrent la tumeur et participent à l’évasion tumorale et au remaniement matriciel. L’inflammation et la monocytose associée pourraient donc relier les maladies cardiovasculaires et le cancer. La question abordée par Koelwyn et al., dans un article publié en 2020 [4], est de savoir si les modifications générales entraînées par un infarctus du myocarde peuvent moduler la tumorigenèse.
En utilisant des modèles murins et des données cliniques humaines, les auteurs ont étudié la relation entre les maladies cardiovasculaires et le cancer. Ils ont trouvé que l’infarctus du myocarde favorisait la croissance tumorale et augmentait le risque de mort liée au cancer.
Avec un premier modèle murin syngénique de cancer du sein (modèle E0771), les auteurs ont évalué la croissance des tumeurs solides chez des souris ayant subi un infarctus du myocarde en bloquant le flux de l’artère coronaire descendante antérieure trois jours après implantation des cellules tumorales dans le coussinet adipeux mammaire. Ils ont observé que l’induction de l’infarctus du myocarde doublait la croissance tumorale après vingt jours, par rapport à des souris témoins ayant subi une chirurgie placebo (groupe « sham »). Des analyses par immunofluorescence et cytométrie en flux ont montré le doublement du taux de prolifération des cellules immunitaires CD45+ et non immunitaires dans les tumeurs des souris ayant subi l’infarctus du myocarde. L’analyse de l’infiltrat leucocytaire a par ailleurs révélé la présence d’un nombre accru de cellules CD45+, en particulier les monocytes CD11b+ Ly6G- Ly6Chi dans les tumeurs, après infarctus du myocarde, alors qu’aucune différence n’était observée concernant le nombre de macrophages, de granulocytes neutrophiles ou de cellules dendritiques. Les tumeurs des souris avec infarctus du myocarde présentaient un enrichissement en lymphocytes T régulateurs (Treg), malgré une diminution de l’infiltration des lymphocytes T.
Les auteurs ont observé qu’un infarctus du myocarde augmente les taux sanguins de monocytes Ly6Chi chez les souris, un phénomène déjà décrit auparavant [5]. Cependant, il est apparu que, chez les souris porteuses de tumeurs, ces taux restaient élevés après douze jours, alors qu’ils se normalisaient, comme attendu, chez des souris non porteuses de tumeurs, indiquant la mise en place d’une inflammation aiguë non résolue chez les premières. Les auteurs ont vérifié que l’infarctus du myocarde seul ne modulait pas les capacités migratoires des monocytes vers la tumeur : en effet, le transfert adoptif de monocytes issus de souris CD45.1 avec ou sans infarctus du myocarde à des souris CD45.2 porteuses de tumeurs conduisait à des taux équivalents de monocytes Ly6Chi CD45.1 infiltrant les tumeurs. En revanche, les auteurs ont mis en évidence le fait qu’un infarctus du myocarde modulait le phénotype des tumeurs en augmentant l’expression de la chimiokine CXCL13 (C-X-C motif chemokine ligand 13) et de son récepteur CXCR5 (C-X-C motif chemokine receptor 5), suggérant la mise en place de signaux chimio-attractants dans ces tumeurs. Afin de tester le lien entre l’augmentation de la disponibilité et du recrutement des monocytes Ly6Chi et la croissance tumorale, les auteurs ont utilisé des stratégies de déplétion cellulaire. Ils ont montré que la déplétion totale en monocytes Ly6Chi limitait l’accélération de la croissance tumorale après induction d’un infarctus du myocarde, et modifiait les réponses immuno-inflammatoires dans la tumeur. Remarquablement, les auteurs ont observé que la déplétion des monocytes Ly6Chi chez les souris témoins (groupe « sham ») n’avait pas d’effet sur la croissance tumorale. Cela suggérait donc que l’effet délétère des monocytes Ly6Chi était lié au contexte inflammatoire particulier créé par l’infarctus du myocarde. En d’autres termes, c’est l’exposition des monocytes à l’infarctus du myocarde qui révélait leur phénotype immunosuppresseur, indépendamment de leur capacité migratoire, comme mentionné plus haut (Figure 1).
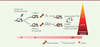 |
Figure 1. Implication de l’infarctus du myocarde dans l’aggravation de la tumorigenèse. L’induction d’un infarctus du myocarde trois jours après l’injection de cellules tumorales augmente la production de monocytes Ly6Chi et l’expression de chimiokines dans la tumeur en croissance. Les monocytes circulants Ly6Chi en excès infiltrent la tumeur et se différencient en cellules myéloides immunosuppressives (mMDSC), qui contrôlent l’équilibre des lymphocytes T et favorisent la croissance tumorale. « Sham » désigne le groupe des souris témoins ayant subi une chirurgie placebo. |
Les auteurs ont ensuite combiné des analyses transcriptomiques et des cartographies des sites d’accessibilité de la chromatine (ATAC-seq) comparatives des monocytes de la moelle et du sang, et des cellules myéloïdes suppressives monocytaires (monocytic myeloid-derived suppressor cells, mMDSC) de la tumeur, 9 et 17 jours après l’infarctus du myocarde. Ces analyses ont mis en évidence l’expression différentielle, stable dans le temps, de gènes directement impliqués dans la modulation du système immunitaire. Ces résultats suggèrent que le survenue d’un infarctus du myocarde s’accompagne d’une reprogrammation épigénétique des monocytes vers un état d’immunosuppression favorisant l’accélération de la croissance tumorale (Figure 2).
Afin de montrer que ces résultats étaient applicables à d’autres cancers, les auteurs ont utilisé un modèle murin de croissance spontanée de cancer du sein (MMTV-PyMT) [4]. Par ailleurs, une analyse rétrospective de femmes ayant un cancer du sein, sans antécédent de maladies cardiovasculaires et sans facteurs de risque cardiovasculaire au moment du diagnostic du cancer, indiquait que la survenue d’un accident cardiovasculaire après le diagnostic de la tumeur augmentait le risque de récidive du cancer et la mortalité liée à ce cancer [4]. Ces données cliniques corroboraient donc les résultats de l’étude expérimentale chez la souris.
Plusieurs questions restent en suspens. Les auteurs montrent que l’infarctus du myocarde seul induit une monocytose transitoire, qui se résout en douze jours, alors que la présence de la tumeur induit sa persistance. Il semble donc que l’infarctus du myocarde soit le facteur déclenchant de la production hématopoïétique de monocytes Ly6Chi, mais que la combinaison de l’infarctus du myocarde et de la tumeur soit responsable du maintien de la monocytose et de la reprogrammation épigénétique stable des monocytes dans le temps (Figure 2). Ces données soulèvent la question du rôle joué par la tumeur elle-même dans la reprogrammation épigénétique des cellules progénitrices des monocytes de la moelle osseuse. La tumeur pourrait-elle produire des molécules permettant d’entretenir l’inflammation générale et la monocytose déclenchées par l’infarctus du myocarde ? Quels facteurs seraient responsables de la reprogrammation épigénétique ? Les auteurs ayant montré une augmentation du taux de prolifération des cellules tumorales et immunitaires dans la tumeur des souris soumises à un infarctus du myocarde, on pourrait envisager que la tumeur elle-même soit une source ou un réservoir de cellules progénitrices de mMDSC.
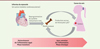 |
Figure 2. Lien entre maladies cardiovasculaires et cancer. L’infarctus du myocarde déclenche une réponse inflammatoire aiguë se traduisant par une production accrue de monocytes Ly6Chi. La présence d’une tumeur mammaire entretient cette inflammation et la prolonge dans le temps. L’excès de monocytes en circulation accélère la tumorigenèse et augmente le risque de mort liée au cancer. |
Les auteurs mentionnent le risque accru de progression du cancer du sein chez les femmes ayant subi un accident cardiovasculaire après le diagnostic du cancer, sans toutefois considérer l’impact probable des thérapies ou des conjonctions de thérapies dans les modifications épigénétiques des précurseurs hématopoïétiques et dans la progression tumorale. Cependant, il est à noter que les accidents cardiovasculaires pris en compte dans cette étude n’étaient pas limités à l’infarctus du myocarde et aux maladies cardiaques, mais incluaient également les accidents vasculaires, ce qui suggère l’existence de mécanismes plus généraux, qui pourraient éventuellement être observés dans d’autres maladies aiguës. La poursuite des travaux portant sur le lien entre maladies cardiovasculaires et cancers devrait permettre de progresser dans la compréhension des effets délétères de comorbidités chez les individus atteints d’un cancer.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Gallagher EJ LeRoith D Obesity and diabetes: the increased risk of cancer and cancer-related mortality. Physiol Rev 2015 ; 95 : 727–748. [CrossRef] [PubMed] [Google Scholar]
- Combadière C Potteaux S Rodero M et al. Combined inhibition of CCL2, CX3CR1, and CCR5 abrogates Ly6Chi and Ly6Clo monocytosis and almost abolishes atherosclerosis in hypercholesterolemic mice. Circulation 2008 ; 117 : 1649–1657. [CrossRef] [PubMed] [Google Scholar]
- Dutta P Courties G Wei Y et al. Myocardial infarction accelerates atherosclerosis. Nature 2012 ; 487 : 325–329. [CrossRef] [PubMed] [Google Scholar]
- Koelwyn GJ, Newman AAC, Afonso MS, et al. Myocardial infarction accelerates breast cancer via innate immune reprogramming. Nat Med 2020; 26 : 1452–8. [CrossRef] [PubMed] [Google Scholar]
- Nahrendorf M Swirski FK Aikawa E et al. The healing myocardium sequentially mobilizes two monocyte subsets with divergent and complementary functions. J Exp Med 2007 ; 204 : 3037–3047. [CrossRef] [PubMed] [Google Scholar]
© 2021 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Implication de l’infarctus du myocarde dans l’aggravation de la tumorigenèse. L’induction d’un infarctus du myocarde trois jours après l’injection de cellules tumorales augmente la production de monocytes Ly6Chi et l’expression de chimiokines dans la tumeur en croissance. Les monocytes circulants Ly6Chi en excès infiltrent la tumeur et se différencient en cellules myéloides immunosuppressives (mMDSC), qui contrôlent l’équilibre des lymphocytes T et favorisent la croissance tumorale. « Sham » désigne le groupe des souris témoins ayant subi une chirurgie placebo. |
| Dans le texte | |
 |
Figure 2. Lien entre maladies cardiovasculaires et cancer. L’infarctus du myocarde déclenche une réponse inflammatoire aiguë se traduisant par une production accrue de monocytes Ly6Chi. La présence d’une tumeur mammaire entretient cette inflammation et la prolonge dans le temps. L’excès de monocytes en circulation accélère la tumorigenèse et augmente le risque de mort liée au cancer. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




