| Issue |
Med Sci (Paris)
Volume 36, Number 11, Novembre 2020
Nos jeunes pousses ont du talent !
|
|
|---|---|---|
| Page(s) | 1074 - 1077 | |
| Section | Partenariat médecine/sciences - Écoles doctorales - Masters | |
| DOI | https://doi.org/10.1051/medsci/2020214 | |
| Published online | 05 November 2020 | |
Le monoxyde d’azote: Une arme du système immunitaire pour brouiller les communications entre bactéries
Microorganismes et communication intercellulaire
Host nitric oxide disrupts microbial cell-to-cell communication to inhibit staphylococcal virulence
Microbes and intercellular communication
École normale supérieure de Lyon, Département de biologie, Master biologie, Lyon, France
* merlin.despres@ens-lyon.fr
** simon.gaudin@ens-lyon.fr
Le dossier thématique suivant a été rédigé par les étudiantes et étudiants de Master 1 de Biologie de l’École Normale Supérieure de Lyon à l’issue de l’UE Microbiologie Moléculaire et Structurale (2019-2020). Le Master de Biologie de l’ENS de Lyon, cohabilité par l’université Claude Bernard Lyon 1, accueille chaque année environ 50 étudiants en M1 et en M2 et propose une formation de haut niveau à la recherche en biosciences. Chaque étudiant y construit son parcours à la carte, en choisissant ses options parmi un large panel de modules, favorisant ainsi une approche pluridisciplinaire des sciences du vivant, et ce en relation étroite avec les laboratoires de recherche du tissu local, national et international.
En participant à diverses activités scientifiques connexes aux UE de leur formation, les étudiants préparent également l’obtention du Diplôme de l’ENS de Lyon, qui valide leur scolarité à l’ENS. La rédaction du présent dossier, qui vise à transmettre de façon claire les messages issus d’une sélection d’articles scientifiques publiés récemment dans le domaine de la microbiologie, constitue l’une de ces activités connexes proposées aux étudiants.
Les bactéries peuvent vivre en communautés dont la structure est régulée par de nombreuses interactions abiotiques et biotiques. Les interactions biotiques reposent sur des communications inter-bactériennes qui participent à la mise en place de relations de collaboration, de compétition ou de prédation. Ces communautés bactériennes peuvent en outre être en interaction avec des hôtes animaux, dans le cas des bactéries du microbiote ou des bactéries pathogènes par exemple, ou avec des virus parasites, les bactériophages. Le présent dossier illustre quelques aspects nouveaux de cette communication bactérienne, et de la façon dont les interactions bactéries/hôte ou bactéries/phages peuvent impacter cette communication.
Deux nouvelles s’attardent sur des découvertes récentes autour du quorum sensing, une modalité de communication bactérienne permettant l’expression coordonnée des gènes à l’échelle de la population, en fonction de la densité de la population. La nouvelle intitulée « Le monoxyde d’azote : une arme du système immunitaire pour brouiller les communications entre bactéries » illustre comment le quorum sensing chez Staphylococcus aureus, une bactérie opportuniste, peut être affecté par un médiateur du système immunitaire de la souris. La nouvelle intitulée « Un bactériophage exploite le système de communication de son hôte bactérien pour entrer en cycle lytique » montre une stratégie étonnante par laquelle le phage VP882 décrypte des signaux issus du quorum sensing de la bactérie qu’il infecte pour réguler son propre cycle de réplication.
Au-delà du quorum sensing, deux nouvelles décrivent de nouvelles modalités de communication inter-bactérienne. La nouvelle intitulée « Les nanotubes bactériens, acteurs de la compétition entre Bacillus subtilis et Bacillus megaterium » met en lumière le rôle des nanotubes, des structures de communication intercellulaire insoupçonnées jusque récemment chez les bactéries. La nouvelle intitulée « La bactérie Vibrio cholerae lyse les bactéries environnantes et assimile leur ADN qu’elle intègre dans son propre génome » illustre comment un système de sécrétion, qui permet l’injection d’effecteurs bactériens dans des cellules cibles, peut être exploité pour faciliter les transferts horizontaux de gènes chez les bactéries.
Enfin, pour élargir la réflexion au monde des virus eucaryotes, deux nouvelles montrent comment l’infection virale peut interférer avec la communication entre cellules eucaryotes, sur l’exemple de la communication s’effectuant par l’intermédiaire de vésicules extracellulaires. La nouvelle intitulée « La sécrétion de vésicules extracellulaires par les plaquettes activées à l’origine de la létalité de la dengue ? » discute des mécanismes par lesquels le virus de la dengue déclenche la sécrétion de vésicules extracellulaires par les plaquettes, et des conséquences que cela peut avoir sur l’inflammation et le déclenchement de chocs hémorragiques. La nouvelle intitulée « Le coccolithovirus et Emiliania huxleyi : le détournement viral des vésicules extracellulaires » montre enfin comment ce virus d’algue unicellulaire exploite la communication intercellulaire de son hôte pour augmenter son pouvoir de diffusion au sein de la population, et des conséquences écologiques et géochimiques que cela peut entraîner à grande échelle.
© 2020 médecine/sciences – Inserm
Équipe pédagogique
Chloé Journo (maître de conférences, ENS de Lyon). Co-responsable de l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École normale supérieure de Lyon, Lyon, France
Théodore Grenier (doctorant moniteur, ENS de Lyon). Équipe génomique fonctionnelle des interactions hôte/bactéries, Institut de génomique fonctionnelle de Lyon, Université de Lyon, École normale supérieure de Lyon, CNRS UMR 5242, Université Claude Bernard Lyon 1, Lyon, France
Renaud Mahieux (professeur, ENS de Lyon). Co-responsable de l’UE microbiologie moléculaire et structurale. Équipe oncogenèse rétrovirale, Centre international de recherche en infectiologie, Inserm U1111 - CNRS UMR5308, École normale supérieure de Lyon, Lyon, France

Les interactions entre un hôte et les microorganismes qu’il héberge prennent la forme d’un continuum allant de la relation commensale à la symbiose ou au parasitisme. L’équilibre de la relation commensale peut parfois être rompu, lors d’une rupture des barrières immunitaires de l’hôte, ou quand l’essor de la virulence de l’espèce commensale la rend pathogène. Cette espèce commensale devient alors un pathogène opportuniste.
Parmi les pathogènes opportunistes bien connus, la bactérie Gram-positive Staphylococcus aureus (S. aureus) est une source majeure d’infections. S. aureus est présente au niveau de la peau et des voies respiratoires chez environ un tiers de la population humaine, chez des individus dits porteurs sains. S. aureus peut mettre en place des stratégies d’infection et d’échappement au système immunitaire très variées, ce qui la rend responsable d’infections très diverses, et en particulier d’infections nosocomiales [1].
L’émergence des infections nosocomiales à staphylocoque constitue un enjeu scientifique et médical majeur, d’autant plus que certaines souches développent des résistances aux antibiotiques [2]. Des études ont démontré que le passage d’un état commensal à un état pathogène opportuniste chez S. aureus est modulé par le quorum sensing, une modalité de communication bactérienne permettant l’expression coordonnée des gènes à l’échelle de la population en fonction de sa densité. Ce système est fondé sur la détection de peptides sécrétés par les bactéries, dont la concentration extracellulaire est positivement corrélée à la densité bactérienne. La signalisation intracellulaire induite par la détection de ces peptides est responsable de leur propre production : ces peptides sont appelés « peptides auto-inducteurs » (AIP, pour auto-inducer peptides). La détection de ces peptides induit également l’expression de facteurs de virulence. Ainsi, la virulence d’une souche initialement commensale peut être déclenchée lorsqu’une certaine densité bactérienne est atteinte. Chez S. aureus, l’opéron agr a été décrit comme le facteur central du quorum sensing, et le facteur de transcription AgrA, comme un activateur majeur des facteurs de virulence [3].
Maintenir une relation commensale implique que l’hôte assure un certain contrôle de ses commensaux, via des modalités de protection passives (barrières physiques, température, pH, etc.), ou via des mécanismes actifs modulés par le système immunitaire [4]. Parmi les armes de ce dernier, le monoxyde d’azote (NO, nitric oxide), une petite molécule diffusible, est, chez les mammifères, un médiateur antibactérien et antiparasitaire bien connu [5]. Produit par l’enzyme iNOS (inducible nitric oxide synthase) en réponse à la perception de motifs microbiens, en particulier dans les cellules du système immunitaire inné, comme les macrophages [5], le NO peut altérer la fonctionnalité des protéines bactériennes, en se liant à leurs résidus cystéine (nitrosylation), ce qui perturbe la physiologie de la bactérie. L’effet pléiotrope du NO sur l’ensemble du métabolisme bactérien constitue ainsi un stress nitrosatif responsable de l’inhibition globale de la croissance bactérienne [6, 7].
Cherchant à caractériser les multiples cibles bactériennes de la nitrosylation, Urbano et al. ont réalisé un crible par spectrométrie de masse de l’ensemble des protéines nitrosylées de S. aureus [8]. Parmi celles-ci, les auteurs soulignent la prédominance des enzymes à rôle métabolique, ce qui est cohérent avec l’effet bactériostatique du NO précédemment décrit. Mais la nouveauté ici est l’identification, parmi les protéines nitrosylées au niveau de leurs sites fonctionnels, du facteur de transcription AgrA, fondamental au quorum sensing. Cette observation les a conduits à émettre l’hypothèse que le NO, en plus de ses effets bactériostatiques, pourrait également interférer directement avec le quorum sensing, et donc jouer un rôle crucial dans la régulation de la virulence de S. aureus. C’est cette hypothèse que les auteurs s’attachent à démontrer dans cette étude.
La nitrosylation d’AgrA réduit l’expression des facteurs de virulence chez S. aureus
Urbano et al. ont d’abord évalué par RT-qPCR (reverse transcription-quantitative polymerase chain reaction) l’effet du NO sur l’expression des gènes régulés par AgrA, dont ceux de l’opéron agr et de facteurs de virulence (RNAIII, psm alpha, psm beta). Leurs résultats montrent que l’expression de ces gènes cibles diminue quand la concentration de NO augmente. De plus, les expériences de RT-qPCR chez des mutants bactériens (ΔagrBD, agrC C91S et agrC C371S) montrent que le NO n’inhibe pas fonctionnellement les autres acteurs du quorum sensing (AgrB, AgrC et AgrD), et que la baisse de l’expression des gènes cibles d’AgrA observée en présence de NO n’est pas due à une baisse générale de la transcription. AgrA semble donc la seule cible fonctionnelle du NO dans la boucle d’autorégulation de l’opéron agr. Ainsi, le NO régule l’expression des gènes de virulence via la modulation de l’activité d’AgrA.
Urbano et al. ont ensuite testé si la nitrosylation d’AgrA déstabilisait la protéine, accélérant ainsi sa dégradation et limitant donc son activité. En inhibant temporairement la traduction à l’aide de tétracycline, les auteurs n’ont pas constaté de dégradation accrue d’AgrA en présence de NO, réfutant donc cette hypothèse. Afin d’identifier les résidus cystéines essentiels à l’action inhibitrice de la nitrosylation, les auteurs ont alors procédé à une série de mutations site-spécifiques afin de remplacer les cystéines par des acides aminés non sensibles à la nitrosylation. Seul le remplacement des cystéines en position 55, 123 et 199 est associé à une perte de sensibilité au NO, mesurée via les variations d’expression de RNAIII, effecteur du quorum sensing en aval d’AgrA. Remarquablement, le résidu C199 est situé au niveau du domaine d’interaction avec l’ADN d’AgrA, ce qui a conduit les auteurs à émettre l’hypothèse que sa nitrosylation préviendrait l’interaction d’AgrA avec ses séquences cibles, notamment les promoteurs de l’opéron agr et des facteurs de virulence. Cette hypothèse a été confirmée par ChIP-qPCR (immunoprécipitation de la chromatine suivie d’une PCR quantitative) : en présence de NO, le taux de fixation d’AgrA sur les promoteurs de l’opéron agr et du facteur de virulence RNAIII est divisé par plus d’un facteur trois.
Ainsi, l’absence d’activation transcriptionnelle des gènes cibles d’AgrA en présence de NO est due à la nitrosylation spécifique de certains résidus, prévenant l’interaction d’AgrA avec les séquences cibles, et non à une diminution globale de la transcription potentiellement provoquée par les effets métaboliques du NO. L’opéron agr s’autorégulant positivement, l’inhibition fonctionnelle d’AgrA se manifeste in fine par une diminution de sa propre expression.
Pour résumer, les auteurs ont démontré un effet direct de la nitrosylation sur l’activité de régulation transcriptionnelle d’AgrA, par inhibition de sa fixation à l’ADN, et un effet indirect par diminution de son expression, du fait de la boucle de rétrocontrôle positif de l’opéron agr.
Le monoxyde d’azote assure un rôle protecteur in vivo face aux infections à staphylocoque
Afin de confirmer in vivo l’implication du NO dans la régulation de la virulence de S. aureus, les auteurs ont généré une lignée murine iNOS -/-, déficiente pour la production endogène de NO. Les auteurs ont cherché à déterminer si le NO est impliqué dans une meilleure résistance des souris à l’infection par S. aureus. La mortalité 12 heures post-infection des souris iNOS -/- est deux fois plus importante que celle des souris témoins WT. Ainsi, le NO est clairement impliqué dans la survie des souris à l’infection, et donc potentiellement dans la réponse immunitaire antibactérienne.
L’effet du NO sur le contrôle de l’infection pourrait s’expliquer par un effet bactériostatique, largement décrit, et/ou par une action directe sur l’expression des facteurs de virulence. Pour tester la première hypothèse, les auteurs ont suivi l’évolution de la charge bactérienne au cours de l’infection, sans qu’aucune différence significative ne soit mise en évidence : le NO ne semble pas interférer avec la prolifération bactérienne. Ces résultats corroborent des études antérieures montrant que S. aureus possède un système à deux composants lui assurant une adaptation métabolique et réplicative au stress nitrosatif [9]. Ainsi, l’effet protecteur du NO ne serait pas dû à un effet bactériostatique, mais à une réduction de la virulence de S. aureus. En effet, les souris iNOS -/- développent des pneumonies à staphylocoques plus sévères que les souris WT, se traduisant notamment par une production accrue de facteurs de virulence tels que l’a-toxine. En réponse à cette production accrue, la concentration sérique de nombreuses cytokines pro-inflammatoires (CXCL1, MCP-1, IL-17A, TNF-a) est plus élevée chez les souris iNOS -/- que chez les souris WT, conduisant à la sévérité des symptômes.
De tous ces résultats, les auteurs concluent que suite à l’infection par S. aureus, la production de NO protège l’hôte en inhibant l’expression des facteurs de virulence bactériens, prévenant ainsi une réponse inflammatoire délétère.
Conclusion
En bref, le NO interfère avec la communication bactérienne par l’inhibition directe de l’action du facteur de transcription AgrA, acteur central du quorum sensing, régulant la virulence de S. aureus chez l’hôte (Figure 1). Remarquablement, il a été montré que lors d’un stress oxydatif, par exemple au cours de la réponse immunitaire, AgrA est également oxydé sur le résidu C199. De manière similaire à la nitrosylation, cette oxydation empêche la fixation d’AgrA à ses gènes cibles ce qui interromprait la boucle du quorum sensing et l’expression des facteurs de virulence qui lui sont associés [10].
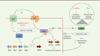 |
Figure 1. Le monoxyde d’azote produit par l’hôte inhibe spécifiquement AgrA, ce qui perturbe le quorum sensing et limite ainsi la virulence de Staphylococcus aureus. Le quorum sensing chez Staphylococcus aureus est assuré par les produits de l’opéron agr. La concentration extracellulaire du peptide auto-inducteur (AIP) est perçue par AgrC, entraînant l’activation d’AgrA, facteur de transcription qui assure l’expression de son propre opéron et de facteurs de virulence. La détection de composés microbiens entraîne la production de monoxyde d’azote (NO) par les cellules du système immunitaire inné de l’hôte, qui inhibe fonctionnellement AgrA par nitrosylation, et qui limite ainsi l’expression des facteurs de virulence et la réaction inflammatoire délétère. Le NO est donc un facteur de l’équilibre de la relation commensale entre l’hôte et Staphylococcus aureus. |
Chez un grand nombre d’espèces bactériennes, le quorum sensing contrôle certains phénomènes collectifs comme par exemple la dynamique de formation et la dispersion du biofilm, qui peuvent être impliqués dans la transition d’un état commensal vers un état pathogène. L’interférence du NO avec le quorum sensing pourrait donc également moduler la dynamique du biofilm, renforçant ainsi le contrôle de la virulence des microorganismes hébergés [11].
Le NO à faible concentration est une molécule de signalisation importante chez les Mammifères [12]. L’évolution aurait pu sélectionner la synthèse de NO à forte concentration comme un moyen de réguler la virulence des pathogènes opportunistes. Son action précisément ciblée sur le quorum sensing, qui régule la virulence en fonction de la densité de la population, en fait en effet un outil de choix pour maintenir les populations bactériennes dans des limites compatibles avec leur état commensal et prévenir leur passage vers un état pathogène opportuniste. Au vu de l’efficacité d’un tel système dans l’augmentation de la survie de l’hôte face au pathogène opportuniste S. aureus, et de la conservation des acteurs du quorum sensing au sein du monde bactérien, les auteurs de l’étude suggèrent que la régulation du quorum sensing bactérien par le NO est probablement très répandue au sein des mammifères et en fait une potentielle nouvelle voie de recherche thérapeutique à l’heure de l’antibiorésistance [13].
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Tong SYC, Davis JS, Eichenberger E, et al. Staphylococcus aureus Infections: epidemiology, pathophysiology, clinical manifestations, and management. Clin Microbiol Rev 2015 ; 28 : 603–661. [Google Scholar]
- https://www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance. [Google Scholar]
- Le KY, Otto M. Quorum-sensing regulation in staphylococci: an overview. Front Microbiol 2015; 6. [Google Scholar]
- Hooper LV, Littman DR, Macpherson AJ Interactions between the microbiota and the immune system. Science 2012 ; 336 : 1268–1273. [Google Scholar]
- Bogdan C. Nitric oxide synthase in innate and adaptive immunity: an update. Trends Immunol. 2015 ; 36 : 161–178. [CrossRef] [PubMed] [Google Scholar]
- Yu H, Sato EF, Nagata K, et al. Oxygen-dependent regulation of the respiration and growth of Escherichia coli by nitric oxide. FEBS Lett 1997 ; 409 : 161–165. [CrossRef] [PubMed] [Google Scholar]
- Stern AM, Zhu J An introduction to nitric oxide sensing and response in bacteria. Adv Appl Microbiol 2014 ; 87 : 187–220. [CrossRef] [PubMed] [Google Scholar]
- Urbano R, Karlinsey JE, Libby SJ, et al. host nitric oxide disrupts microbial cell-to-cell communication to inhibit staphylococcal virulence. Cell Host Microbe 2018 ; 23 : 594–606 e7. [Google Scholar]
- Richardson AR, Dunman PM, Fang FC The nitrosative stress response of Staphylococcus aureus is required for resistance to innate immunity. Mol Microbiol 2006 ; 61 : 927–939. [CrossRef] [PubMed] [Google Scholar]
- Sun F, Liang H, Kong X, et al. Quorum-sensing agr mediates bacterial oxidation response via an intramolecular disulfide redox switch in the response regulator AgrA. Proc Natl Acad Sci USA 2012 ; 109 : 9095–9100. [CrossRef] [Google Scholar]
- Heckler I, Boon EM. insights into nitric oxide modulated quorum sensing pathways. Front Microbiol 2019; 10. [Google Scholar]
- Donald JA, Forgan LG, Cameron MS The evolution of nitric oxide signalling in vertebrate blood vessels. J Comp Physiol B 2015 ; 185 : 153–171. [Google Scholar]
- Salam AM, Quave CL. targeting virulence in staphylococcus aureus by chemical inhibition of the accessory gene regulator system in vivo. mSphere 2018; 3. [Google Scholar]
Liste des figures
 |
Figure 1. Le monoxyde d’azote produit par l’hôte inhibe spécifiquement AgrA, ce qui perturbe le quorum sensing et limite ainsi la virulence de Staphylococcus aureus. Le quorum sensing chez Staphylococcus aureus est assuré par les produits de l’opéron agr. La concentration extracellulaire du peptide auto-inducteur (AIP) est perçue par AgrC, entraînant l’activation d’AgrA, facteur de transcription qui assure l’expression de son propre opéron et de facteurs de virulence. La détection de composés microbiens entraîne la production de monoxyde d’azote (NO) par les cellules du système immunitaire inné de l’hôte, qui inhibe fonctionnellement AgrA par nitrosylation, et qui limite ainsi l’expression des facteurs de virulence et la réaction inflammatoire délétère. Le NO est donc un facteur de l’équilibre de la relation commensale entre l’hôte et Staphylococcus aureus. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




