| Issue |
Med Sci (Paris)
Volume 36, Number 2, Février 2020
|
|
|---|---|---|
| Page(s) | 112 - 115 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/2020006 | |
| Published online | 04 March 2020 | |
Une nouvelle génération d’immunothérapies ciblant la voie CD39/CD73/adénosine pour favoriser la réponse immunitaire anti-tumorale
A new generation of immunotherapies targeting the CD39/CD73/adenosine pathway to promote the anti-tumor immune response
1
Institut de recherche en cancérologie de Montpellier, Inserm U1194, université de Montpellier, institut régional du cancer de Montpellier, 34298 Montpellier, France
2
Innate Pharma, 117 avenue de Luminy, 13009 Marseille, France
3
OREGA Biotech, 69130 Ecully, France
4
Inserm UMRS 976, université Paris Diderot, Sorbonne Paris Cité, laboratoire immunologie, dermatologie et oncologie, 75475 Paris, France
5
Département d’immunologie, centre hospitalier régional universitaire de Montpellier et faculté de médecine, université de Montpellier, 34295 Montpellier, France
Le concept d’immunosurveillance et la compréhension des mécanismes par lesquels le système immunitaire peut éradiquer des tumeurs ont conduit au développement de nouvelles formes d’immunothérapie du cancer visant à promouvoir ou rétablir une réponse immunitaire anti-tumorale efficace et durable. Cette idée révolutionnaire de cibler, non plus les cellules tumorales, mais les cellules immunitaires, est à l’origine d’avancées médicales majeures. Des résultats sans précédent ont en effet été obtenus en utilisant des inhibiteurs des points de contrôle du système immunitaire (immune checkpoint inhibitors, ICI) tels que les anticorps anti-PD-1, anti-PD-L1, et anti-CTLA-4, pour traiter des cancers réfractaires aux traitements conventionnels par chimiothérapie, radiothérapie, ou thérapie ciblée, dont le pronostic était jusqu’alors très défavorable [1-3]. Ces nouvelles immunothérapies, utilisées seules ou en combinaison, font désormais partie de l’arsenal thérapeutique contre un grand nombre de cancers, et ont permis d’obtenir des rémissions complètes. Toutefois, les effets bénéfiques durables ne concernent qu’une minorité des patients traités (20 % à 30 % tous cancers confondus), tandis que les autres patients présentent une résistance innée ou acquise aux ICI [4]. La mise au point de traitements combinant immunothérapie et radiothérapie ou chimiothérapie, mais aussi l’identification de nouvelles cibles afin d’améliorer l’efficacité des ICI sont au cœur des nouvelles stratégies thérapeutiques contre le cancer. Dans ce contexte, le ciblage des voies d’immunosuppression du microenvironnement de la tumeur constitue l’un des enjeux. Les résultats de nos récents travaux de recherche, publiés dans Cell Reports [5], fournissent le rationnel scientifique pour le développement clinique de deux anticorps ciblant les protéines CD39 et CD73, et sont en faveur de leur utilisation dans l’immunothérapie des cancers.
CD39, CD73, et adénosine : de nouvelles cibles thérapeutiques contrôlant la réponse immunitaire anti-tumorale
L’adénosine, par ses propriétés immunosuppressives, est un acteur majeur de l’échappement des tumeurs au contrôle par le système immunitaire. Ce nucléoside joue un rôle essentiel dans la migration, la prolifération, et la mort cellulaire [6]. C’est un frein puissant à la réponse immunitaire par sa capacité à inhiber l’activation des cellules dendritiques, la prolifération et l’activation des lymphocytes T effecteurs, l’activation des cellules natural killer (NK), ou au contraire en activant les fonctions suppressives des lymphocytes T régulateurs et des macrophages pro-tumoraux de type M2 [6]. La production d’adénosine dans le microenvironnement tumoral est liée à l’activité de deux ectonucléotidases, CD39 (ectonucléoside triphosphate diphosphohydrolase 1, ENTPD1) et CD73 (ecto-5’-nucléotidase, NTE5). Une augmentation de l’expression de CD39 et CD73 dans le lit tumoral témoigne d’un environnement immunosuppresseur.
CD39, sous forme membranaire ou soluble, hydrolyse l’adénosine triphosphate (ATP) et l’adénosine diphosphate (ADP) en adénosine monophosphate (AMP). L’AMP est converti à son tour en adénosine par CD73. À l’inverse de l’adénosine, l’ATP extracellulaire libéré lors de la mort des cellules tumorales agit comme un signal immunogénique puissant [7]. L’ATP, en se liant aux récepteurs membranaires purinergiques P2X et P2Y, favorise la maturation des cellules dendritiques et l’amorçage (priming) de la réponse anti-tumorale. L’ATP inhibe la prolifération des cellules tumorales et favorise leur mort. Le rapport ATP/adénosine est donc un élément important pour la fonction anti-tumorale du système immunitaire, et les enzymes CD39 et CD73 apparaissent comme des enzymes clefs, dont l’activité séquentielle contrôle la concentration d’ATP (immunostimulatrice) et d’adénosine (immunosuppressive) [8] (Figure 1). Confortant l’hypothèse du rôle de CD39 et CD73 dans le contrôle de la réponse immunitaire anti-tumorale, plusieurs études montrent que les souris déficientes en CD39 ou CD73 ont moins de métastases et une croissance de tumeurs syngéniques transplantées diminuée [9-11]. Par ailleurs, le blocage de l’activité de l’une ou l’autre de ces ectonucléotidases par des inhibiteurs chimiques ou des anticorps monoclonaux a produit des effets encourageants dans des études pré-cliniques [12-14].
 |
Figure 1. La voie ATP/AMP/adénosine. Les exoenzymes CD39 et CD73 favorisent l’accumulation d’adénosine dans le microenviro nnement tumoral et inhibent les réponses anti-tumorales. CD39 et CD73 sont exprimées par certaines cellules immunes infiltrant la tumeur et par les cellules tumorales elles-mêmes. Elles transforment l’ATP extracellulaire, relargué par les cellules tumorales mourantes, en AMP, puis en adénosine. L’adénosine, en se fixant sur les récepteurs A2A et A2B, inhibe les fonctions effectrices des lymphocytes T CD8+ et des cellules NK. La diminution de la quantité d’ATP, quant à elle, diminue l’activation des cellules dendritiques via les récepteurs P2X. Ces deux actions concomitantes favorisent la prolifération et la dissémination des cellules tumorales. |
Neutralisation de l’activité ATPasique de CD39 : impact sur l’efficacité des thérapies anti-tumorales
En utilisant trois modèles murins (mélanome B16F10, fibrosarcome MCA205, et adénocarcinome colorectal MC38), nous avons montré que l’invalidation du gène codant CD39 chez la souris est associée à une augmentation des fonctions effectrices des lymphocytes T CD8+ et CD4+ infiltrant la tumeur et à un retard de la progression tumorale. Cependant, l’invalidation du gène codant CD39 ne permet à elle seule la régression complète des tumeurs dans aucun de ces trois modèles. En revanche, elle potentialise le taux de réponse favorable aux ICI anti-PD-1 et anti-CTLA-4, et permet une rémission complète (élimination des tumeurs) et durable chez 20 % des animaux traités par un anticorps anti-PD-1 dans le modèle de mélanome B16F10, particulièrement résistant à ces immunothérapies. Dans le modèle de fibrosarcome MCA205, le traitement de souris déficientes en CD39 par l’anticorps anti-PD-1 seul retarde légèrement la croissance tumorale, mais n’induit pas de rémission complète. Cependant, dans ce modèle, le taux de rémission complète obtenu avec la combinaison de l’oxaliplatine et de l’anticorps anti-PD-1 passe de 65 % chez les souris témoins à plus de 90 % chez les souris déficientes en CD39. Cet effet est strictement dépendant des lymphocytes T CD8+ et CD4+, et est associé au développement d’une mémoire immunitaire protectrice. Ces résultats montrent que la neutralisation de l’activité ATPasique de CD39 chez la souris potentialise l’efficacité des traitements anti-cancéreux utilisant des ICI combinés ou non à une chimiothérapie, et augmente significativement les taux de réponse complète et de survie. Ils ouvrent ainsi des perspectives pour de nouvelles approches de thérapies combinées.
Inhibition de CD39 et de CD73 : redondance ou synergie ?
Le développement concomitant d’anticorps bloquant CD39 (IPH5201) ou CD73 (IPH5301) nous a permis d’aborder cette question pour la première fois. L’anticorps IPH5201 inhibe l’activité enzymatique de CD39 membranaire et soluble, et bloque efficacement l’hydrolyse de l’ATP extracellulaire. Son utilisation augmente le taux de réponse à l’oxaliplatine des souris porteuses du fibrosarcome MCA205 et invalidées pour le gène codant CD39 mais exprimant la protéine CD39 humaine, alors que son utilisation en monothérapie n’affecte pas la croissance tumorale chez ces souris.
L’anticorps IPH5301 bloque la dégradation de l’AMP en adénosine par CD73, et son affinité pour cette enzyme est similaire à celle de deux anticorps de référence, MEDI9447 et CD73.4, actuellement en cours d’essais cliniques de phase Ib/II et I/IIa. Cependant, IPH5301 est plus efficace pour bloquer l’activité enzymatique de CD73 sous forme membranaire ou soluble et pour restaurer la prolifération des lymphocytes T in vitro.
Ces anticorps IPH5201 et IPH5301, lorsqu’ils sont utilisés seuls, bloquent efficacement la production d’adénosine et restaurent in vitro la prolifération des lymphocytes du sang périphérique de sujets sains ou de patientes atteintes d’un cancer du sein, dans un milieu riche en ATP. Remarquablement, dans les mêmes expériences in vitro, lorsqu’ils sont utilisés ensemble à des doses qui étaient insuffisantes pour restaurer la prolifération des lymphocytes quand ils étaient utilisés seuls, IPH5201 et IPH5301 agissent en synergie pour supprimer l’effet suppressif lié à la dégradation de l’ATP en adénosine et pour favoriser la prolifération des lymphocytes T. Ainsi, les blocages de l’activité enzymatique de CD39 et CD73 n’apparaissent pas redondants, mais synergiques pour limiter l’inhibition des lymphocytes T dépendante de l’adénosine et améliorer ainsi l’immunité anti-tumorale (Figure 2).
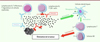 |
Figure 2. Mécanisme d’action des anticorps IPH5201 et IPH5301. Les anticorps IPH5201 et IPH5301 bloquent respectivement l’activité enzymatique de CD39 et celle de CD73, donc l’hydrolyse de l’ATP et de l’AMP extracellulaire. Ces deux actions conjointes permettent, d’une part de limiter la production d’adénosine et ainsi l’inhibition des cellules immunes exprimant les récepteurs de l’adénosine (récepteurs A2A, A2B), et, d’autre part, de potentialiser l’activation des cellules dendritiques via les récepteurs P2X. L’activation optimale des cellules immunes infiltrant la tumeur permet la mise en place de réponses anti-tumorales efficaces et l’élimination de la tumeur. |
Liens d’intérêt
AB, JFE, JB et NB sont actionnaires et/ou salariés d'Orega Biotech et inventeurs de brevets couvrant des anticorps anti-CD39. CP et IP sont salariés d'Innate Pharma et inventeurs de brevets couvrant des anticorps anti-CD39 ou anti-CD37. LG déclare n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Hodi FS, O’Day SJ, McDermott DF, et al. Improved survival with ipilimumab in patients with metastatic melanoma. N Engl J Med 2010 ; 363 : 711–723. [Google Scholar]
- Topalian SL, Hodi FS, Brahmer JR, et al. Safety, activity, and immune correlates of anti-PD-1 antibody in cancer. N Engl J Med 2012 ; 366 : 2443–2454. [Google Scholar]
- Brahmer JR, Tykodi SS, Chow LQ, et al. Safety and activity of anti-PD-L1 antibody in patients with advanced cancer. N Engl J Med 2012 ; 366 : 2455–2465. [Google Scholar]
- Jenkins RW, Barbie DA, Flaherty KT. Mechanisms of resistance to immune checkpoint inhibitors. Br J Cancer 2018 ; 118 : 9–16. [CrossRef] [PubMed] [Google Scholar]
- Perrot I, Michaud HA, Giraudon-Paoli M, et al. Blocking antibodies targeting the CD39/CD73 immunosuppressive pathway unleash immune responses in combination cancer therapies. Cell Rep 2019 ; 27 : 2411–25 e9. [Google Scholar]
- de Andrade Mello P, Coutinho-Silva R, Savio LEB. Multifaceted effects of extracellular adenosine triphosphate and adenosine in the tumor-host interaction and therapeutic perspectives. Front Immunol 2017; 8 : 1526. [CrossRef] [PubMed] [Google Scholar]
- Silva-Vilches C, Ring S, Mahnke K. ATP and its metabolite adenosine as regulators of dendritic cell activity. Front Immunol 2018 ; 9 : 2581. [CrossRef] [PubMed] [Google Scholar]
- Bastid J, Regairaz A, Bonnefoy N, et al. Inhibition of CD39 enzymatic function at the surface of tumor cells alleviates their immunosuppressive activity. Cancer Immunol Res 2015 ; 3 : 254–265. [CrossRef] [PubMed] [Google Scholar]
- Sun X, Wu Y, Gao W, et al. CD39/ENTPD1 expression by CD4+ Foxp3+ regulatory T cells promotes hepatic metastatic tumor growth in mice. Gastroenterol 2010 ; 139 : 1030–1040. [CrossRef] [Google Scholar]
- Stagg J, Divisekera U, Duret H, et al. CD73-deficient mice have increased antitumor immunity and are resistant to experimental metastasis. Cancer Res 2011 ; 71 : 2892–2900. [Google Scholar]
- Stagg J, Beavis PA, Divisekera U, et al. CD73-deficient mice are resistant to carcinogenesis. Cancer Res 2012 ; 72 : 2190–2196. [Google Scholar]
- Antonioli L, Yegutkin GG, Pacher P, et al. Anti-CD73 in cancer immunotherapy: awakening new opportunities. Trends Cancer 2016 ; 2 : 95–109. [CrossRef] [PubMed] [Google Scholar]
- Antonioli L, Novitskiy SV, Sachsenmeier KF, et al. Switching off CD73: a way to boost the activity of conventional and targeted antineoplastic therapies. Drug Discov Today 2017 ; 22 : 1686–1696. [CrossRef] [PubMed] [Google Scholar]
- Nikolova M, Carriere M, Jenabian MA, et al. CD39/adenosine pathway is involved in AIDS progression. PLoS Pathog 2011 ; 7 : e1002110. [CrossRef] [PubMed] [Google Scholar]
© 2020 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (https://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l'utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. La voie ATP/AMP/adénosine. Les exoenzymes CD39 et CD73 favorisent l’accumulation d’adénosine dans le microenviro nnement tumoral et inhibent les réponses anti-tumorales. CD39 et CD73 sont exprimées par certaines cellules immunes infiltrant la tumeur et par les cellules tumorales elles-mêmes. Elles transforment l’ATP extracellulaire, relargué par les cellules tumorales mourantes, en AMP, puis en adénosine. L’adénosine, en se fixant sur les récepteurs A2A et A2B, inhibe les fonctions effectrices des lymphocytes T CD8+ et des cellules NK. La diminution de la quantité d’ATP, quant à elle, diminue l’activation des cellules dendritiques via les récepteurs P2X. Ces deux actions concomitantes favorisent la prolifération et la dissémination des cellules tumorales. |
| Dans le texte | |
 |
Figure 2. Mécanisme d’action des anticorps IPH5201 et IPH5301. Les anticorps IPH5201 et IPH5301 bloquent respectivement l’activité enzymatique de CD39 et celle de CD73, donc l’hydrolyse de l’ATP et de l’AMP extracellulaire. Ces deux actions conjointes permettent, d’une part de limiter la production d’adénosine et ainsi l’inhibition des cellules immunes exprimant les récepteurs de l’adénosine (récepteurs A2A, A2B), et, d’autre part, de potentialiser l’activation des cellules dendritiques via les récepteurs P2X. L’activation optimale des cellules immunes infiltrant la tumeur permet la mise en place de réponses anti-tumorales efficaces et l’élimination de la tumeur. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




