Figure 1.
Télécharger l'image originale
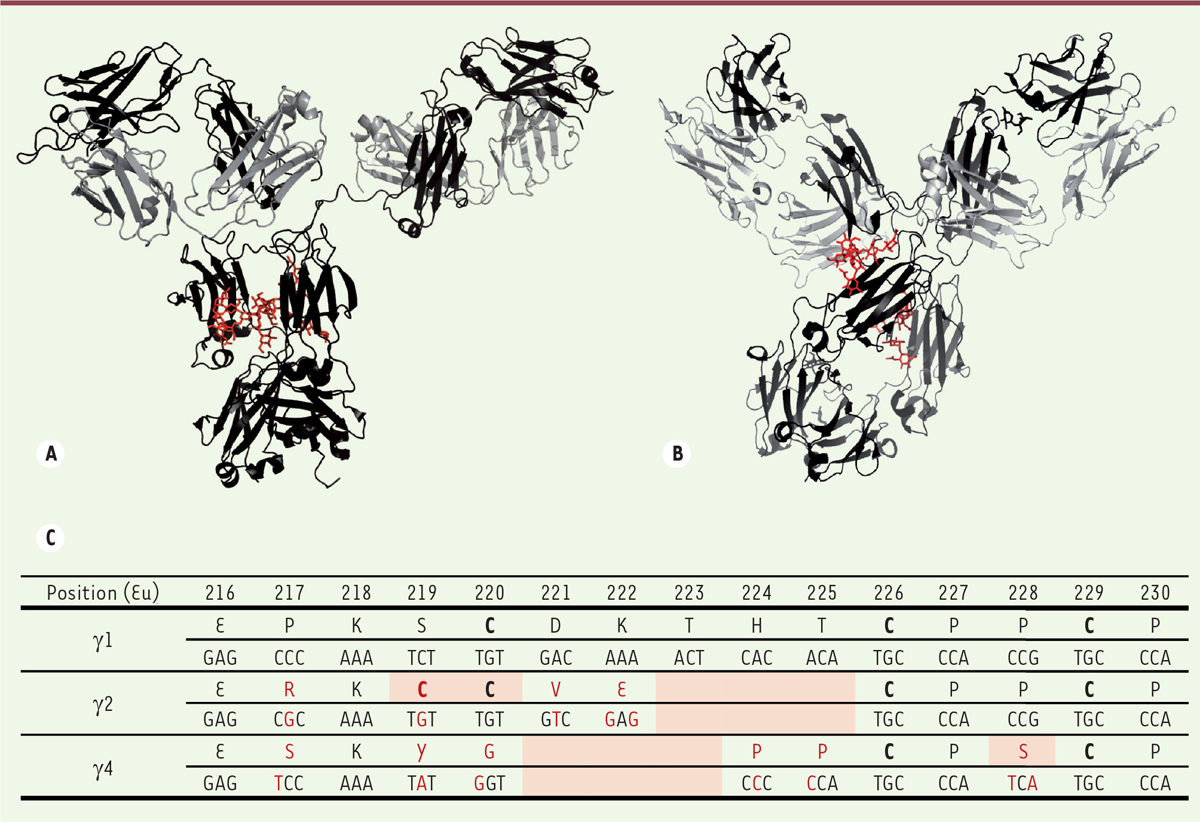
Différences entre sous-classes d’IgG humaines au niveau de la région charnière. A et B. Structure d’une IgG1 (A) et d’une IgG4 (B), les deux seules sous-classes d’IgG humaines ayant été cristallisées dans leur intégralité. Les chaînes lourdes sont en noir, les chaînes légères en gris ; les N-glycanes de la région Fc sont indiqués en rouge. Les figures ont été réalisées en utilisant PyMOL Molecular Graphics System, version 1.7.4 (Schrödinger) à partir du fichier PDB 1HZH représentant l’unique IgG1 humaine cristallisée, nommée B12 et dirigée contre la gp120 du VIH (virus de l’immunodéficience humaine) et à partir du fichier PDB 5DK3 représentant le pembrolizumab, l’unique IgG4 humaine cristallisée (variant G4e1). La grande flexibilité de la région charnière des IgG1 donne de la liberté aux bras Fab et provoque une forte asymétrie. Il n’existe malheureusement pas de structure d’une IgG2 humaine entière. C. Alignement de la région charnière des chaînes lourdes g 1, g 2 et g 4 humaines. Les acides aminés (selon la numérotation EU) et les nucléotides qui diffèrent de la séquence des IgG1 sont indiqués en rouge. Les cystéines engagées dans des ponts disulfures sont indiquées en gras. Les différences notables apparaissent en fond orangé: délétion de 3 acides aminés dans l’IgG2 et l’IgG4, cystéines 219 et 220 de l’IgG2, et sérine 228 de l’IgG4 (voir texte).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




