| Issue |
Med Sci (Paris)
Volume 34, Number 6-7, Juin–Juillet 2018
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 527 - 529 | |
| Section | Le Magazine | |
| DOI | https://doi.org/10.1051/medsci/20183406011 | |
| Published online | 31 July 2018 | |
Microbiote et microglie : des interactions prénatales et postnatales distinctes selon l’identité sexuelle
Microbiome and microglia: prenatal and postnatal interactions diverge according to sex
Institut de Biologie de l’École Normale Supérieure (IBENS), École Normale Supérieure, CNRS, Inserm, PSL université Paris, 75005 Paris, France
Les cellules microgliales, qui sont les macrophages résidents du système nerveux central (SNC), constituent la première ligne de défense immunitaire face aux traumatismes ou infections. Contrairement aux neurones et autres cellules gliales, les cellules microgliales dérivent de précurseurs présents dans le sac vitellin, colonisent le SNC pendant la vie embryonnaire et s’auto-renouvellent ensuite tout au long de la vie [1] (→).
(→) Voir la Synthèse de P. Legendre et H. Le Corronc, m/s n° 2, février 2014, page 147
Ces cellules immunitaires ont été impliquées dans de multiples processus physiologiques dans le cerveau en développement et mature, comme la synaptogenèse, la transmission synaptique ou l’élimination de débris cellulaires et extracellulaires [2, 3]. En outre, des dysfonctionnements microgliaux ont été associés à un large spectre de pathologies neurologiques, neurodégénératives, mais également à certains troubles neurodéveloppementaux, qui ont une incidence plus forte chez les hommes que chez les femmes [4, 5]. En lien avec leur fonction de sentinelles immunitaires, les cellules microgliales assurent, chez l’adulte, une surveillance constante de leur environnement. Elles détectent des signaux extracellulaires, notamment ceux qui sont produits par les autres cellules du système immunitaire, et mettent en place des réponses spécifiques adaptées. Les cellules microgliales sont ainsi capables de répondre à une batterie de signaux environnementaux, comme ceux provenant du microbiote, l’ensemble des micro-organismes présents dans le corps [6]. Chez l’adulte, ces cellules constituent donc une interface clé entre le cerveau et l’environnement. Si les cellules microgliales colonisent le cerveau à des phases précoces de l’embryogenèse, on connaît encore mal leur cinétique de différenciation ainsi que leur capacité à répondre in utero à des signaux environnementaux. Dans l’étude que nous avons réalisée en collaboration avec l’équipe de F. Ginhoux (Agency for science, technology, and research - A*STAR- Singapore immunology network – SigN - Singapour), nous avons exploré, chez la souris, les différentes étapes de développement microglial ainsi que les relations entre microbiote maternel et cellules microgliales durant la gestation. Nous avons montré l’existence de réponses microgliales aux différents stades pré et postnataux qui, de manière remarquable, différaient selon le sexe de la progéniture [7].
Acquisition tardive d’un dimorphisme sexuel
En réalisant des analyses transcriptomiques sur des cellules microgliales purifiées chez la souris, combinées à des analyses histologiques et fonctionnelles, nous avons pu montrer, en accord avec une étude récente [8], l’existence d’une maturation dynamique de la microglie en trois étapes clés du développement embryonnaire (Figure 1). L’utilisation de mutants conditionnels nous a conduites à l’identification de CXCR4 (CXC chemokine receptor 4) comme étant un facteur essentiel de la colonisation microgliale des zones prolifératives du cortex cérébral embryonnaire. Les cellules microgliales embryonnaires expriment, dès les stades précoces de développement, certains des gènes qui leur permettent de percevoir leur environnement, appelés collectivement chez l’adulte, le « sensome » [9]. Alors que ce développement microglial est très similaire chez les embryons de souris mâles et femelles durant les stades embryonnaires, il diverge à l’âge adulte : les cellules de souris femelles apparaissent dans un état immunitaire plus actif, ce qui est en accord avec des études récentes montrant que les réponses immunitaires innées et acquises sont plus importantes chez les femmes que les hommes [10].
 |
Figure 1. Étapes de différenciation des cellules microgliales. L’analyse du transcriptome des cellules microgliales a révélé trois étapes clés de développement embryonnaire. |
En analysant des cellules microgliales fœtales humaines, nous avons observé que certains mécanismes développementaux étaient conservés entre la souris et l’homme, notamment l’absence de dimorphisme sexuel in utero et l’expression de certains gènes du « sensome ». Des phases développementales spécifiques, ainsi qu’un dimorphisme sexuel apparaissent donc au cours du développement postnatal.
Le microbiote maternel influence le développement microglial embryonnaire
L’un des signaux environnementaux qui influence les cellules microgliales adultes a pour origine le microbiote, qui a récemment émergé comme un régulateur clé des fonctions cérébrales [6]. Nous avons donc examiné si le microbiote maternel pouvait, au cours de la gestation, dialoguer avec les cellules microgliales des embryons, qui se développent dans un environnement considéré comme stérile. Pour répondre à cette question, nous avons réalisé des analyses transcriptomiques (microarrays 1 et RNA-seq) et d’accessibilité de la chromatine (ATAC-seq2) combinées à des analyses histologiques, sur des cellules de la microglie purifiées à partir d’embryons de souris axéniques (ou « germ-free », dépourvues de microbiote) ou de souris contrôles.
Quatre jours après le début de leur colonisation cérébrale, l’expression par les cellules microgliales de gènes impliqués dans la réponse aux infections, tels que Aoah (acyloxyacyl hydrolase) et Ly86 (lymphocyte antigen 86), est altérée chez les embryons provenant de souris germ-free, suggérant que le microbiote de la mère régule l’expression de gènes microgliaux permettant sa détection, et contrôlant les réponses à l’inflammation qu’il induit. L’absence de microbiote maternel est également associée à une augmentation de la densité microgliale dans différentes régions du cerveau des embryons (cortex cérébral, striatum, région préoptique ; Figure 2). En fin de gestation, le transcriptome des cellules microgliales des souris mâles est fortement altéré chez les animaux nés de mères germ-free, notamment les gènes impliqués dans les processus métaboliques et la réponse immunitaire. Le microbiote maternel participerait ainsi à la maturation des cellules microgliales embryonnaires en dialoguant avec les cellules immunitaires in utero.
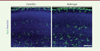 |
Figure 2. L’absence du microbiote maternel régule la densité corticale de la microglie chez les embryons mâles. Les cellules microgliales sont visualisées par un marquage détectant Iba1 (Ionized calcium-binding adaptor molecule 1) sur une coupe coronale dans le cortex somatosensoriel des embryons mâles à E18,5 (18,5 jours de développement embryonnaire) (barre d’échelle = 100 µm). |
Les réponses microgliales à des perturbations du microbiote sont divergentes selon l’identité sexuelle
L’absence permanente de microbiote chez les souris axéniques a des effets divergents sur les cellules microgliales selon leurs identités sexuelles : chez les souris mâles, elles sont affectées durant la vie in utero, alors que chez les femelles, elles sont sévèrement perturbées au stade adulte. Ainsi, microglies chez les femelles et les mâles présentent des fenêtres temporelles de susceptibilité différentes à l’absence permanente de microbiote. Chez l’adulte, les cellules de souris femelles présentent une dérégulation des gènes impliqués dans la morphogenèse cellulaire, la régulation de la transcription et les réponses immunitaires. Ces effets sexuellement dimorphiques ont été observés au niveau transcriptionnel, mais aussi au niveau de l’accessibilité de la chromatine, et de la densité microgliale dans le cortex cérébral (Figure 2). Un traitement avec un cocktail d’antibiotiques, qui détruit de façon aiguë le microbiote, entraîne, chez les souris adultes, une réponse sexuellement dimorphique : les cellules microgliales chez les femelles modulent l’expression de gènes régulateurs de la transcription, tandis que chez les mâles, elles présentent une réponse immunitaire altérée. Cependant, les réponses microgliales au traitement antibiotique sont plus atténuées que chez les souris axéniques, démontrant que les défauts décrits chez ces dernières résultent d’une absence prolongée de microbiote.
Fenêtres de susceptibilité et troubles neurodéveloppementaux
Si les mécanismes impliqués et les conséquences fonctionnelles restent à découvrir, cette étude révèle un rôle charnière des cellules microgliales à l’interface entre environnement et cerveau. Elle montre également que mâles et femelles auraient des susceptibilités différentes à des altérations environnementales, comme celles du microbiote. Cette observation est importante si l’on considère que la prévalence de certaines maladies neurodéveloppementales associées à des perturbations microgliales est plus importante chez les hommes que chez les femmes [4, 5, 11, 12]. Inversement, des pathologies associées à des dysfonctionnements microgliaux chez l’adulte, comme les maladies auto-immunes et la sclérose en plaque, ont une incidence prépondérante chez les femmes [11, 12].
Ces travaux suggèrent que les cellules microgliales, qui sont des cellules essentielles dans le développement et la plasticité des circuits cérébraux, ainsi que dans de nombreux processus pathologiques, se situent à une interface clé entre l’environnement et le cerveau et ce, dès la vie fœtale. Ce rôle de médiateur diffère selon l’âge et l’identité sexuelle, ce qui place ces cellules fascinantes à une position clé pour relayer de manière dimorphique l’impact de modifications environnementales. Nos travaux révèlent également l’importance de prendre en considération le sexe de l’individu dans toutes les études précliniques et cliniques, dès les stades embryonnaires.
Liens d’intérêt
Les auteures déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Remerciements
Les travaux ont été financés par l’Inserm, le CNRS, l’ENS, le Labex Memolife et le contrat ERC NImO Consolidator 616080.
Références
- Legendre P, Le Corronc H. Cellules microgliales et développement du système nerveux central chez l’embryon. Med Sci (Paris) 2014 ; 30 : 147–152. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Thion MS, Garel S. On place and time: microglia in embryonic and perinatal brain development. Curr Opin Neurobiol 2017; 47 : 121–130. [CrossRef] [PubMed] [Google Scholar]
- Casano AM, Peri F. Microglia: multitasking specialists of the brain. Dev Cell 2015; 32 : 469–477. [CrossRef] [PubMed] [Google Scholar]
- Halladay AK, Bishop S, Constantino JN, et al. Sex and gender differences in autism spectrum disorder: summarizing evidence gaps and identifying emerging areas of priority. Mol Autism 2015; 6 : 36. [CrossRef] [PubMed] [Google Scholar]
- Ochoa S, Usall J, Cobo J, et al. Gender differences in schizophrenia and first-episode psychosis: a comprehensive literature review. Schizophr Res Treatment 2012; 2012 : 916198. [PubMed] [Google Scholar]
- Erny D, Hrabe de Angelis AL, Jaitin D, et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci 2015; 18 : 965–977. [CrossRef] [PubMed] [Google Scholar]
- Thion MS, Low D, Silvin A, et al. Microbiome influences prenatal and adult microglia in a sex-specific manner. Cell 2018; 172 : 500–516 e16. [CrossRef] [PubMed] [Google Scholar]
- Matcovitch-Natan O, Winter DR, Giladi A, et al. Microglia development follows a stepwise program to regulate brain homeostasis. Science 2016; 353 : aad8670. [Google Scholar]
- Hickman SE, Kingery ND, Ohsumi TK, et al. The microglial sensome revealed by direct RNA sequencing. Nat Neurosci 2013; 16 : 1896–1905. [CrossRef] [PubMed] [Google Scholar]
- Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016; 16 : 626–638. [CrossRef] [PubMed] [Google Scholar]
- Ngo ST, Steyn FJ, McCombe PA. Gender differences in autoimmune disease. Front Neuroendocrinol 2014; 35 : 347–369. [CrossRef] [PubMed] [Google Scholar]
- Zagni E, Simoni L, Colombo D. Sex and gender differences in central nervous system-related disorders. Neurosci J 2016 ; 2016 : 2827090. [CrossRef] [PubMed] [Google Scholar]
© 2018 médecine/sciences – Inserm
 Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Article publié sous les conditions définies par la licence Creative Commons Attribution License CC-BY (http://creativecommons.org/licenses/by/4.0), qui autorise sans restrictions l’utilisation, la diffusion, et la reproduction sur quelque support que ce soit, sous réserve de citation correcte de la publication originale.
Liste des figures
 |
Figure 1. Étapes de différenciation des cellules microgliales. L’analyse du transcriptome des cellules microgliales a révélé trois étapes clés de développement embryonnaire. |
| Dans le texte | |
 |
Figure 2. L’absence du microbiote maternel régule la densité corticale de la microglie chez les embryons mâles. Les cellules microgliales sont visualisées par un marquage détectant Iba1 (Ionized calcium-binding adaptor molecule 1) sur une coupe coronale dans le cortex somatosensoriel des embryons mâles à E18,5 (18,5 jours de développement embryonnaire) (barre d’échelle = 100 µm). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




