Figure 2.
Télécharger l'image originale
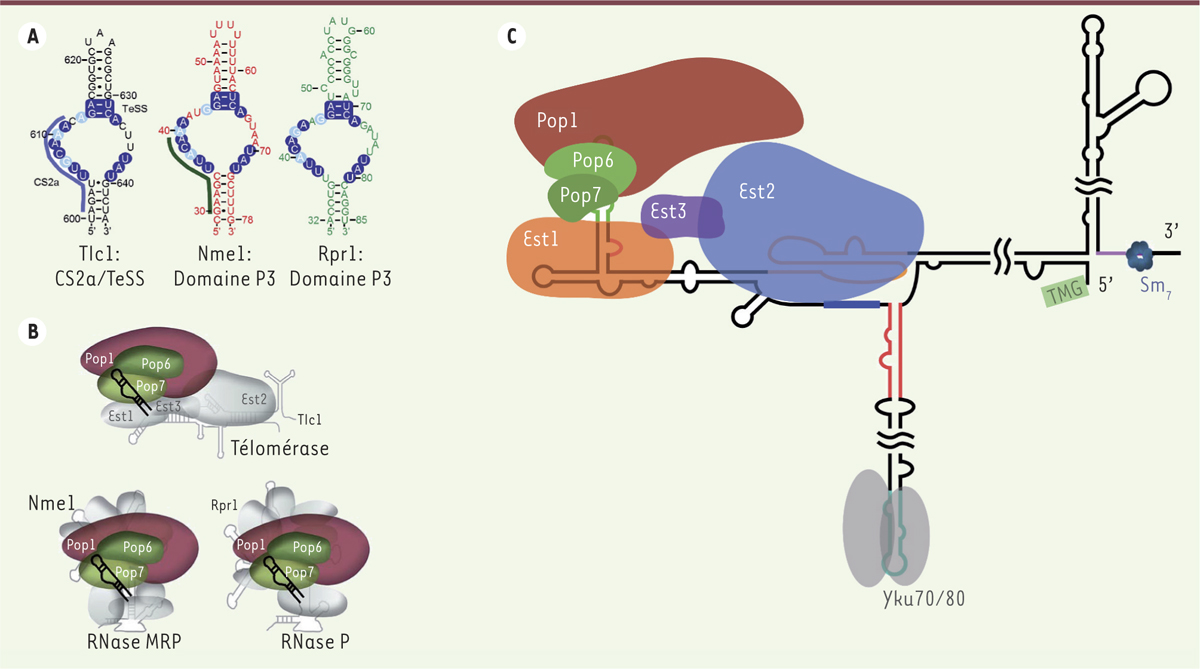
Le domaine P3 de Tlc1 possède les mêmes fonctions que celui des ARN Nme1 et Rpr1 des ribonucléases MRP/P : il lie l’hétérodimère Pop6/Pop7 pour ensuite recruter la protéine Pop1. A. Représentation de la portion distale de la tige IVc : le domaine TeSS (telomerase-stimulating structure) et la séquence CS2a (conserved sequence 2a) possèdent de fortes ressemblances avec les domaines P3 des ARN Nme1 et Rpr1. Les nucléotides (nt) identiques sont encerclés en bleu foncé. Les purines et pyrimidines conservées sont encerclées en bleu pâle. Le trait bleu à gauche de Tlc1 représente la portion essentielle à l’activité de la télomérase, l’élément CS2a. Le trait vert foncé à gauche de Nme1 représente les nucléotides protégés par la liaison de Pop6/Pop7. B. Les ARN de la télomérase (Tlc1), la ribonucléase (RNase) MRP (Nme1) et la RNase P (Rpr1) ont un élément commun : le domaine P3. Celui-ci est parfaitement interchangeable entre les trois ARN. C. Nouveau modèle de la télomérase chez la levure Saccharomyces cerevisiae. Le domaine P3 de Tlc1 recrute l’hétérodimère Pop6/Pop7. La protéine Pop1 se lie, par la suite, pour stabiliser le complexe de la télomérase formé des protéines Est1 (ever shorter telomere 1), Est2 et Est3.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




