| Issue |
Med Sci (Paris)
Volume 33, Novembre 2017
Les Cahiers de Myologie
|
|
|---|---|---|
| Page(s) | 63 - 66 | |
| Section | Infos | |
| DOI | https://doi.org/10.1051/medsci/201733s115 | |
| Published online | 15 November 2017 | |
Prix Master 2016 de la SFM
Domaine nucléaire et protéome microtubulaire au cours de la maturation des fibres musculaires
Myonuclear domain and microtubule proteome during skeletal muscle maturation
Institut NeuroMyogène- CNRS UMR 5310 - Inserm U1217 - Université de Lyon, Lyon, France
Au cours du développement musculaire, les noyaux se positionnent activement le long des fibres musculaires, façonnant les Domaines Nucléaires (DN). Ce positionnement semble essentiel à la fonctionnalité des fibres car des défauts d’établissement des DN sont toujours associés à des dysfonctionnements musculaires. Des études montrent que le positionnement nucléaire est dynamique, suggérant que, dans des pathologies présentant des délocalisations nucléaires, relocaliser les noyaux pourrait restaurer certaines fonctionnalités musculaires. Les microtubules sont essentiels au positionnement précoce des noyaux dans les fibres musculaires. Le réseau microtubulaire étant totalement remodelé pendant la maturation musculaire, nous avons émis l’hypothèse selon laquelle les « protéomes associés aux microtubules » évoluent au cours de la maturation des fibres, ce qui contribue à la formation et au maintien des DN dans les fibres matures. Nous avons mené une approche biochimique in vitro afin d’isoler les protéines associées aux microtubules dans des fibres immatures et matures. L’identification des protéines par spectrométrie de masse a permis la sélection de candidats, associés/exprimés de façon différentielle aux microtubules pendant la maturation des fibres et potentiellement impliqués dans le contrôle des DN. Nous déchiffrons actuellement, via un criblage siARN, l’implication respective de ces candidats sur les différentes phases d’établissement des DN en utilisant une méthode non biaisée d’analyse statistique des DN dans les myotubes, en fonction de leur contenu en noyaux. Cette approche conduira à l’identification de nouvelles voies liées à la mise en place des DN et permettra d’identifier des candidats sur lesquels agir dans des pathologies associées de type myopathies centronucléaires (CNM).
Abstract
In the normal course of muscle fiber development, myonuclei actively position and adapt a precise localization in mature fibers, shaping MyoNuclear Domains (MNDs). Myonuclei positioning in fibers appears to be essential for muscle function as defects in MNDs settings are always associated with dysfunction (i.e., centronuclear myopathy, sarcopenia). Previous studies have shown that myonuclei positioning in fibers is reversible, suggesting that in pathologies presenting MNDs impairment, myonuclei could be re-addressed to the “correct” position in fibers and this could benefit to muscle function. Cytoskeleton networks, and particularly microtubules, have been implicated in early nuclei localization in myotubes. As the microtubule network is completely redesigned during muscle maturation, we hypothesized that “microtubules associated proteomes” would change between immature and mature fibers and contribute to a microtubule-dependent process resulting in MNDs setting and maintenance in mature fibers. We performed an in vitro biochemical approach to isolate microtubules partners in immature (myotubes) and mature myofibers. Using mass-spectrometry identification, we selected 244 candidates, differentially associated/expressed with microtubules during myofiber maturation and potentially controlling MNDs settings. We are currently conducting a siRNA screen approach on these candidates to decipher their respective implication in early and late phases of MNDs establishment, using an unbiased assay developed by our team allowing statistical analysis of MNDs regarding myonuclei content. This approach will lead to the identification of new pathways related to nuclear positioning and MNDs setting in normal condition and in myopathies associated to MNDs impairment such as CNMs.
© 2017 médecine/sciences – Inserm
Contexte et hypothèse
Les fibres musculaires composent le muscle strié squelettique et proviennent de la fusion de cellules spécialisées : les myoblastes. Ces cellules ont la capacité de fusionner entre-elles par milliers afin de former un syncytium : le myotube [1]. Ces myotubes sont des fibres musculaires encore immatures et devront subir différentes étapes de maturation pour permettre leur bon fonctionnement : la formation de l’appareil contractile (agencement entre les réseaux d’actine et de myosine à la base des sarcomères), la mise en place du réseau de réticulum sarcoplasmique (réserves calciques) ou bien encore l’établissement d’un contact efficace entre la fibre et le motoneurone à la jonction neuromusculaire (permettant une réponse adéquate de la fibre musculaire suite à l’excitation par le motoneurone). Les noyaux qui composent les fibres musculaires suivent aussi un processus de maturation vis-à-vis de leur conformation propre mais aussi de leur positionnement le long de la fibre. Les étapes précoces de positionnement des noyaux le long des myotubes commencent à être mieux comprises et passent par des mouvements nucléaires contrôlés par différents acteurs clefs du cytosquelette tels que les microtubules, les moteurs moléculaires ainsi que certaines protéines associées aux microtubules (microtubule associated proteins). Par exemple, après l’événement de fusion entre myoblastes, les noyaux vont rapidement se positionner au centre du myotube via un mécanisme dynéine-dépendant [2]. Les noyaux s’alignent et s’espacent les uns des autres pour se répartir régulièrement au centre des myotubes en formation grâce à une interaction entre MAP7 et Kif5B [3]. Cependant, ce mécanisme semble beaucoup plus complexe qu’il n’y paraît, avec l’implication d’au moins 17 autres kinésines dans ce processus combinant mouvement nucléaire et alignement précoce des noyaux [4]. Les étapes finales de maturation positionnelle des noyaux telles que la « périphérisation », leur espacement et leur maintien à la périphérie restent encore à identifier. Les réseaux de cytosquelette d’actine et de microtubules sont totalement remodelés durant la maturation des fibres musculaires avec une forte accumulation péri-nucléaire observée en comparaison à leur organisation dans des cellules mononuclées. Récemment, ces réseaux cytosquelettiques ont été mis en évidence comme un potentiel support à la « périphérisation » des noyaux [5].
Les conséquences fonctionnelles d‘une mauvaise localisation des noyaux sur les fibres ont longtemps suscité des interrogations. Une désorganisation du positionnement nucléaire, que ce soit en termes d’espacement ou de « périphérisation », est toujours associée à un dysfonctionnement de la fibre musculaire [3]. Particulièrement, dans certaines conditions pathologiques, telles que dans les CNM où les noyaux perdent (ou n’acquièrent pas) cette localisation périphérique et se concentrent au centre des fibres musculaires [6]. Des études ont montré que l’altération de la localisation des noyaux dans les fibres musculaires influençait négativement la fonctionnalité de ces fibres [3]. Par conséquent, la maturation positionnelle des noyaux au cours de la formation des fibres musculaires est essentielle pour obtenir une fibre musculaire mature fonctionnelle. Ces données suggèrent un effet bénéfique de la restauration positionnelle des noyaux dans les fibres musculaires dans les pathologies associées.
Identification de nouveaux régulateurs du positionnement nucléaire
Mon travail de thèse consiste à comprendre l’influence des protéines associées au réseau microtubulaire sur le positionnement nucléaire dans les fibres musculaires au cours du développement et de la maturation de ces fibres. Particulièrement, nous recherchons des protéines spécifiquement associées au réseau microtubulaire dans les fibres matures contrôlant la mise en place tardive des noyaux dans les fibres musculaires. Pour ce faire, nous avons développé une stratégie d’identification protéomique différentielle entre des fibres musculaires immatures et matures grâce à une méthode originale de culture in vitro de cellules primaires de souris (Figure 1A) [5]. Cette analyse nous a permis d’identifier et de sélectionner un premier groupe de protéines (249) (Figure 1B). Cette approche globale a été complétée par une approche ciblée sur le protéome spécifiquement associé au réseau microtubulaire en utilisant deux stratégies complémentaires (Figure 1C). La première repose sur la purification des microtubules avec leurs protéines associées par centrifugation sur coussin de glycérol après addition dans l’extrait cytoplasmique de Taxol® afin de stabiliser le réseau microtubulaire au cours de sa formation. La deuxième approche consiste en un enrichissement microtubulaire par ajout préalable de microtubules stabilisés à l’aide du Taxol® dans l’extrait cytoplasmique. Les microtubules et protéines associées purifiés par ces deux approches ont ensuite été analysés par spectrométrie de masse. Nous avons par la suite classé les protéines en trois grandes catégories : spécifiquement exprimées dans les étapes précoces de différenciation des myotubes (3 jours de différenciation, immatures), spécifiques d’un stade de différenciation tardif (11 jours de différenciation des fibres, matures) et une dernière catégorie regroupant les protéines exprimées de façon non spécifique aux deux stades de maturation des fibres. Ce classement nous a permis de sélectionner 244 protéines d’intérêt dont le rôle sur le positionnement des noyaux ainsi que sur les caractéristiques du réseau microtubulaire sera étudié à travers un criblage phénotypique en utilisant la technique des siARN (Figure 1D).
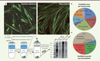 |
Figure 1. Protéomes microtubulaires des fibres musculaires immatures et matures. A. Immuno-marquages de myotubes immatures (3 jours de différenciation) et de myofibres matures (11 jours de différenciation) in vitro marqués pour les noyaux (rouge) et la chaîne lourde de la myosine (vert). Barres d’échelles = 150 µm. B. Localisation subcellulaire des protéines candidates sélectionnées à partir des extraits cellulaires totaux. C. Protocole biochimique utilisé pour purifier et identifier le protéome microtubulaire dans les myotubes. D. Sélection des protéomes microtubulaire qui seront analysés par criblage siARN. |
Mise en place de la stratégie de criblage par siARN
Des cellules primaires purifiées à partir de souriceaux C57BL/6 âgés de 5 jours sont induites dans la voie de la différenciation courte (3 jours de différenciation), ou longue (11 jours de différenciation). L’effet de l’inhibition de chacune des protéines sélectionnées sur le positionnement des noyaux sera apprécié dans ces deux phases. L’analyse à 3 jours est basée sur un plugin développé dans ImageJ® par notre équipe combinée à une analyse statistique dans RStudio® afin d’extraire et d’analyser différents paramètres en lien avec les myotubes formés et le positionnement des noyaux. Nous obtenons ainsi automatiquement l’index de fusion, la longueur et l’aire des myotubes, l’aire des domaines nucléaires au cours de la formation des myotubes (grâce à la classification des myotubes en fonction de leur nombre de noyaux). Différents paramètres reliés aux distributions/localisations des noyaux le long des myotubes formés sont aussi extraits. À partir de ces données, nous avons développé un index qui permet de rendre compte de l’effet de l’absence de chaque protéine ciblée par un siARN sur le phénotype global de répartition des noyaux dans les myotubes étudiés. L’analyse à 11 jours est basée sur des mesures réalisées sur les fibres musculaires matures obtenues comme la largeur des fibres, les distances entre noyaux adjacents et la « périphérisation » des noyaux. Cette analyse quantitative est combinée à une analyse plus qualitative des fibres sur leur aptitude à former des sarcomères et des tubules-T matures. Cette approche protéomique nous a déjà permis d’identifier de nouveaux acteurs du positionnement nucléaire au cours de la formation des fibres musculaires. L’identification de ces protéines va permettre une meilleure compréhension des mécanismes impliqués dans la formation des fibres musculaires mais surtout d’identifier de potentielles cibles thérapeutiques pour les pathologies associées de type CNM.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Wakelam MJ. The fusion of myoblasts. Biochem J 1985 ; 228 : 1–12. [CrossRef] [PubMed] [Google Scholar]
- Cadot B, Gache V, Vasyutina E, et al. Nuclear movement during myotube formation is microtubule and dynein dependent and is regulated by Cdc42, Par6 and Par3. EMBO Rep 2012 ; 13 : 741–749. [CrossRef] [PubMed] [Google Scholar]
- Metzger T, Gache V, Xu M, et al. MAP and kinesin-dependent nuclear positioning is required for skeletal muscle function. Nature 2012 ; 484 : 120–124. [CrossRef] [PubMed] [Google Scholar]
- Gache V, Gomes ER, Cadot B. Microtubule motors involved in nuclear movement during skeletal muscle differentiation. Mol Cell Biol 2017 ; 28 : 865–874. [Google Scholar]
- Falcone S., Roman W., Hnia K., et al. N-WASP is required for Amphiphysin-2/BIN1-dependent nuclear positioning and triad organization in skeletal muscle and is involved in the pathophysiology of centronuclear myopathy. EMBO Mol Med 2014 ; 6 : 1455–1475. [CrossRef] [PubMed] [Google Scholar]
- Jungbluth H, Wallgren-Pettersson C, Laporte J. Centronuclear (myotubular) myopathy. Orphanet J Rare Dis 2008 ; 3 : 26. [CrossRef] [PubMed] [Google Scholar]
Liste des figures
 |
Figure 1. Protéomes microtubulaires des fibres musculaires immatures et matures. A. Immuno-marquages de myotubes immatures (3 jours de différenciation) et de myofibres matures (11 jours de différenciation) in vitro marqués pour les noyaux (rouge) et la chaîne lourde de la myosine (vert). Barres d’échelles = 150 µm. B. Localisation subcellulaire des protéines candidates sélectionnées à partir des extraits cellulaires totaux. C. Protocole biochimique utilisé pour purifier et identifier le protéome microtubulaire dans les myotubes. D. Sélection des protéomes microtubulaire qui seront analysés par criblage siARN. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




