| Issue |
Med Sci (Paris)
Volume 32, Number 5, Mai 2016
|
|
|---|---|---|
| Page(s) | 441 - 444 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20163205005 | |
| Published online | 25 May 2016 | |
L’hormone anti-müllerienne
Une hormone ovarienne exerçant une rétroaction hypothalamique ?
Anti-Mullerian hormone: an ovarian hormone exerting hypothalamic feedback?
1
Unité Inserm U1172, laboratoire du développement et plasticité du cerveau neuroendocrine, centre de recherche Jean-Pierre Aubert, 59045
Lille, France
2
Faculté de médecine, université de Lille, FHU 1000 Days for Health, 59045
Lille, France
3
Service de gynécologie endocrinienne et médecine de la reproduction, hôpital Jeanne de Flandre, CHU de Lille, avenue Eugene Avinée, 59037
Lille, France
La reproduction des mammifères est contrôlée au niveau du cerveau par une petite population de neurones spécifiques de l’hypothalamus qui sécrètent de la GnRH (hormone de libération des gonadotrophines hypophysaires, aussi appelée LHRH, luteinizing hormone releasing hormone). Ces neurones, dont les corps cellulaires sont localisés dans la région préoptique1 (chez la souris et l’homme) et dans l’hypothalamus médiobasal (chez l’homme), envoient des projections vers l’éminence médiane de l’hypothalamus, qui constitue l’interface entre le système nerveux central et le système endocrinien périphérique. La GnRH est donc libérée dans les capillaires du système porte hypothalamo-hypophysaire puis véhiculée dans l’hypophyse antérieure où elle commande la sécrétion des gonadotrophines [1], l’hormone lutéinisante (LH) et l’hormone follicule stimulante (FSH), qui à leur tour, vont réguler l’activité gonadique [17] (→). Chez les mammifères femelles, une partie de l’activité ovarienne est indépendante des gonadotrophines, à savoir la croissance folliculaire depuis son début jusqu’au stade des petits follicules à antrum. De nombreux facteurs interviennent dans ce phénomène, en particulier l’hormone anti-müllerienne (AMH), aussi connue sous le nom de müllerian-inhibiting substance, qui est un membre de la superfamille du TGF-ß (transforming growth factor-ß). Il s’agit une glycoprotéine homodimérique de 140 kDa, dont les deux monomères sont liés par des ponts disulfures. Chez la femelle, l’AMH est sécrétée par les cellules ovariennes de la granulosa2. Son rôle est de réguler négativement la transition des follicules primordiaux vers les follicules primaires [2] et de protéger les follicules en croissance d’une maturation prématurée, en s’opposant aux effets de la FSH [3].
(→) Voir la Nouvelle de L. Naulé et S. Mhaouty-Kodja, page 452 de ce numéro
Ce rôle de l’AMH semble perturbé chez les femmes ayant un syndrome des ovaires polykystiques (SOPK), leurs taux plasmatiques d’AMH étant 2 à 3 fois plus élevés que chez les femmes avec ovaires normaux [4]. Le SOPK est la pathologie endocrinienne la plus fréquente de la femme en âge de procréer ; elle touche près de 10% d’entre elles. Elle est responsable d’hyperandrogénie (augmentation inhabituelle de la production d’androgènes, hormones mâles, dans les ovaires), de dysovulation et donc d’infertilité [5]. Une caractéristique du SOPK est une élévation des taux sériques de LH, même si cette élévation n’est pas constante et reste inexpliquée [6].
La sévérité du phénotype du SOPK chez la femme est corrélée à la production d’AMH. Celle-ci est en effet plus élevée chez les patientes dysovulantes par rapport aux patientes avec SOPK mais ovulantes [7]. Chez les femmes avec SOPK, l’excès d’AMH est suspecté de jouer un rôle important dans l’anovulation3 en amplifiant l’effet inhibiteur de l’AMH sur l’action de la FSH [3–8].
L’AMH se lie à son récepteur spécifique de type II (AMHR2) qui s’hétéro-dimérise avec un récepteur de type-I (ALK[activin receptor-like kinase]2, ALK3 ou ALK6) et recrute des protéines Smad qui sont transloquées dans le noyau pour réguler l’expression des gènes cibles [9]. L’AMH est le seul ligand connu d’AMHR2, ce qui suggère que les tissus qui expriment ce récepteur sont très probablement les tissus-cibles de l’AMH. Chez les femelles, la distribution et la fonction d’AMHR2 n’ont pas encore été bien étudiées hormis son rôle dans les ovaires. Mais nous savons qu’il est exprimé dans des tissus extragonadiques incluant le cerveau [10]. Cela soulève la question d’éventuels rôles extra-ovariens de l’AMH, susceptibles d’être amplifiés dans le SOPK.
Nous avons montré, dans une étude publiée récemment dans la revue Nature Communications [11], que l’AMH induit la sécrétion de LH en stimulant l’activité des neurones hypothalamiques à GnRH exprimant le récepteur de l’AMH in vivo dans les espèces murine et humaine. Ces données mettent en avant l’AMH comme régulateur important du système à GnRH, ouvrant de nouvelles pistes pour l’exploration du rôle de l’AMH dans la fonction reproductive et pour la compréhension de la physiopathologie du SOPK.
Expression d’AMHR2 dans le cerveau et sur les neurones à GnRH
Nous avons tout d’abord étudié l’expression de la protéine AMHR2 par immunohistochimie dans le cerveau des souris en âge de procréer (90 jours après la naissance). Nous avons observé que les cellules immunoréactives pour l’AMHR2 sont distribuées dans plusieurs régions du cerveau : au niveau des neurones du cortex, de l’hippocampe, et de l’hypothalamus dans lequel sont localisés les corps cellulaires et les axones des neurones à GnRH. De façon intéressante, l’expression d’AMHR2 dans l’hypothalamus est également détectée dans deux types cellulaires non neuronaux qui régulent la sécrétion de la neurohormone en interagissant étroitement avec les terminaisons des neurones à GnRH : les cellules endothéliales de l’éminence médiane [12] et les cellules gliales hypothalamiques appelées tanycytes [13].
Nous avons de plus trouvé que l’AMHR2 était exprimé dans les neurones à GnRH de fœtus humains et murins. Chez les sujets adultes murins et humains, une approche par double immunomarquage révèle qu’AMHR2 continue à être exprimé par plus de 50 % des neurones à GnRH de la région pré-optique hypothalamique.
L’AMH régule l’excitabilité et la sécrétion des neurones à GnRH
Pour déterminer si l’AMH agissait préférentiellement au niveau des corps cellulaires ou des terminaisons neuronales, nous avons étudié l’effet de l’AMH sur l’activité électrique du neurone à GnRH ainsi que sur la sécrétion de GnRH sur des tranches de cerveau murin contenant, respectivement, soit les corps cellulaires, soit les terminaisons neuroendocrines de ces neurones hypothalamiques. Au niveau des corps cellulaires, nous avons trouvé que l’AMH exerçait un puissant effet post-synaptique excitateur sur la moitié des neurones à GnRH, à la fois chez la souris mâle et la souris femelle. Cet effet stimulateur de l’AMH sur l’activité électrique du neurone à GnRH survient à des concentrations sub-nanomolaires. L’utilisation d’explants d’éminence médiane en survie a par ailleurs montré que l’AMH était également capable de moduler la sécrétion de GnRH par les terminaisons neuroendocrines.
L’administration intracérébroventriculaire d’AMH stimule la sécrétion de LH in vivo
Afin d’examiner les effets de l’AMH sur la sécrétion de la LH hypophysaire in vivo, nous avons administré directement de l’AMH dans le ventricule latéral du cerveau de souris femelles en diœstrus4, lorsque la sécrétion de GnRH est basale, et avons mesuré la sécrétion de LH, qui est un reflet de la sécrétion de GnRH. Nous avons analysé les concentrations plasmatiques de LH 15 et 30 minutes après l’administration de doses croissantes d’AMH et nous avons trouvé une augmentation rapide de la sécrétion de LH 15 minutes après injection. Cette sécrétion revient à l’état de base 30 minutes après l’injection. L’administration d’inhibiteurs des récepteurs de type I de l’AMH atténue significativement cette sécrétion, indiquant qu’elle dépend d’un signal passant par les récepteurs de l’AMH. Des prélèvements de sang répétés ont par ailleurs montré que le traitement à l’AMH entraînait une augmentation de la fréquence de la sécrétion pulsatile de LH chez la souris.
Les effets de l’AMH sur la sécrétion de LH ont été complètement bloqués par un traitement des souris par le cetrorelix (antagoniste du récepteur de la GnRH qui sature les sites anté-hypophysaires), ce qui exclut un effet direct de l’AMH au niveau hypophysaire et confirme une action centrale de l’AMH sur les neurones à GnRH.
Les taux d’AMH et de LH sont corrélés dans un modèle de souris SOPK
Utilisant un modèle de souris SOPK [14], nous avons mis en évidence une corrélation positive et significative entre AMH et LH chez ces souris (alors que leurs taux sériques d’AMH n’étaient pas différents de ceux des souris contrôles), un phénotype qui est retrouvé chez la femme avec SOPK [15]. Aucune corrélation entre FSH et AMH n’a été retrouvée.
Conclusion
Nous avons démontré que l’AMH, qui est anormalement élevée dans le sérum de femmes avec SOPK, était capable d’augmenter l’activité neuronale et la sécrétion de la GnRH. L’AMH était auparavant connue pour ses rôles cruciaux dans la différenciation sexuelle et les fonctions gonadiques. Cependant, les effets extragonadiques possibles de l’AMH sur l’axe hypothalamo-hypophysaire restaient jusque-là inexplorés. Ce travail démontre qu’une grande partie des neurones à GnRH exprime le récepteur de l’AMH à la fois chez la souris et l’homme, et que l’AMH stimule fortement l’activité électrique et de neurosécrétion de ces neurones chez la souris.
Cette étude met en évidence l’augmentation de la sécrétion pulsatile de LH par une action centrale de l’AMH sur les neurones à GnRH. Cette augmentation de la pulsatilité de la LH est une caractéristique pathologique retrouvée dans de nombreux cas de SOPK (Figure 1). Jusque là, l’augmentation de la fréquence des pics de LH dans le SOPK était attribuée à un défaut de rétroaction négative exercé par la progestérone, du fait d’une « androgénisation hypothalamique » dès la vie fœtale [16]. Ces résultats montrent de manière inédite que la sécrétion de GnRH hypothalamique est régulée par l’AMH et que cette régulation pourrait être impliquée dans la physiopathologie de la fertilité, ouvrant ainsi de nouvelles pistes de traitement du syndrome des ovaires polykystiques.
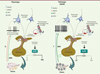 |
Figure 1. Représentation schématique du mécanisme d’action proposé de l’AMH sur les neurones à GnRH des femmes à ovaire normal et des femmes avec un syndrome des ovaires polykystiques (SOPK). AMH : hormone anti-müllerienne ; AMHR : récepteur de l’hormone anti-müllerienne ; E2 : œstrogènes ; GnRH : hormone de libération des gonadotrophines hypophysaires ; T : testostérone ; LH : hormone lutéinisante ; FSH : hormone follicule stimulante. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article
Références
- Christian C, Moenter SM. The neurobiology of preovulatory and estradiol-induced gonadotropin-releasing hormone surges. Endocr Rev 2010 ; 31 : 544–577. [CrossRef] [PubMed] [Google Scholar]
- Durlinger AL, Kramer P, Karels B, et al. Control of primordial follicle recruitment by anti- Mullerian hormone in the mouse ovary. Endocrinology 1999 ; 140 : 5789–5796. [CrossRef] [PubMed] [Google Scholar]
- Pellatt L, Hanna L, Brincat M, et al. Anti-Mullerian hormone reduces follicle sensitivity to follicle stimulating hormone in human granulosa cells. Fertil Steril 2011 ; 96 : 1246–1251. [CrossRef] [PubMed] [Google Scholar]
- Pigny P, Jonard S, Robert Y, Dewailly D. Serum anti-Mullerian hormone as a surrogate for antral follicle count for definition of the polycystic ovary syndrome. J Clin Endocrinol Metab 2006 ; 91 : 941–945. [CrossRef] [PubMed] [Google Scholar]
- Norman RJ, Dewailly D, Legro RS, Hickey TE. Polycystic ovary syndrome. Lancet 2007 ; 370 : 685–697. [CrossRef] [PubMed] [Google Scholar]
- Taylor AE, McCourt B, Martin KA, et al. Determinants of abnormal gonadotropin secretion in clinically defined women with polycystic ovary syndrome. J Clin Endocrinol Metab 1997 ; 82 : 2248–2256. [PubMed] [Google Scholar]
- Pigny P, Merlen E, Robert Y, et al. Elevated serum level of anti-mullerian hormone in patients with polycystic ovary syndrome: relationship to the ovarian follicle excess and to the follicular arrest. J Clin Endocrinol Metab 2003 ; 88 : 5957–5962. [CrossRef] [PubMed] [Google Scholar]
- Jonard S, Dewailly D. The follicular excess in polycystic ovaries, due to intra-ovarian hyperandrogenism, may be the main culprit for the follicular arrest. Hum Reprod Update 2004 ; 10 : 107–117. [CrossRef] [PubMed] [Google Scholar]
- Josso N, di Clemente N. Transduction pathway of anti-Mullerian hormone, a sex-specific member of the TGF-beta family. Trends Endocrinol Metab 2003 ; 14 : 91–97. [CrossRef] [PubMed] [Google Scholar]
- Lebeurrier N, Launay S, Macrez R, et al. Anti-Mullerian-hormone-dependent regulation of the brain serine-protease inhibitor neuroserpin. J Cell Sci 2008 ; 121 : 3357–3365. [CrossRef] [PubMed] [Google Scholar]
- Cimino I, Casoni F, Liu X, et al. Novel role for anti-Müllerian hormone in the regulation of GnRH neuron excitability and hormone secretion. Nat Commun 2016 ; 7 : 10055. [CrossRef] [PubMed] [Google Scholar]
- Giacobini P, Parkash J, Campagne C, et al. Brain endothelial cells control fertility through ovarian-steroid-dependent release of semaphorin 3A. PLoS Biol 2014 ; 12 : e1001808. [CrossRef] [PubMed] [Google Scholar]
- Parkash J, Messina A, Langlet F, et al. Semaphorin7A regulates neuroglial plasticity in the adult hypothalamic median eminence. Nat Commun 2015 ; 6 : 6385. [CrossRef] [PubMed] [Google Scholar]
- Moore AM, Prescott M, Marshall CJ, et al. Enhancement of a robust arcuate GABAergic input to gonadotropin-releasing hormone neurons in a model of polycystic ovarian syndrome. Proc Natl Acad Sci USA 2015 ; 112 : 596–601. [CrossRef] [Google Scholar]
- Catteau-Jonard S, Pigny P, Reyss AC, et al. Changes in serum anti-mullerian hormone level during low-dose recombinant follicular-stimulating hormone therapy for anovulation in polycystic ovary syndrome. J Clin Endocrinol Metab 2007 ; 92 : 4138–4143. [CrossRef] [PubMed] [Google Scholar]
- Solorzano C, Beller J, Abshire M, et al. Neuroendocrine dysfunction in polycystic ovary syndrome. Steroids 2012 ; 77 : 332–337. [CrossRef] [PubMed] [Google Scholar]
- Naulé L, Mhaouty-Kodja S. Le récepteur neural des œstrogènes bêta : un nouvel acteur dans la maturation pubertaire femelle. Med Sci (Paris) 2016 ; 32 : 452–455. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2016 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Représentation schématique du mécanisme d’action proposé de l’AMH sur les neurones à GnRH des femmes à ovaire normal et des femmes avec un syndrome des ovaires polykystiques (SOPK). AMH : hormone anti-müllerienne ; AMHR : récepteur de l’hormone anti-müllerienne ; E2 : œstrogènes ; GnRH : hormone de libération des gonadotrophines hypophysaires ; T : testostérone ; LH : hormone lutéinisante ; FSH : hormone follicule stimulante. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




