| Issue |
Med Sci (Paris)
Volume 30, Number 11, Novembre 2014
Cils primaires et ciliopathies
|
|
|---|---|---|
| Page(s) | 943 - 945 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20143011004 | |
| Published online | 10 November 2014 | |
Comportement de peur : rôle des interneurones exprimant la parvalbumine du cortex préfrontal médian
Prefrontal parvalbumin-expressing interneurons control fear behavior
Inserm U862, neurocentre Magendie, 146, rue Léo Saignat, 33077 Bordeaux Cedex, France
Les troubles anxieux représentent les pathologies psychiatriques les plus fréquentes avec une prévalence de l’ordre de 16 % dans la population mondiale [1]. D’un point de vue clinique, il est fondamental de mieux comprendre les circuits neuronaux et les mécanismes impliqués dans la régulation de ces pathologies dans le but de développer de nouvelles approches thérapeutiques. Expérimentalement, les troubles anxieux - et en particulier les réponses émotionnelles de peur - peuvent être facilement modélisés chez le rongeur par l’utilisation du conditionnement auditif de peur ; celui-ci consiste à associer un stimulus sonore (le stimulus conditionnel) à un choc électrique léger délivré aux pattes de l’animal (le stimulus inconditionnel). Au cours du conditionnement, les animaux apprennent que le son est prédictif de l’occurrence du choc électrique. Par la suite, la présentation du seul son induit chez les animaux conditionnés un ensemble de réponses dont une réponse d’immobilisation (le freezing), qui est un indice de la peur de l’animal et qui, de plus, est facilement quantifiable.
Circuits neuronaux impliqués dans les réponses émotionnelles de peur
Le modèle canonique des circuits neuronaux impliqués dans la régulation des réponses émotionnelles de peur indique que l’amygdale, une structure du lobe temporal médian, joue un rôle clé dans l’apprentissage du conditionnement de peur [2, 3]. Au contraire, le cortex préfrontal médian, et en particulier l’aire prélimbique, semble jouer un rôle fondamental dans l’expression de ces réponses à la suite de l’apprentissage [4]. En particulier, des lésions ou des inactivations de l’aire prélimbique bloquent l’expression des réponses émotionnelles de peur, et des modifications d’activité de certains neurones de cette aire, fortement corrélées à ces réponses comportementales, sont observées [4, 5]. Alors que le rôle de l’aire prélimbique dans l’expression des réponses comportementales de peur est bien établi, celui des différents types de neurones de cette région, ainsi que les mécanismes sous-jacents impliqués dans l’expression des réponses de peur, restent largement inconnus. Le cortex est composé de deux types principaux de cellules nerveuses, des cellules excitatrices de projection dont le neurotransmetteur principal est le glutamate, et des cellules inhibitrices, appelées interneurones, qui utilisent l’acide γ-aminobutyrique ou GABA comme neurotransmetteur. Les cellules excitatrices de projection contactent des régions distantes et vont permettre la transmission de l’information nerveuse à grande échelle. Les interneurones inhibiteurs, quant à eux, permettent notamment de réguler précisément l’activité de sortie des cellules excitatrices. De multiples classes d’interneurones inhibiteurs existent, dont les fonctions sont très diverses [6]. Parmi ces populations interneuronales, on distingue notamment des interneurones exprimant la parvalbumine (interneurones PV), qui contactent les cellules de projection excitatrices au niveau du corps cellulaire ou du segment initial de l’axone (Figure 1). Cette particularité anatomique permet aux interneurones à parvalbumine de réguler précisément l’activité de sortie des cellules de projection. Alors que l’expression des réponses conditionnées de peur repose sur l’activation des cellules excitatrices de l’aire prélimbique [3], le rôle joué par les interneurones à parvalbumine n’a pas fait l’objet d’études systématiques.
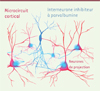 |
Figure 1. Microcircuit cortical composé d’un interneurone inhibiteur gabaergique exprimant la parvalbumine (en bleu) et de cellules de projection excitatrices (en rouge). L’activité des cellules de projection est fortement régulée au niveau du corps cellulaire et des axones par les interneurones exprimant la parvalbumine. |
Les interneurones à parvalbumine du cortex préfrontal médian permettent l’activation et la synchronisation des cellules excitatrices de projection
Inhibition de l’activité des interneurones à parvalbumine lors du comportement de peur
Afin d’identifier ces circuits et mécanismes, nous avons utilisé une approche innovante associant des procédures comportementales et des enregistrements électrophysiologiques combinés à des manipulations optogénétiques de circuits neuronaux spécifiques chez la souris [7]. Dans une première étape, nous avons pu, grâce à des enregistrements électrophysiologiques extracellulaires réalisés au cours du comportement de peur, identifier des interneurones inhibiteurs présumés dont l’activité neuronale était fortement inhibée lors de la présentation du stimulus conditionnel (lorsque celui-ci avait été préalablement associé au stimulus inconditionnel), c’est-à-dire lorsque les animaux présentaient d’intenses réponses comportementales de peur. Des analyses de corrélation nous ont permis de mettre en évidence que les modifications d’activité de ces interneurones présumés permettaient de prédire le développement de ces réponses conditionnées de peur. Ces interneurones présumés présentaient en outre les propriétés électrophysiologiques des interneurones à parvalbumine. Dans une deuxième étape, nous avons évalué, en utilisant des approches optogénétiques, si ces interneurones présumés correspondaient effectivement à des interneurones de type parvalbumine. Pour cela, nous avons utilisé une approche permettant l’expression conditionnelle, au niveau des interneurones à parvalbumine, de protéines sensibles à la lumière. Grâce à cette approche, nous avons démontré avec certitude que les interneurones dont l’activité neuronale était inhibée lors du comportement de peur étaient bien des interneurones à parvalbumine. De plus, la manipulation optogénétique de ces interneurones au cours du comportement nous a permis d’établir une relation causale entre la modification de leur activité neuronale et l’expression des réponses émotionnelles de peur.
Nous nous sommes par la suite intéressés aux mécanismes neuronaux permettant l’expression des réponses émotionnelles de peur par le biais de ces interneurones. Le premier mécanisme que nous avons identifié correspond à un phénomène de désinhibition de l’activité neuronale des cellules de projections préfrontales (Figure 2) [7]. Les interneurones à parvalbumine inhibent en effet de façon tonique les cellules pyramidales au niveau du corps cellulaire et du segment initial de l’axone. Ainsi, une inhibition de l’activité des interneurones à parvalbumine lors de la présentation du stimulus conditionnel supprime l’inhibition tonique sur les cellules pyramidales et, en conséquence, induit leur désinhibition ; nous avons confirmé ces données grâce aux approches optogénétiques couplées à des enregistrements unitaires chez la souris vigile. Ce mécanisme désinhibiteur est particulièrement intéressant puisque c’est un mécanisme permissif, qui permet le développement de réponses neuronales nécessaires à l’expression du comportement de peur.
 |
Figure 2. Mécanismes corticaux permettant l’expression des réponses émotionnelles de peur par le biais des interneurones à parvalbumine. Les interneurones à parvalbumine (en bleu sur la figure) inhibent de façon tonique les cellules de projection (en rouge) au niveau du corps cellulaire et du segment initial de l’axone. Lors de la présentation du son conditionné, l’activité des interneurones à parvalbumine est réduite, ce qui induit une désinhibition des cellules de projections qui deviennent plus excitables. En parallèle, l’inhibition des interneurones à parvalbumine est associée à une remise à zéro (resetting) de la phase des oscillations thêta (entre 8 et 12Hz), ce qui permet de synchroniser l’activité des cellules de projection excitatrices. Ces deux phénomènes sont causalement liés à l’expression des réponses conditionnées de peur. |
Accroissement de l’efficacité de la transmission synaptique
En parallèle de cette désinhibition des cellules pyramidales, nous avons également observé que l’activité neuronale de ces dernières était fortement synchronisée pendant une courte période à la suite de la présentation du stimulus conditionnel, notamment par la mise en place d’oscillations dont la fréquence moyenne était comprise entre 8 et 12 Hz. En effet, lors de la présentation du stimulus conditionnel associé à de fortes réponses émotionnelles de peur, nous avons observé une augmentation transitoire de l’amplitude des oscillations thêta (8-12 Hz), couplée à une réinitialisation de la phase des oscillations à la suite du stimulus conditionnel. Par la suite, nous avons démontré, grâce à des approches optogénétiques, que ce phénomène de resetting de la phase des oscillations thêta était lié à la diminution d’activité des interneurones à parvalbumine, et qu’il permettait la synchronisation de l’activité des cellules pyramidales excitatrices du cortex préfrontal (Figure 2). Enfin, nous avons pu montrer que ces cellules excitatrices pyramidales régulaient les réponses émotionnelles de peur directement au niveau de l’amygdale basolatérale. Cette synchronisation de l’activité neuronale des cellules pyramidales grâce aux interneurones à parvalbumine est fondamentale, puisqu’elle permet d’augmenter de façon considérable l’efficacité de la transmission synaptique au niveau des structures cibles sur une période de temps réduite, et permet ainsi l’expression des réponses émotionnelles de peur.
Perspectives
Ces travaux mettent en évidence deux mécanismes neuronaux complémentaires : la désinhibition de l’activité des cellules excitatrices préfrontales et leur synchronisation grâce au resetting de la phase des oscillations thêta. Ces deux mécanismes sont générés par les modifications d’activité des interneurones à parvalbumine, et permettent une coordination précise et une augmentation de l’activité neuronale des cellules de projection excitatrices du cortex préfrontal afin de contrôler l’expression des réponses conditionnées de peur. Ces travaux indiquent, en outre, que le maintien à long terme des réponses émotionnelles de peur associéés à de nombreuses conditions psychiatriques comme les troubles anxieux ou le syndrome de stress post-traumatique, pourrait être finement régulé au niveau de circuits inhibiteurs préfrontaux spécifiques.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Kessler RC, McGonagle KA, Zhao S, et al. Lifetime and 12-month prevalence of DSM-III-R psychiatric disorders in the United States. Results from the National comorbidity survey. Arch Gen Psychiatry 1994 ; 51 : 8–19. [CrossRef] [PubMed] [Google Scholar]
- Ledoux JE. Emotion circuits in the brain. Annu Rev Neurosci 2000 ; 23 : 155–184. [CrossRef] [PubMed] [Google Scholar]
- Ciocchi S, Lüthi A, Herry C. Nouveaux circuits neuronaux amygdaliens contrôlant le comportement de peur. Med Sci (Paris) 2011 ; 27 : 455–457. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
- Burgos-Robles A, Vidal-Gonzalez I, Quirk GJ. Sustained conditioned responses in prelimbic prefrontal neurons are correlated with fear expression and extinction failure. J Neurosci 2009 ; 29 : 8474–8482. [CrossRef] [PubMed] [Google Scholar]
- Sierra-Mercado D, Jr, Corcoran KA, Lebron-Milad K, Quirk GJ. Inactivation of the ventromedial prefrontal cortex reduces expression of conditioned fear and impairs subsequent recall of extinction. Eur J Neurosci 2006 ; 24 : 1751–1758. [CrossRef] [PubMed] [Google Scholar]
- Markram H, Toledo-Rodriguez M, Wang Y, et al. Interneurons of the neocortical inhibitory system. Nat Rev Neurosci 2004 ; 5 : 793–807. [CrossRef] [PubMed] [Google Scholar]
- Courtin J, Chaudun F, Rozeske RR, et al. Prefrontal parvalbumin interneurons shape neuronal activity to drive fear expression. Nature 2014 ; 505 : 92–96. [CrossRef] [PubMed] [Google Scholar]
© 2014 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Microcircuit cortical composé d’un interneurone inhibiteur gabaergique exprimant la parvalbumine (en bleu) et de cellules de projection excitatrices (en rouge). L’activité des cellules de projection est fortement régulée au niveau du corps cellulaire et des axones par les interneurones exprimant la parvalbumine. |
| Dans le texte | |
 |
Figure 2. Mécanismes corticaux permettant l’expression des réponses émotionnelles de peur par le biais des interneurones à parvalbumine. Les interneurones à parvalbumine (en bleu sur la figure) inhibent de façon tonique les cellules de projection (en rouge) au niveau du corps cellulaire et du segment initial de l’axone. Lors de la présentation du son conditionné, l’activité des interneurones à parvalbumine est réduite, ce qui induit une désinhibition des cellules de projections qui deviennent plus excitables. En parallèle, l’inhibition des interneurones à parvalbumine est associée à une remise à zéro (resetting) de la phase des oscillations thêta (entre 8 et 12Hz), ce qui permet de synchroniser l’activité des cellules de projection excitatrices. Ces deux phénomènes sont causalement liés à l’expression des réponses conditionnées de peur. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




