| Issue |
Med Sci (Paris)
Volume 30, Number 1, Janvier 2014
|
|
|---|---|---|
| Page(s) | 35 - 38 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20143001011 | |
| Published online | 24 January 2014 | |
Quand un régulateur énergétique contrôle la résolution de l’inflammation
L’AMPK induit le changement de phénotype des macrophages au cours de la régénération musculaire
When regulation of cell energy meets regulation of inflammation: AMPK triggers skewing of macrophage phenotype during skeletal muscle regeneration
1
Inserm, U1016, Institut Cochin, 24, rue du Faubourg Saint-Jacques, 75014 Paris, France
2
CNRS, UMR8104, 75014 Paris, France
3
Université Paris Descartes, Sorbonne Paris Cité, 75014 Paris, France
La régénération musculaire est un processus largement étudié depuis de nombreuses années. Cette capacité de réparation du muscle est rendue possible notamment grâce aux cellules souches musculaires adultes, appelées cellules satellites, présentes entre la lame basale et la fibre musculaire [1]. À l’état basal, ces cellules sont quiescentes. Lors d’une lésion, elles sont activées et prolifèrent pour former une population de myoblastes qui, dans un second temps, soit s’engagent dans la voie de la myogenèse - pour devenir myocytes et fusionner pour former de nouvelles fibres remplaçant les fibres musculaires lésées -, soit retournent dans un état de quiescence pour former le réservoir de cellules satellites (revue dans [1]). La coordination de ces événements est finement régulée au niveau de la cellule musculaire elle-même, mais également par son environnement tissulaire. En effet, différents types cellulaires sont nécessaires à une bonne régénération musculaire, dont les macrophages [2].
Les macrophages : cellules immunitaires indispensables à la régénération musculaire
Les macrophages, principalement connus comme l’une des premières défenses de l’organisme face à une infection, ont aussi d’autres rôles. Leur participation à la réparation de nombreux tissus a ainsi été mise en évidence ces dernières années. En cas de dommage tissulaire, les monocytes circulants infiltrent les tissus lésés [3, 4], se différencient en macrophages et contrôlent l’inflammation pour activer les différentes étapes de la réparation tissulaire. Les macrophages infiltrant le muscle endommagé sont de type M1, pro-inflammatoire, caractérisés notamment par une expression de TNF (tumor necrosis factor)-α et d’IL (interleukine)-1β, et stimulent la prolifération des myoblastes. Ces mêmes macrophages changent ensuite de statut pour acquérir un phénotype anti-inflammatoire (M2) et participent à la myogenèse en stimulant la différenciation et la fusion des myoblastes, ainsi que la croissance des nouvelles myofibres [2, 3]. Les mécanismes moléculaires régulant le changement de phénotype des macrophages sont mal connus. Deux voies ont été récemment impliquées : la voie CEBPβ (CCAAT/enhancer-binding protein B) et la voie P38/MKP1 [5, 6].
L’AMPK, senseur énergétique, mais pas seulement
L’AMPK (AMP-activated kinase) est le principal senseur énergétique des cellules. Cette molécule, composée de trois sous-unités (α : catalytique et β, γ : régulatrices) est activée par différentes kinases comme LKB1 ou CAMKKβ [6], mais également par des taux élevés d’AMP présents dans la cellule [13] (→).
(→) Voir la synthèse de M. Foretz et B. Viollet, page 82 de ce numéro
Les cibles métaboliques de l’AMPK sont très bien décrites dans la littérature (revue dans [7]). L’AMPK joue également un rôle dans la régulation du cycle cellulaire, de la polarité cellulaire, et plus récemment, a été impliquée dans l’inflammation. L’activité de l’AMPK est associée à une diminution de l’expression de molécules pro-inflammatoires par le macrophage en présence de bactéries [8]. Nous avons exploré le rôle de l’AMPKα1, seule isoforme catalytique exprimée par les macrophages [9], dans le changement phénotypique des macrophages au cours de la régénération musculaire.
La délétion de l’AMPKa1 altère la régénération musculaire in vivo
La délétion de l’AMPKα1 dans les macrophages engendre un défaut de la régénération musculaire du tibialis anterior (après une lésion induite par la cardiotoxine) identifié par une augmentation du pourcentage de fibres nécrotiques sept jours après le dommage, et par une diminution de l’aire des fibres musculaires nouvellement formées 14, 28, et 56 jours après la blessure. À l’inverse, la transplantation de moelle osseuse de souris normales chez une souris receveuse irradiée déficiente pour l’AMPKα1 induit une amélioration de la régénération musculaire, induisant une augmentation de la taille des nouvelles myofibres 14 jours après l’induction de la blessure.
Les macrophages déficients pour l’AMPKα1 n’acquièrent pas le statut anti-inflammatoire in vitro
L’analyse in vitro du statut inflammatoire de macrophages dérivés de la moelle osseuse de souris déficientes pour l’AMPKα1 et cultivés en présence de cytokines qui induisent l’état M2 (IL4, IL10) [10] met en évidence une diminution du nombre de cellules exprimant des marqueurs M2 (TGF [transforming growth factor]-β1, CD206 [ou mannose receptor], CD163, Arginase 1 et Mgl1 [macrophage galactose-type C-type lectin 1]) et une augmentation du nombre de cellules exprimant des marqueurs M1 (la chimiokine CCL3 ou MIP1a, iNOS [inducible nitric oxide synthase] et Cox-2 [cyclo-oxygénase-2]). En outre, les propriétés trophiques vis-à-vis des myoblastes de ces macrophages déficients pour l’AMPKα1 sont altérées. Notre groupe avait montré précédemment que les macrophages pro-inflammatoires de type M1 stimulent la prolifération des myoblastes alors que les macrophages anti-inflammatoires (M2) agissent positivement sur leur différenciation et leur fusion, conduisant à la formation de nouvelles fibres musculaires [2, 3]. Les macrophages déficients en AMPKα1 activés par les cytokines pro-M2 conservent la propriété de stimuler la prolifération des myoblastes, et ont perdu leur capacité de support de la myogenèse (Figure 1).
 |
Figure 1. Rôle des macrophages sur la myogenèse in vitro. Le milieu conditionné de macrophages normaux (WT) et déficients en AMPKα1 (AMPKα1-/-) est déposé sur des myoblastes pendant 72 h. Le marquage de la desmine (rouge) permet d’identifier la formation de structures différenciées plurinucléées (noyaux en bleu, coloration Hoescht), les myotubes. |
Les macrophages déficients en AMPKα1 n’acquièrent pas le statut anti-inflammatoire in vivo
L’analyse de l’expression protéique des marqueurs de l’inflammation dans des leucocytes extraits de muscle en régénération montre une diminution du pourcentage de cellules exprimant les marqueurs M1 (CCL3, iNOS) et une augmentation du nombre de cellules exprimant les marqueurs M2 (TGFβ1, CD206, CD163, Arginase 1) avec le temps. Cette cinétique, indicative de la résolution de l’inflammation, n’est pas observée dans les leucocytes déficients en AMPKα1, le niveau d’expression des marqueurs M1 et M2 restant stable depuis les premiers jours après la lésion. La non-acquisition du phénotype M2 a été confirmée in vivo chez la souris CX3CR1GFP/+ qui permet de suivre les sous-populations monocytaires et macrophagiques [11]. L’analyse du pourcentage des populations F4/80±, CX3CR1±, Ly6-C/G+ (macrophages M1) et F4/80++, CX3CR1++, Ly6-C/G- (macrophages M2) met en évidence un retard d’apparition de la population M2 dès le premier jour de régénération.
La phagocytose est un mécanisme essentiel au changement de phénotype des macrophages via l’AMPK
La phagocytose de débris apoptotiques et/ou nécrotiques est associée à l’acquisition d’un phénotype anti-inflammatoire par les macrophages [3, 12]. L’activité de phagocytose de myoblastes apoptotiques/nécrotiques est fortement réduite dans les macrophages déficients en AMPKα1. Ceci s’accompagne, contrairement aux macrophages normaux, d’une inhibition de l’acquisition du phénotype anti-inflammatoire M2. L’utilisation de souris déficientes et d’inhibiteurs spécifiques a également permis de montrer que le signal en amont de l’activation de l’AMPK n’implique pas la kinase LKB1, mais la CAMKKβ (Ca2+/CaM-dependent protein kinase kinase β), dont l’inhibition prévient l’acquisition du phénotype anti-inflammatoire M2, notamment après phagocytose des débris cellulaires.
En conclusion
L’ensemble de ces travaux, utilisant des études de perte et de gain de fonction in vivo, ainsi que des modèles de coculture in vitro, démontrent un nouveau rôle de la voie CAMKKβ-AMPKα1 associée à la phagocytose des débris cellulaires dans la résolution de l’inflammation au cours de la régénération musculaire (Figure 2). Ces données mettent en évidence un lien entre la régulation du métabolisme et la régulation de l’inflammation, primordial dans la résolution de l’inflammation des tissus.
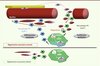 |
Figure 2. Rôle de la voie CAMKK β-AMPK et de la phagocytose lors du changement de phénotype des macrophages. |
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Yin H, Price F, Rudnicki MA. Satellite cells and the muscle stem cell niche. Physiol Rev 2013 ; 93 : 23–67. [CrossRef] [PubMed] [Google Scholar]
- Saclier M, Yacoub-Youssef H, Mackey AL, et al. Differentially activated macrophages orchestrate myogenic precursor cell fate during human skeletal muscle regeneration. Stem Cells 2013 ; 31 : 384–396. [CrossRef] [PubMed] [Google Scholar]
- Arnold L, Henry A, Poron F, et al. Inflammatory monocytes recruited after skeletal muscle injury switch into antiinflammatory macrophages to support myogenesis. J Exp Med 2007 ; 204 : 1057–1069. [CrossRef] [PubMed] [Google Scholar]
- Chazaud B. Macrophages: supportive cells for tissue repair and regeneration. Immunobiology 2013 (sous presse). [PubMed] [Google Scholar]
- Perdiguero E, Sousa-Victor P, Ruiz-Bonilla V, et al. p38/MKP-1-regulated AKT coordinates macrophage transitions and resolution of inflammation during tissue repair. J Cell Biol 2011 ; 195 : 307–322. [CrossRef] [PubMed] [Google Scholar]
- Ruffell D, Mourkioti F, Gambardella A, et al. A CREB-C/EBPbeta cascade induces M2 macrophage-specific gene expression and promotes muscle injury repair. Proc Natl Acad Sci USA 2009 ; 106 : 17475–17480. [CrossRef] [Google Scholar]
- Hardie DG. AMP-activated protein kinase: an energy sensor that regulates all aspects of cell function. Genes Dev 2011 ; 25 : 1895–1908. [CrossRef] [PubMed] [Google Scholar]
- Zhao X, Zmijewski JW, Lorne E, et al. Activation of AMPK attenuates neutrophil proinflammatory activity and decreases the severity of acute lung injury. Am J Physiol Lung Cell Mol Physiol 2008 ; 295 : L497–L504. [CrossRef] [PubMed] [Google Scholar]
- Sag D, Carling D, Stout RD, Suttles J. Adenosine 5’-monophosphate-activated protein kinase promotes macrophage polarization to an anti-inflammatory functional phenotype. J Immunol 2008 ; 181 : 8633–8641. [PubMed] [Google Scholar]
- Martinez FO, Sica A, Mantovani A, Locati M. Macrophage activation and polarization. Front Biosci 2011 ; 13 : 453–461. [CrossRef] [Google Scholar]
- Geissmann F, Jung S, Littman DR. Blood monocytes consist of two principal subsets with distinct migratory properties. Immunity 2003 ; 19 : 71–82. [CrossRef] [PubMed] [Google Scholar]
- Devitt A, Marshall LJ. The innate immune system and the clearance of apoptotic cells. J Leukoc Biol 2011 ; 90 : 447–457. [CrossRef] [PubMed] [Google Scholar]
- Foretz M, Viollet B. Les nouvelles promesses de la metformine : vers une meilleure compréhension de ses mécanismes d’action. Med Sci (Paris) 2014 ; 30 : 82–92. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2014 médecine/sciences – Inserm
Liste des figures
 |
Figure 1. Rôle des macrophages sur la myogenèse in vitro. Le milieu conditionné de macrophages normaux (WT) et déficients en AMPKα1 (AMPKα1-/-) est déposé sur des myoblastes pendant 72 h. Le marquage de la desmine (rouge) permet d’identifier la formation de structures différenciées plurinucléées (noyaux en bleu, coloration Hoescht), les myotubes. |
| Dans le texte | |
 |
Figure 2. Rôle de la voie CAMKK β-AMPK et de la phagocytose lors du changement de phénotype des macrophages. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




