| Issue |
Med Sci (Paris)
Volume 28, Number 10, Octobre 2012
|
|
|---|---|---|
| Page(s) | 809 - 812 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20122810004 | |
| Published online | 12 October 2012 | |
Les glioblastomes de l’enfant et du jeune adulte
Une histoire de mutations d’histone et de remodelage de la chromatine
Mutations in histone H3.3 and chromatin remodeling genes drive pediatric and young adult glioblastomas
1
Département de génétique humaine, Université McGill, 4060 Sainte-Catherine West, PT-239, Montréal, QC H3Z 2Z3, Canada
2
Département de pédiatrie, Université McGill, Centre universitaire de santé McGill, 4060 Sainte-Catherine West, PT-239, Montréal, QC H3Z 2Z3, Canada
*
dong.khuongquang@mail.mcgill.ca
**
noha.gerges@mail.mcgill.ca
***
nada.jabado@mcgill.ca
Les tumeurs gliales de l’adulte et de l’enfant
Les tumeurs cérébrales sont les tumeurs solides les plus fréquentes en pédiatrie, et constituent la première cause de morbidité et de décès liés au cancer chez l’enfant. Leur classification histologique reste complexe et la plupart des tumeurs de haut grade sont classées comme étant embryonnaires (médulloblastome, tumeurs rhabdoïdes) ou gliales. Les tumeurs gliales de haut grade sont parmi les plus agressives : elles comprennent les glioblastomes (GBM, astrocytome de grade IV selon la classification de l’OMS [Organisation mondiale de la santé]) et les gliomes anaplasiques (grade III). De manière générale, le GBM est une tumeur de l’adulte : il est rare en pédiatrie - son incidence est de l’ordre de 0,6/100 000 chez les enfants et adolescents âgés de 0 à 19 ans - et son incidence augmente au cours de la vie jusqu’à 60 ans où il atteint son pic de fréquence [20] (→).
(→) Voir la Nouvelle de M. Verreault et al., page 812 de ce numéro
Le taux de mortalité à 5 ans des GBM est très élevé - proche de 90 % - en pédiatrie comme chez l’adulte. Les GBM se développent essentiellement dans les hémisphères cérébraux (plus de 50 %), mais également dans le thalamus ou ailleurs dans le système nerveux central.
Une variante anatomique des tumeurs gliales de haut grade est le gliome du tronc cérébral, qui représente un défi clinique additionnel étant donné son emplacement qui rend toute chirurgie d’exérèse impossible. Il survient essentiellement chez les enfants âgés de 5 à 10 ans, et son pronostic est particulièrement sombre avec un taux de survie globale à deux ans inférieur à 10 %.
Si, au cours des dernières décennies, des progrès importants ont été réalisés dans la compréhension et le traitement des médulloblastomes de l’enfant [21] (→), tel n’est pas le cas chez les enfants atteints de tumeurs gliales de haut grade. Ainsi, pour ces tumeurs, les avancées thérapeutiques demeurent négligeables en dépit de nombreux essais cliniques combinant chirurgie, radiothérapie, chimiothérapie, auxquels s’ajoute le développement, ces dernières années, de nombreuses thérapies ciblées incluant des inhibiteurs de récepteurs à activité tyrosine kinase ou de l’angiogenèse. Ces échecs suggèrent que ces efforts ne sont pas adaptés pour contrer la progression tumorale.
(→) Voir la Nouvelle de F. Bourdeaut et al., page 805 de ce numéro
Caractéristiques génétiques des GBM de l’adulte et de l’enfant
Les caractéristiques histologiques des GBM sont identiques quel que soit l’âge du patient ou la localisation de la tumeur, mais leurs caractéristiques génétiques diffèrent [1–4]. Par exemple, chez l’enfant, moins de 10 % des tumeurs ont des mutations/amplifications du récepteur à activité tyrosine kinase de l’EGF (epidermal growth factor) (EGFR), ou des mutations des enzymes isocitrate déshydroxygénase 1 ou 2 (IDH1/2), qui caractérisent respectivement la majorité des GBM primaires et secondaires chez l’adulte [3–5, 20] (→).
(→) Voir la Nouvelle de M. Verreault et al., page 812 de ce numéro
Des mutations du gène suppresseur de tumeur TP53 ont été observées dans une proportion plus importante de tumeurs chez l’enfant âgé de plus de 3 ans [6]. La perte combinée des bras des chromosomes 1p et 19q, signature génétique des oligodendrogliomes diffus de l’adulte, est extrêmement rare dans les oligodendrogliomes pédiatriques qui, eux-mêmes, sont rares [7]. Par ailleurs, certaines études semblent montrer que les tumeurs gliales de haut grade du tronc cérébral sont une entité moléculaire distincte des autres GBM [8, 9]. Malgré ces découvertes, aucun marqueur génétique ou mécanisme pathogénique clé n’avait - jusqu’à récemment - été découvert dans le GBM pédiatrique.
Mutations du gène H3F3A dans certains GBM pédiatriques et du jeune adulte
Récemment, notre groupe a séquencé les exomes de 48 GBM pédiatriques et de 6 échantillons correspondants de tissu cérébral normal [10]. Cette étude a révélé, dans 31 % des cas, des mutations somatiques récurrentes du gène H3F3A, codant pour une variante de l’histone 3, l’histone H3.3 [22]. Ces mutations portent sur des résidus très spécifiques : soit la lysine (K) en position 27, mutée en méthionine (M) (K27M, 9 cas sur 48), soit la glycine (G) en position 34, mutée en arginine (R) ou valine (V) (G34R, 5 cas sur 48 ; G34V, 1 cas sur 48). Fait intéressant, dans une cohorte supplémentaire de 784 gliomes adultes et pédiatriques, nous avons retrouvé les mutations de H3F3A dans 32 % des GBM et 18 % des astrocytomes anaplasiques pédiatriques, mais seulement dans 3 % des GBM adultes et jamais dans les tumeurs gliales de bas grade quel que soit l’âge du patient [10]. L’équipe du Dr Baker a réalisé le séquençage de l’ensemble du génome de 7 gliomes malins du tronc cérébral, ainsi que le séquençage ciblé de 43 tumeurs du tronc cérébral et de 36 GBM pédiatriques [11]. La mutation K27M dans H3.3, mais également dans l’histone canonique H3.1 (HIST1H3B) est présente dans 78 % des gliomes malins du tronc cérébral (60 % pour H3F3A et 18 % pour HIST1H3B), et la mutation G34R de H3F3A dans 14 % des tumeurs GBM de leur cohorte. Ces deux articles [10, 11], ainsi qu’un troisième plus récent de notre groupe [12], mettent en évidence une même mutation K27M de l’histone 3 dans les tumeurs gliales de haut grade du tronc cérébral et les GBM du thalamus, mutation qui caractérise les GBM de la ligne médiane, alors que la mutation G34R est observée essentiellement dans les tumeurs localisées dans les hémisphères cérébraux (Figure 1).
 |
Figure 1. Répartition anatomique des tumeurs présentant une mutation de H3.3 ou IDH1 en fonction de leur localisation et de l’âge des patients. La mutation K27M-H3.3 survient essentiellement dans les tumeurs de la ligne médiane, chez les enfants les plus jeunes (âge moyen de 7,4 ans). Les mutations G34R/V-H3.3 et celles d’IDH1/2 sont mutuellement exclusives et surviennent essentiellement dans les hémisphères cérébraux chez des patients plus âgés (âge moyen de 17,9 et 21,7 ans, respectivement). Les mutations d’ATRX surviennent surtout chez les enfants plus âgés, et plus particulièrement en association avec les mutations G34R/V-H3.3 et d’IDH1/2. |
Ces mutations récurrentes faux-sens des histones identifiées dans les deux études sont hétérozygotes et concernent deux résidus hautement conservés du gène, ce qui suggère un gain de fonction de la molécule, comme on l’observe dans les mutations IDH1/2. Fait important, alors que de nombreuses études impliquent indirectement les modifications post-traductionnelles des histones et l’épigénome dans la genèse de nombreux cancers, il s’agit des premières mutations somatiques jamais décrites affectant directement un gène codant pour une histone.
Conséquences des mutations de l’histone H3.3 dans les GBM pédiatriques
Conséquences des mutations de H3.3 sur la transcription
Les histones sont des protéines qui enveloppent l’ADN pour former des particules appelées nucléosomes qui compactent le génome des eucaryotes tout en permettant son accès à des processus cellulaires tels que la réparation, la transcription et la réplication (Figure 2) [23]. Outre leur rôle fondamental d’emballage de l’ADN, les histones ont un rôle crucial dans le maintien et l’expression de notre patrimoine génétique. H3.3 est une variante conservée de l’histone 3 structurellement très proche de l’histone canonique H3.1, dont elle ne diffère que par 5 acides aminés. Outre son rôle dans le remplacement des histones au niveau des gènes actifs et des promoteurs, H3.3 semble participer à la « mémoire » de notre epigénome par la transmission épigénétique de la chromatine active d’une cellule mère à une cellule fille, et s’accumule dans des locus silencieux au niveau de l’hétérochromatine péricentrique et des télomères [13] (Figure 2). Contrairement à son homologue canonique H3.1, H3.3 est incorporée dans la chromatine indépendamment du cycle de réplication cellulaire [14]. Elle représente l’histone préférentiellement contenue dans les nucléosomes du cerveau en développement chez la souris. Les deux mutations de H3.3 observées dans les GBM pédiatriques se situent dans la queue des histones, qui subit de fortes modifications post-traductionnelles (Figure 2). En particulier, la mutation K27M affecte deux modifications très étudiées : la méthylation de K27 et/ou l’acétylation de K27. La première est associée à la répression de gènes via l’intervention du complexe Polycomb qui est recruté à l’ADN par une K27 méthylée [15] ; la seconde est présente au niveau de promoteurs actifs. Notamment, la substitution d’une lysine par une méthionine pourrait avoir les mêmes conséquences que la méthylation et/ou l’abrogation de l’acétylation de ce même acide animé, entraînant la répression de la transcription. La mutation G34R/V pourrait influencer la méthylation de la lysine 36 (H3K36), une modification clé associée aux processus d’élongation de la transcription, mais également de l’épissage alternatif, ainsi que de la réparation ou la méthylation de l’ADN. Il est intéressant de remarquer que nous avons obtenu deux profils d’expression de gènes selon que l’une ou l’autre mutation de H3F3A était présente, suggérant des conséquences propres à chaque mutation dans la régulation de la transcription [10].
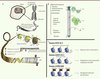 |
Figure 2. Représentation schématique de l’assemblage de la chromatine et de sa régulation A. L’ADN est compacté autour d’histones organisées en octamères qui contrôlent différents processus cellulaires tels que la réplication, la transcription ou la réparation de l’ADN. Les mutations K27M-H3.3 et G34R/V-H3.3 se situent au niveau ou à proximité de résidus de la queue de l’histone, affectant très probablement d’éventuelles modifications post-traductionnelles. B. Le complexe ATRX/DAXX permet l’intégration de H3.3 au niveau des télomères et de l’hétérochromatine. L’absence d’ATRX favoriserait un allongement des télomères, processus impliqué dans la transformation maligne d’une cellule. C. Proposition de modèle physiopathlogique des tumeurs gliales pédiatriques de haut grade (adapté de [19] et de [13]). |
Conséquences des mutations de H3.3 sur le maintien des télomères
L’avantage sélectif des mutations de H3.3 dans le GBM pédiatrique peut également s’expliquer par un effet sur le maintien des télomères et/ou la stabilité de l’hétérochromatine. Le dépôt de H3.3 au sein de ces contextes génomiques implique le complexe ATRX (alpha thalassemia/mental retardation syndrome X-linked)-DAXX (death domain-associated protein 6) [16]. Nous avons également identifié des mutations récurrentes dans ATRX (14/48 cas) et son partenaire de liaison DAXX (2/48 cas) dans les GBM pédiatriques [10]. Ainsi, des mutations de H3F3A, ATRX ou DAXX étaient présentes dans 21 des 48 GBM pédiatriques (44 %) et elles étaient corrélées à un phénotype d’allongement alternatif des télomères (ALT ou alternate lengthening of telomeres) [10]. Fait intéressant, dans notre cohorte, les mutations d’IDH1 identifiées dans les rares GBM pédiatriques et chez l’adulte étaient mutuellement exclusives avec les mutations H3F3A/ATRX/DAXX [10]. ATRX et H3.3 sont tous les deux essentiels au maintien de la chromatine télomérique. Les mutations d’ATRX/DAXX, en empêchant l’intégration de l’histone H3.3 au niveau des télomères, sont ainsi responsables d’un allongement alternatif de ces mêmes télomères, conférant un avantage de survie à la cellule. De manière intéressante, la survenue de mutations ATRX était statistiquement plus fréquente chez les adolescents, dans les GBM hémisphériques et en association avec le mutant H3.3 G34R/V. L’autre phénomène intéressant, dont la signification devra être explorée, est le chevauchement de ces mutations H3.3 et ATRX-DAXX avec des mutations de TP53 dans une même tumeur (Figure 1).
Perspectives
Les recherches de cette dernière décennie ont mis en évidence le rôle primordial des processus épigénétiques dans la formation et la progression tumorales. Le séquençage haut débit de nouvelle génération a permis d’identifier un nombre inattendu de mutations responsables de modifications clés de l’épigénome dans plusieurs types de cancer. Ceci indique que des altérations génétiques peuvent être sous-jacentes à ces événements épigénétiques. Dans le cas particulier des gliomes, la responsabilité directe de la mutation récurrente d’IDH1 dans le phénotype hyperméthylé du génome (CpG island methylator phenotype, CIMP) [17] a été récemment démontrée ; plus précisément elle affecte la déméthylation des histones [18]. Cette mutation est également associée à un meilleur pronostic [17]. La dérégulation du remodelage de la chromatine semble être une étape clé dans la survenue des tumeurs gliales de l’enfant (H3.3) et de l’adulte jeune (IDH). Ces études permettent d’étendre notre compréhension des mécanismes par lesquels les défauts de la chromatine contribuent au cancer ; elles offrent aussi la première preuve que des mutations somatiques ciblent directement un résidu modifiable des histones. Des études plus approfondies sont essentielles pour comprendre les mécanismes par lesquels ces modifications, et d’autres de la machinerie chromatinienne, contribuent à la transformation maligne, et les exploiter pour améliorer le diagnostic et la thérapie, en particulier en offrant une piste pour le développement de nouvelles thérapies ciblées dans un cancer actuellement meurtrier.
Liens d’intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Faury D, Nantel A, Dunn SE, et al. Molecular profiling identifies prognostic subgroups of pediatric glioblastoma and shows increased YB-1 expression in tumors. J Clin Oncol 2007 ; 25 : 1196–1208. [CrossRef] [PubMed] [Google Scholar]
- Haque T, Faury D, Albrecht S, et al. Gene expression profiling from formalin-fixed paraffin-embedded tumors of pediatric glioblastoma. Clin Cancer Res 2007 ; 13 : 6284–6292. [CrossRef] [PubMed] [Google Scholar]
- Paugh BS, Qu C, Jones C, et al. Integrated molecular genetic profiling of pediatric high-grade gliomas reveals key differences with the adult disease. J Clin Oncol 2010 ; 28 : 3061–3068. [CrossRef] [PubMed] [Google Scholar]
- Qu HQ, Jacob K, Fatet S, et al. Genome-wide profiling using single-nucleotide polymorphism arrays identifies novel chromosomal imbalances in pediatric glioblastomas. Neuro Oncol 2010 ; 12 : 153–163. [CrossRef] [PubMed] [Google Scholar]
- Yan H, Parsons DW, Jin G, et al. IDH1 and IDH2 mutations in gliomas. N Engl J Med 2009 ; 360 : 765–773. [CrossRef] [PubMed] [Google Scholar]
- Pollack IF, Finkelstein SD, Burnham J, et al. Age and TP53 mutation frequency in childhood malignant gliomas : results in a multi-institutional cohort. Cancer Res 2001 ; 61 : 7404–7407. [PubMed] [Google Scholar]
- Kreiger PA, Okada Y, Simon S, et al. Losses of chromosomes 1p and 19q are rare in pediatric oligodendrogliomas. Acta Neuropathol 2005 ; 109 : 387–392. [CrossRef] [PubMed] [Google Scholar]
- Paugh BS, Broniscer A, Qu C, et al. Genome-wide analyses identify recurrent amplifications of receptor tyrosine kinases and cell-cycle regulatory genes in diffuse intrinsic pontine glioma. J Clin Oncol 2011 ; 29 : 3999–4006. [CrossRef] [PubMed] [Google Scholar]
- Zarghooni M, Bartels U, Lee E, et al. Whole-genome profiling of pediatric diffuse intrinsic pontine gliomas highlights platelet-derived growth factor receptor alpha and poly (ADP-ribose) polymerase as potential therapeutic targets. J Clin Oncol 2010 ; 28 : 1337–1344. [CrossRef] [PubMed] [Google Scholar]
- Schwartzentruber J, Korshunov A, Liu XY, et al. Driver mutations in histone H3.3 and chromatin remodelling genes in paediatric glioblastoma. Nature 2012 ; 482 : 226–231. [CrossRef] [PubMed] [Google Scholar]
- Wu G, Broniscer A, McEachron TA, et al. Somatic histone H3 alterations in pediatric diffuse intrinsic pontine gliomas and non-brainstem glioblastomas. Nat Genet 2012 ; 44 : 251–253. [CrossRef] [PubMed] [Google Scholar]
- Khuong-Quang DA, Buczkowicz P, Rakopoulos P, et al. K27M mutation in histone H3.3 defines clinically and biologically distinct subgroups of pediatric diffuse intrinsic pontine gliomas. Acta Neuropathol 2012 ; 124 : 439–447. [CrossRef] [PubMed] [Google Scholar]
- Szenker E, Ray-Gallet D, Almouzni G. The double face of the histone variant H3.3. Cell Res 2011 ; 21 : 421–434. [CrossRef] [PubMed] [Google Scholar]
- Talbert PB, Henikoff S. Histone variants : ancient wrap artists of the epigenome. Nat Rev Mol Cell Biol 2010 ; 11 : 264–275. [CrossRef] [PubMed] [Google Scholar]
- Simon JA, Kingston RE. Mechanisms of polycomb gene silencing : knowns and unknowns. Nat Rev Mol Cell Biol 2009 ; 10 : 697–708. [CrossRef] [PubMed] [Google Scholar]
- Goldberg AD, Banaszynski LA, Noh KM, et al. Distinct factors control histone variant H3.3 localization at specific genomic regions. Cell 2010 ; 140 : 678–691. [CrossRef] [PubMed] [Google Scholar]
- Noushmehr H, Weisenberger DJ, Diefes K, et al. Identification of a CpG island methylator phenotype that defines a distinct subgroup of glioma. Cancer Cell 2010 ; 17 : 510–522. [CrossRef] [PubMed] [Google Scholar]
- Lu C, Ward PS, Kapoor GS, et al. IDH mutation impairs histone demethylation and results in a block to cell differentiation. Nature 2012 ; 483 : 474–478. [CrossRef] [PubMed] [Google Scholar]
- Baldewijns MM, van Vlodrop IJ, Schouten LJ, et al. Genetics and epigenetics of renal cell cancer. Biochim Biophys Acta 2008 ; 1785 : 133–155. [PubMed] [Google Scholar]
- Verreault M, Delattre JY, Ahmed Idbaih A. Les tumeurs gliales diffuses de l’adulte : hétérogénéité génétique et implications thérapeutiques. Med Sci (Paris) 2012 ; 28 : 812–816. [Google Scholar]
- Bourdeaut F, Celio Pouponnot C, Ayrault O. Les médulloblastomes et leurs cellules d’origine. Med Sci (Paris) 2012 ; 28 : 805–808. [Google Scholar]
- Ray-Gallet D, Gérard A, Polo S, Almouzni G. Variations sur le thème du « code histone ». Med Sci (Paris) 2005 ; 21 : 384–389. [Google Scholar]
- Bertin A, Mangenot S. Structure et dynamique de la particule cœur de nucléosome. Med Sci (Paris) 2008 ; 24 : 715–719. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2012 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1. Répartition anatomique des tumeurs présentant une mutation de H3.3 ou IDH1 en fonction de leur localisation et de l’âge des patients. La mutation K27M-H3.3 survient essentiellement dans les tumeurs de la ligne médiane, chez les enfants les plus jeunes (âge moyen de 7,4 ans). Les mutations G34R/V-H3.3 et celles d’IDH1/2 sont mutuellement exclusives et surviennent essentiellement dans les hémisphères cérébraux chez des patients plus âgés (âge moyen de 17,9 et 21,7 ans, respectivement). Les mutations d’ATRX surviennent surtout chez les enfants plus âgés, et plus particulièrement en association avec les mutations G34R/V-H3.3 et d’IDH1/2. |
| Dans le texte | |
 |
Figure 2. Représentation schématique de l’assemblage de la chromatine et de sa régulation A. L’ADN est compacté autour d’histones organisées en octamères qui contrôlent différents processus cellulaires tels que la réplication, la transcription ou la réparation de l’ADN. Les mutations K27M-H3.3 et G34R/V-H3.3 se situent au niveau ou à proximité de résidus de la queue de l’histone, affectant très probablement d’éventuelles modifications post-traductionnelles. B. Le complexe ATRX/DAXX permet l’intégration de H3.3 au niveau des télomères et de l’hétérochromatine. L’absence d’ATRX favoriserait un allongement des télomères, processus impliqué dans la transformation maligne d’une cellule. C. Proposition de modèle physiopathlogique des tumeurs gliales pédiatriques de haut grade (adapté de [19] et de [13]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




