| Issue |
Med Sci (Paris)
Volume 28, Number 6-7, Juin–Juillet 2012
|
|
|---|---|---|
| Page(s) | 582 - 584 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2012286009 | |
| Published online | 16 July 2012 | |
L’astrocyte, un partenaire clé des neurones au cours de la transmission synaptique de base
Astrocyte, a key partner of neurons during basal synaptic transmission
1
Département de Physiologie, Université de Montréal, Montréal, Québec, Canada
2
Groupe de Recherche sur le Système Nerveux Central, Université de Montréal, PO box 6128 Station centre-ville, Montréal, QC, H3C 3J7 Canada
3
Inserm U862, Neurocentre Magendie, UMR 5297, Institut Interdisciplinaire des Neurosciences, 146, rue Léo Saignat, 33077 Bordeaux Cedex, France
Le concept de la synapse tripartite
Le fonctionnement du cerveau repose sur la transmission d’information de neurone en neurone, à travers une structure spécialisée, la synapse. Très simplement : l’information se propage sous la forme d’un signal électrique, le potentiel d’action, le long de l’axone neuronal. Lorsque le potentiel d’action arrive au niveau de la terminaison synaptique (élément présynaptique), ce signal électrique est converti en un signal chimique. Les neurotransmetteurs libérés dans la fente synaptique activent par la suite des récepteurs présents sur l’élément postsynaptique, et l’information est transmise.
Il a longtemps été considéré que la transmission synaptique était uniquement une histoire de neurone. Cependant, en 1999, la synapse s’est complexifiée avec l’émergence du concept de la synapse tripartite qui considère les astrocytes comme des éléments fonctionnels des synapses [1]. Au cours de ces vingt dernières années, de nombreux travaux réalisés dans plusieurs régions du cerveau ont révélé que les astrocytes étaient capables de détecter les transmetteurs libérés dans la fente synaptique, et d’y répondre [2–4].
Les astrocytes appartiennent au groupe des cellules gliales qui, contrairement aux neurones, n’émettent pas de potentiel d’action. Parmi leurs nombreux rôles, les astrocytes régulent l’efficacité du transfert d’information en libérant par exemple des transmetteurs, appelés gliotransmetteurs (comme le glutamate, la D-sérine ou encore les purines) [5, 6]. Pour ce faire, au cours d’une activité synaptique intense qui recrute un réseau de neurones, les astrocytes détectent les neurotransmetteurs libérés dans la fente synaptique via des récepteurs exprimés à leur surface. L’activation de ces récepteurs provoque une augmentation de calcium dans les astrocytes. En retour, ces cellules gliales libèrent des gliotransmetteurs qui se lieront à des récepteurs soit neuronaux présynaptiques, soit neuronaux postsynaptiques, afin de réguler l’efficacité du transfert d’information [2, 3].
En accord avec la vision classique, les astrocytes détectent les transmetteurs libérés dans la fente synaptique en réponse à l’arrivée de plusieurs potentiels d’actions dans l’élément présynaptique. Cependant, en plus des activités synaptiques intenses faisant intervenir des réseaux synaptiques, la communication neuronale a aussi lieu au niveau de synapses individuelles, à des fréquences beaucoup plus faibles. Cette forme de communication détermine le tonus synaptique des neurones et façonne les mécanismes de plasticité synaptique qui sous-tendent diverses formes d’apprentissage. Afin de mieux comprendre comment l’information excitatrice glutamatergique est transmise dans le cerveau, nous avons voulu savoir si les astrocytes étaient également capables de détecter et de réguler la libération d’une seule vésicule de neurotransmetteurs (glutamate, neurotransmetteur excitateur) à la suite de l’arrivée présumée d’un seul potentiel d’action dans l’élément présynaptique [7]. Cette transmission, appelée transmission synaptique de base, est fondamentale pour le fonctionnement du cerveau.
Les astrocytes régulent la transmission synaptique de base
Cette étude a été réalisée dans des tranches « aiguës1 » d’hippocampe de rat (région CA1), une région du cerveau impliquée dans les processus de mémoire et d’apprentissage. Une combinaison d’approches de microscopie confocale et multiphotonique et d’enregistrements électrophysiologiques a été utilisée.
Les astrocytes sont caractérisés par la présence d’un prolongement principal et de nombreux prolongements qui leur confèrent une morphologie en forme « d’éponge ». Ces prolongements astrocytaires ne sont pas rectilignes. En effet, leur diamètre s’élargit le long de l’axe principal, puis s’affine à nouveau, délimitant des compartiments morphologiques (taille d’un compartiment mesurée le long de l’axe principal du prolongement : environ 1 µm). Tout d’abord, nous avons mis en évidence que ces compartiments sont fonctionnels : ils interagissent avec les synapses et expriment à leur surface des récepteurs glutamatergiques.
Au cours de la transmission synaptique de base, l’astrocyte détecte les molécules de glutamate libérées dans la fente synaptique via des récepteurs métabotropiques du glutamate de type 5 (mGluR5, Figure 1). L’activation de ces récepteurs conduit à une augmentation de calcium dans le compartiment astrocytaire. En retour, l’astrocyte libère des purines via un mécanisme mettant en jeu les protéines de type SNARE (soluble N-ethylmaleimide-sensitive factor attachment protein receptor), sensibles à la toxine tétanique. Une fois libérées dans la fente synaptique, les purines activent des récepteurs à l’adénosine de type A2A (A2AR) (Figure 1) présents sur la surface de l’élément neuronal présynaptique. L’activation de ces récepteurs conduit alors à une facilitation de la transmission synaptique de base au niveau de cette synapse (Figure 1).
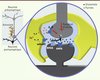 |
Figure 1. Les astrocytes facilitent la transmission synaptique de base. Représentation schématique résumant l’implication des astrocytes au cours de la transmission synaptique de base. AMPA et NMDA représentent les récepteurs glutamatergiques de type AMPA et NMDA. mGluR5, récepteur métabotropique du glutamate de type 5 ; A2AR, récepteur à l’adénosine de type A2A (adapté de [7]). |
En résumé, nos travaux indiquent que l’astrocyte est un partenaire clé des neurones au cours de la transmission synaptique de base. Tout comme les neurones, les astrocytes sont capables de traiter l’information localement, au niveau de compartiments fonctionnels. Il est important de noter que cette sensibilité astrocytaire a également été rapportée récemment dans une autre région de l’hippocampe [8]. Désormais, la communication élémentaire ne peut plus être considérée comme un phénomène uniquement neuronal.
Perspectives
Il semble que l’astrocyte agisse comme un intégrateur d’information, depuis la transmission synaptique de base - à l’échelle des synapses individuelles - jusqu’à l’activité synaptique intense, à l’échelle d’un réseau. En fonction du niveau et du patron d’activité synaptique, il est possible que le signal calcique se propage à l’échelle d’un prolongement, voir de la cellule dans son ensemble. Une étape supplémentaire serait de déterminer les conséquences (ou non) de ce signal calcique sur l’efficacité de la transmission au niveau des synapses voisines, avec lesquelles l’astrocyte est en interaction. Désormais, si nous voulons comprendre les fonctionnements et les dysfonctionnements du cerveau, nous devons considérer l’astrocyte comme un partenaire intime des neurones.
Liens d’Intérêt
Les auteurs déclarent n’avoir aucun lien d’intérêt concernant les données publiées dans cet article.
Références
- Araque A, Parpura V, Sanzgiri RP, Haydon PG. Tripartite synapses: glia, the unacknowledged partner. Trends Neurosci 1999 ; 22 : 208–215. [CrossRef] [PubMed] [Google Scholar]
- Perea G, Navarrete M, Araque A. Tripartite synapses: astrocytes process and control synaptic information. Trends Neurosci 2009 ; 32 : 421–431. [CrossRef] [PubMed] [Google Scholar]
- Halassa MM, Haydon PG. Integrated brain circuits: astrocytic networks modulate neuronal activity and behavior. Annu Rev Physiol 2010 ; 72 : 335–355. [CrossRef] [PubMed] [Google Scholar]
- Tasker JG, Oliet SH, Bains JS, et al. Glial regulation of neuronal function: from synapse to systems physiology. J Neuroendocrinol 2012 ; 24 : 566–576. [CrossRef] [PubMed] [Google Scholar]
- Volterra A, Meldolesi J. Astrocytes, from brain glue to communication elements: the revolution continues. Nat Rev Neurosci 2005 ; 6 : 626–640. [CrossRef] [PubMed] [Google Scholar]
- Parpura V, Heneka MT, Montana V, et al. Glial cells in (patho)physiology. J Neurochem 2012 ; 121 : 4–27. [CrossRef] [PubMed] [Google Scholar]
- Panatier A, Vallée J, Haber M, et al. Astrocytes are endogenous regulators of basal transmission at central synapses. Cell 2011 ; 146 : 785–798. [CrossRef] [PubMed] [Google Scholar]
- Di Castro MA, Chuquet J, Liaudet N, et al. Local Ca2+ detection and modulation of synaptic release by astrocytes. Nat Neurosci 2011 ; 14 : 1276–1284. [CrossRef] [PubMed] [Google Scholar]
© 2012 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1. Les astrocytes facilitent la transmission synaptique de base. Représentation schématique résumant l’implication des astrocytes au cours de la transmission synaptique de base. AMPA et NMDA représentent les récepteurs glutamatergiques de type AMPA et NMDA. mGluR5, récepteur métabotropique du glutamate de type 5 ; A2AR, récepteur à l’adénosine de type A2A (adapté de [7]). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




