| Issue |
Med Sci (Paris)
Volume 28, Number 1, Janvier 2012
|
|
|---|---|---|
| Page(s) | 9 - 10 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2012281002 | |
| Published online | 27 January 2012 | |
Mutation d’HSP110 dans les cancers colorectaux
Le paradoxe du chaperon qui ne protège plus
Mutation of HSP110 in colorectal cancer: the chaperone paradox
1
Inserm, UMRS 866, 21033 Dijon, France
2
université de Bourgogne, esplanade Érasme, 21078 Dijon, France
3
Inserm, UMRS 938 - centre de recherche Saint-Antoine, équipe instabilité des microsatellites et cancers, 75012, Paris, France
4
université Pierre et Marie Curie-Paris 6, Paris, France
Mutation de HSP110 dans les cancers colorectaux
Les protéines chaperons ou HSP (heat shock proteins) sont essentielles à la cellule. Elles se comportent comme des chaperons ou « capuchons moléculaires » pour d’autres protéines cellulaires, intervenant ainsi dans de nombreux processus biologiques. Chez les mammifères, il existe cinq principales familles de protéines HSP, classées en fonction de leurs poids moléculaires (HSP100, HSP90, HSP70, HSP60 et les petites HSP) (pour revue, voir [1]).
Certaines de ces protéines HSP sont surexprimées par les cellules tumorales, ce qui leur permet ainsi de s’adapter aux conditions environnementales qu’elles ont à affronter au cours du développement du cancer chez le patient ; l’expression accrue de ces HSP protège par exemple les cellules tumorales de la mort cellulaire, notamment celle qu’induisent les drogues utilisées lors du traitement des patients par chimiothérapie. Plusieurs inhibiteurs de protéines chaperons pourraient être inclus dans l’arsenal thérapeutique anticancéreux et sont actuellement testés dans des essais cliniques chez l’homme.
En collaboration avec l’équipe de Carmen Garrido, l’équipe d’Alex Duval a identifié la mutation d’un des gènes de la superfamille des HSP, le gène HSP110, dans des cancers colorectaux [2]. La protéine mutante perd plusieurs domaines protéiques essentiels à son activité. Elle se lie à la protéine HSP110 normale et l’empêche par là même de jouer son rôle de chaperon dans la cellule. Les cellules tumorales exprimant la protéine mutante sont fragilisées et montrent en particulier une sensibilité accrue aux chimiothérapies prescrites aujourd’hui dans le traitement des patients atteints de cancer du côlon, comme le 5-fluorouracile ou l’oxaliplatine. La protéine mutante est délocalisée dans le cytoplasme, contrairement à la protéine HSP110 sauvage dont la localisation est à la fois cytoplasmique et membranaire (Figure 1).
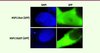 |
Figure 1. Expression de la protéine chaperon HSP110 dans la cellule tumorale colique. La protéine sauvage (Hsp110wt) présente une expression nucléaire et cytoplasmique. La protéine mutante (HSP110∆E9) présente une expression aberrante, restreinte au cytoplasme. GFP : green fluorescent protein ; DAPI : marqueur des noyaux. |
Mutation de HSP110 : un marqueur prédictif de la réponse thérapeutique
Sur un plan clinique, nous avons observé que la protéine mutante était présente à des taux variables chez 100 % des patients qui souffraient d’une forme particulière de cancer colorectal (CCR). Il s’agit des tumeurs du côlon appelées MSI (pour microsatellite instability), qui représentent 20 % environ de l’ensemble des CCR chez l’homme. De manière parfaitement concordante avec les résultats acquis in vitro dans des cultures de cellules tumorales, nous avons observé que les patients dont les tumeurs expriment fortement la protéine mutante (35 % des malades porteurs d’un CCR MSI environ) répondent très favorablement à la chimiothérapie puisqu’aucune rechute de la maladie n’est observée chez eux. À l’inverse, les patients qui expriment la protéine mutante à des taux plus faibles (65 % des patients porteurs d’un CCR MSI) répondent moins favorablement au traitement et leur maladie récidive. Ces derniers résultats sont particulièrement intéressants sur le plan clinique ; ils attestent en effet que la connaissance du statut dans la tumeur de la protéine HSP110 (forte ou faible expression) permet de prédire la réponse au traitement du patient. Celle-ci étant facilement déterminée en clinique, la prise en charge thérapeutique devrait donc être améliorée. C’est d’autant plus important que le cancer du côlon, un des cancers les plus fréquents dans le monde, représente la deuxième cause de mortalité par cancer chez l’homme, et que les patients bénéficiant d’une chimiothérapie sont ceux qui souffrent d’une forme grave et malheureusement fréquente de la maladie (tumeur invasive associée à des métastases locorégionales, au niveau ganglionnaire) [3]. À plus long terme, la découverte de nouveaux composés qui seraient capables de mimer l’effet chimiosensibilisant de la protéine HSP110 mutante dans la cellule cancéreuse constituerait une avancée significative dans le traitement du cancer.
Une mutation inattendue dans un contexte tumoral
Les cellules tumorales MSI [4–6] présentent un phénotype d’instabilité génomique particulier, consécutif au défaut fonctionnel du système MMR (mismatch repair), qui se caractérise par l’accumulation de nombreuses altérations dans les séquences répétées du génome, ou microsatellites [7, 8]. Il semble que le défaut d’expression du gène HSP110 dans ces tumeurs est consécutif à l’instabilité d’une séquence microsatellite de grande taille (répétition T17), localisée dans un intron et dont la mutation provoque un épissage aberrant par saut de l’exon 9 [2]. L’expression d’une protéine mutante comme la protéine HSP110∆E9 est un événement a priori surprenant puisque son action est délétère pour les cellules tumorales (rôle proapoptotique, effet chimiosensibilisant). Notre hypothèse pour expliquer la survenue fréquente d’un tel événement dans le cancer est que le mécanisme qui en est à l’origine, la délétion du microsatellite intronique T17, est probablement inévitable dans des cellules tumorales déficientes en MMR. En effet, ces clones déficients en MMR, dont l’index mitotique est souvent très élevé, ne sont pas en mesure de réparer les erreurs de réplication qui surviennent inéluctablement et à haute fréquence au niveau de telles répétitions génomiques introniques de grande taille. Cette hypothèse demande à être confirmée afin de percer le mystère de l’expression paradoxale du chaperon qui ne protège plus.
 |
Figure 2. Impact de l’expression du mutant chaperon HSP110ΔE9 dans la tumeur sur la réponse à la chimiothérapie des patients atteints de CCR MSI. L’expression forte du mutant HSP110ΔE9 dans la tumeur protège d’une rechute de la maladie après traitement par chimiothérapie. |
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Références
- Lanneau D, Wettstein G, Bonniaud P, Garrido C. Heat shock proteins : cell protection through protein triage. Scientific World Journal 2010 ; 10 : 1543–1552. [CrossRef] [Google Scholar]
- Dorard C, de Thonel A, Collura A, et al. Expression of a mutant HSP110 sensitizes colorectal cancer cells to chemotherapy and improves disease prognosis. Nat Med 2011 ; 17 : 1283–1289. [CrossRef] [PubMed] [Google Scholar]
- Zaanan A, Cuilliere-Dartigues P, Guilloux A, et al. Impact of p53 expression and microsatellite instability on stage III colon cancer disease-free survival in patients treated by 5-fluorouracil and leucovorin with or without oxaliplatin. Ann Oncol 2010 ; 21 : 772–780. [CrossRef] [PubMed] [Google Scholar]
- Thibodeau SN, Bren G, Schaid D. Microsatellite instability in cancer of the proximal colon. Science 1993 ; 260 : 816–819. [CrossRef] [PubMed] [Google Scholar]
- Ionov Y, Peinado MA, Malkhosyan S, Shibata D, Perucho M. Ubiquitous somatic mutations in simple repeated sequences reveal a new mechanism for colonic carcinogenesis. Nature 1993 ; 363 : 558–561. [CrossRef] [PubMed] [Google Scholar]
- Aaltonen LA, Peltomaki P, Leach FS, et al. Clues to the pathogenesis of familial colorectal cancer. Science 1993 ; 260 : 812–816. [CrossRef] [PubMed] [Google Scholar]
- Duval A, Hamelin R. Mutations at coding repeat sequences in mismatch repair-deficient human cancers : toward a new concept of target genes for instability. Cancer Res 2002 ; 62 : 2447–2454. [PubMed] [Google Scholar]
- Duval A, Hamelin R. Réparation des erreurs de réplication, microsatellites et cancer. Med Sci (Paris) 2003 ; 19 : 55–62. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
© 2012 médecine/sciences – Inserm / SRMS
Liste des figures
 |
Figure 1. Expression de la protéine chaperon HSP110 dans la cellule tumorale colique. La protéine sauvage (Hsp110wt) présente une expression nucléaire et cytoplasmique. La protéine mutante (HSP110∆E9) présente une expression aberrante, restreinte au cytoplasme. GFP : green fluorescent protein ; DAPI : marqueur des noyaux. |
| Dans le texte | |
 |
Figure 2. Impact de l’expression du mutant chaperon HSP110ΔE9 dans la tumeur sur la réponse à la chimiothérapie des patients atteints de CCR MSI. L’expression forte du mutant HSP110ΔE9 dans la tumeur protège d’une rechute de la maladie après traitement par chimiothérapie. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




