| Issue |
Med Sci (Paris)
Volume 27, Number 1, Janvier 2011
|
|
|---|---|---|
| Page(s) | 49 - 54 | |
| Section | M/S revues | |
| DOI | https://doi.org/10.1051/medsci/201127149 | |
| Published online | 10 February 2011 | |
La désimination ou citrullination
Une modification post-traductionnelle aux multiples facettes
Deimination or citrullination
A post-translational modification with many physiological and pathophysiological facets
UMR 5165 CNRS/Université Paul Sabatier, Hôpital Purpan, place du Docteur Baylac, TSA 40031, 31059 Toulouse Cedex 9, France
*
marie-claire.mechin@udear.cnrs.fr
La désimination, aussi nommée citrullination, est une modification post-traductionnelle aux multiples facettes. Elle est impliquée dans de nombreux processus cellulaires physiologiques comme la régulation génique, le développement embryonnaire ou encore la différenciation terminale, mais aussi dans divers mécanismes physiopathologiques liés à des maladies humaines graves, comme la sclérose en plaques ou la polyarthrite rhumatoïde. La désimination, conversion enzymatique dépendante du calcium de peptidyl-arginines en peptidyl-citrullines, entraîne une perte de charge des protéines-substrats, ce qui a des conséquences majeures sur leur conformation, leur stabilité, leurs interactions et donc leurs fonctions. Chez l’homme, il existe cinq isotypes de peptidyl-arginine désiminases (1-4 et 6) présentant une expression tissulaire variable. Ces isotypes sont très homologues et étroitement régulés aux niveaux transcriptionnel et post-transcriptionnel, comme, probablement, par auto-désimination.
Abstract
Deimination or citrullination, is a post-translational modification with many facets. It is involved in several basic cellular processes, including gene regulation, embryonic development and terminal differentiation, and also in various pathophysiological mechanisms linked to severe human diseases such as multiple sclerosis and rheumatoid arthritis. Deimination, the calcium-dependent enzymatic conversion of peptidyl-arginine to peptidyl-citrulline, induces a decrease in the charge of the modified proteins with major consequences on their conformation, stability and/or interactions, and therefore on their functions. Five isotypes of peptidylarginine deiminases (1-4 and 6), exist in humans with a variable tissue expression. These highly conserved enzymes are closely regulated at transcriptional and post-transcriptional levels, probably including auto-deimination.
© 2011 médecine/sciences – Inserm / SRMS
Les modifications post-traductionnelles comme la (dé)phosphorylation, la méthylation, la glycosylation ou même l’ubiquitinylation sont bien connues des biologistes et médecins. Il n’en est pas de même pour la désimination ou citrullination qui, bien que découverte au début des années 1970, est encore très peu connue. Cet article est une présentation générale de la désimination, des enzymes responsables de cette modification, les peptidyl-arginine désiminases (PAD), et de leurs multiples implications physiopathologiques.
L’épiderme, un excellent modèle pour l’étude des peptidyl-arginine désiminases et la désimination
Les PAD (EC 3.5.3.15), enzymes dépendantes du calcium, catalysent la réaction de désimination (Figure 1A). Elles transforment au sein d’une protéine les résidus arginyl- (chargés positivement) en résidus citrullyl- (neutres). Ceci entraîne une modification de la charge globale de la protéine cible. Il existe cinq gènes (PADI1 à 4 et 6) codant respectivement pour les PAD1, 2, 3, 4 et 6, regroupés en un seul locus (chromosome 1p35-36 chez l’homme) et conservés au cours de l’évolution [1] (Figure 1B). PAD6, d’expression restreinte principalement aux gonades, est nécessaire dès les premiers stades du développement embryonnaire [2, 3]. Les souris déficientes pour cet isotype sont infertiles, son absence entraînant une désorganisation du cytosquelette de l’œuf dès les premiers stades du développement [3]. PAD4 (initialement nommée PAD5) est largement exprimée dans les cellules hématopoïétiques et est impliquée dans plusieurs mécanismes physiologiques et physiopathologiques (voir paragraphes suivants). PAD3 comme PAD1 présentent des patrons d’expression tissulaire variables alors que PAD2 semble ubiquiste. L’épiderme normal est un excellent exemple d’expression différentielle de ces trois dernières PAD [4] (Figure 2A-B). En effet, PAD1 est présente dans ce tissu depuis la couche basale jusqu’à la couche granuleuse et sur toute la hauteur de la couche cornée. PAD2, moins bien caractérisée, semble présente dans les couches suprabasales. PAD3 est spécifiquement détectée dans la couche granuleuse et dans la couche cornée profonde. Les protéines désiminées, en revanche, ne sont détectables qu’au niveau de la couche cornée (Figure 1C) : elles correspondent d’une part aux kératines K1 et K10, deux protéines structurales constitutives des filaments intermédiaires (FI) du cytosquelette, et d’autre part à la filaggrine, une protéine associée aux FI. Nous avons montré que PAD1 et PAD3 sont les isotypes qui interviennent dans le catabolisme de la filaggrine, protéine-clé de la différenciation terminale des kératinocytes (cellules majoritaires de l’épiderme). Cette protéine permet l’hydratation physiologique de la couche cornée, nécessaire au maintien de diverses fonctions de barrière de l’épiderme, fonctions vitales assurant la protection de l’organisme contre les agressions physiques, chimiques ou biologiques (ultraviolets, stress mécaniques, micro-organismes pathogènes, allergènes, etc.). La désimination des monomères de filaggrine, nés du clivage de son précurseur, la profilaggrine, et secondairement associés aux FI de kératines, conduit à leur dissociation puis à leur protéolyse complète. La dégradation des monomères de filaggrine est alors assurée par une cascade de protéases faisant intervenir successivement la caspase 14, la calpaïne I et la bléomycine hydrolase. Ce processus aboutit à la production d’un pool d’acides aminés, constituants majeurs du facteur naturel d’hydratation (FNH) [5] (Figure 2C-D). Récemment, il a été montré que des mutations non-sens du gène FLG, codant la profilaggrine, sont responsables de l’ichtyose vulgaire1 et constituent un facteur de forte prédisposition à la dermatite atopique (appelée communément eczéma atopique). Ces deux maladies cutanées sont très fréquentes. Il est remarquable que l’incidence de la dermatite atopique, qui touche surtout les jeunes enfants, est en augmentation constante dans les pays industrialisés depuis les années 1960.
 |
Figure 1 La désimination (ou citrullination) : une modification post-traductionnelle peu connue. A. La réaction de désimination est réalisée par les peptidyl-arginine désiminases (PAD) en présence de calcium. Les atomes sont représentés par des disques de couleur : le carbone en noir, l’azote en bleu et l’oxygène en rouge. Les hydrogènes ne sont pas représentés. B. Chez l’homme, les cinq gènes PADI sont regroupés sur le chromosome 1 en un seul locus recouvrant plus de 300 kilobases (les tailles reportées sont en kb). Une région conservée intergénique (IG1) localisée à plus de 80 kb du gène PADI1 participe à la régulation transcriptionnelle à longue distance de PADI3 et vraisemblablement de PADI1, à travers la formation d’une boucle chromatinienne. C. Dans la peau, les protéines désiminées (ou citrullinées) sont détectées par immunoréaction au niveau de la couche cornée (CC) de l’épiderme avec un antisérum anti-citrulline modifiée (AMC) (barre = 20 μm). La jonction dermo-épidermique est notée par une ligne pointillée blanche. |
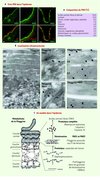 |
Figure 2 Les PAD1-3 et l’hydratation cutanée. A. Les PAD1-3 observées par immunomicroscopie confocale présentent une expression différentielle dans l’épiderme humain normal (barres = 10 μm). PAD1 et 3 colocalisent avec la filaggrine (Fil). B. En microscopie électronique : la filaggrine est immuno-détectée sur les grains de kératohyaline (GK) et dans la matrice des cornéocytes C1 à C4 ; PAD1 et PAD3 sont immunolocalisées sur les GK (images du milieu) et dans la matrice des cornéocytes (respectivement, C3-C4 et C3, images de droite). Barres = 200 nm ; billes d’or de 10 nm = filaggrine ; billes d’or de 5 nm = PAD1 ou PAD3 (flèches) ; des : desmosome. Les flèches correspondent aux billes d’or de 5 nm utilisées lors de l’immunomarquage en microscopie électronique avec les anticorps anti-PAD1 ou anti-PAD3. Ces flèches permettent de mieux repérer les petites billes de 5 nm, plus difficiles à voir que les billes de 10 nm correspondant, elles, à l’immunomarquage anti-filaggrine. C-D. Les PAD1 et PAD3 jouent un rôle-clé dans les dernières étapes du catabolisme de la filaggrine menant à la production du facteur naturel d’hydratation (FNH). |
Les cinq gènes PADI dérivent d’un ancêtre commun et ont divergé au fil de l’évolution ([1], et pour revue [6]). Leur organisation exons/introns est similaire et selon un alignement multiple global réalisé avec l’algorithme ClustalW, les séquences primaires des cinq PAD humaines présentent des pourcentages élevés d’identité entre paralogues (36 à 55 %) et encore plus élevés avec les séquences des Pad orthologues de souris ou de rat (72 à 94 %). Pourtant nous avons démontré que les isotypes 1 à 3 des PAD présentent des spécificités de substrat différentes et des sensibilités au calcium et au pH distinctes [7] et, plus récemment, qu’elles sont régulées de façon différentielle et à de multiples niveaux [8–11]. Des tests utilisant l’activité luciférase, réalisés dans des kératinocytes humains en culture primaire, ont montré que les gènes PADI1, 2 et 3 sont contrôlés au niveau transcriptionnel par des facteurs ubiquistes comme Sp1, Sp3, NF-Y et MZF1 qui se lient à leurs promoteurs minimaux, longs respectivement de 195, 132 et 129 paires de bases (pour revue voir [8]). Par ailleurs, l’étude d’un modèle de différenciation in vitro des kératinocytes induite par augmentation de la concentration en calcium démontre qu’un niveau de régulation supplémentaire, à longue distance, se met en place. L’expression du gène PADI3 est ainsi stimulée via la formation d’une large boucle chromatinienne et la fixation d’activateurs transcriptionnels de la famille AP-1 sur la région intergénique IG1, région conservée située à plus de 80 kb du promoteur minimal [9, 10] (Figure 1B). Parallèlement, nous avons montré qu’une stimulation transcriptionnelle de PADI1-3 par la vitamine D n’est pas suffisante pour induire l’augmentation des enzymes PAD1-3 correspondantes, ni la désimination des protéines des kératinocytes. En revanche, l’augmentation de la densité cellulaire, autre modèle d’induction de la différenciation des kératinocytes, induit l’expression des gènes PADI1 et 3, des enzymes PAD1 et 3 et de l’activité de désimination (accrue d’un facteur 12 environ) [11]. De plus, nous avons observé que les PAD1-3 sont capables de s’auto-désiminer in vitro et que cette auto-désimination réduit leur capacité à modifier la filaggrine [11]. Une approche in silico, utilisant des modèles tridimensionnels de PAD3 sur lesquels les arginines les plus accessibles ont été substituées par des citrullines, nous a permis d’évaluer l’effet de l’auto-désimination sur le site actif (Figure 3A-B). Celle-ci induit des changements de distance entre les quatre acides aminés majeurs (Asp-350, His-470, Asp-472 et Cys-646) du site actif, de l’ordre de 100 pm (jusqu’à 38 %), et des changements du volume de celui-ci d’environ 200 pm3 (environ 20 %) (Figure 3C). Ces changements structuraux sont vraisemblablement responsables de la réduction de l’activité PAD observée [11].
 |
Figure 3 Modèles tridimensionnels de PAD3 et auto-désimination. A. Forme inactive, en absence de calcium. B. Forme active, en présence de calcium (*, cinq sites fixent le calcium). La liaison du calcium induit un changement structural important de l’enzyme qui entraîne son activation. En effet, en présence de calcium, les dix acides aminés majeurs du site actif se rapprochent les uns des autres pour structurer un site fonctionnel (Arg-346 et Arg-372 sont représentées en rouge, Trp-347 en gris, Asp-350 et Asp-472 en bleu, Gly-374 en noir, Val-468 en rose, His-470 en violet, Leu-640 en jaune et Cys-646 en vert). C. Grandissement au niveau des quatre acides aminés majeurs du site actif. En bas, à gauche : forme inactive, en absence de calcium (PAD3 [W8] Arg) ; en bas, au milieu : forme active, en présence de calcium (PAD3 [W9] Arg) sans auto-désimination ; en bas, à droite : forme auto-désiminée (PAD3 [W9] Cit 60-40). L’auto-désimination in silico a consisté à modifier en citrullines les arginines les plus accessibles (accessibilité aux solvants ≥ 40 %). Les distances calculées sont indiquées en picomètres. L’auto-désimination induit un élargissement du site actif de PAD3 en présence de calcium, l’augmentation des distances entre les quatre acides aminés Asp-350 (Cγ, jaune), Asp-472 (Cγ, blanc), His-470 (Nδ1, rose) et Cys-646 (Sγ, orange) pouvant atteindre 38 %. |
La désimination est donc une modification post-traductionnelle très étroitement contrôlée, non seulement via la transcription des gènes PADI, mais aussi au niveau post-transcriptionnel et certainement au niveau post-traductionnel, par auto-désimination.
Implication de la désimination et des PAD dans de nombreuses maladies humaines graves
Cette modification post-traductionnelle et ces enzymes sont aussi largement étudiées dans la physiopathologie de maladies aussi diverses que la sclérose en plaques, la maladie d’Alzheimer, la polyarthrite rhumatoïde (PR) ou encore dans le contexte plus général de l’inflammation et du cancer (Tableau I).
Désimination, PAD et physiopathologies.
Dans le cerveau des patients atteints de sclérose en plaques, la protéine basique de la myéline est plus désiminée (45 % des arginines) que dans celui d’individus sains (20 %), avec un taux de désimination pouvant atteindre 90 % dans la forme fulminante de Marburg ([12] et pour revue [13]). La surexpression de Pad2 suffit à induire une démyélinisation des axones du système nerveux central des souris transgéniques induisant leur dégénérescence et mimant la maladie humaine [14]. Pour la maladie d’Alzheimer, c’est au Japon que les premiers travaux ont montré la présence de protéines structurales désiminées (vimentine et GFAP, glial fibrillary acidic protein) en quantité anormale dans l’hippocampe de cerveaux analysés post-mortem par immunohistologie, électrophorèse bidimensionnelle et spectrométrie de masse MALDI-TOF [15]. L’augmentation du taux de protéines citrullinées et la surexpression de Pad2 dans le cerveau de souris infectées par la protéine scrapie (souche ME7) tendent à prouver l’implication de cet isotype dans les maladies neurodégénératives à prions [16]. Tout récemment, une expression accrue de PAD2 et une augmentation de la désimination ont effectivement été démontrées chez l’homme dans des cas sporadiques de la maladie de Creutzfeldt-Jakob [17]. PAD2 et des taux anormalement élevés de désimination ont également été observés au niveau du nerf optique dans des cas de glaucome ou dans les cellules épithéliales des capsules de Bowman du rein lors du développement d’une néphropathie expérimentale (pour revue voir [6]). Dans ce dernier cas, PAD2 ciblerait également une protéine structurale majeure du cytosquelette, l’actine [18]. Pour les maladies cutanées, seule une diminution du niveau de désimination a été observée dans l’épiderme de patients atteints de psoriasis ou d’érythrodermie ichtyosiforme congénitale bulleuse [6].
Par ailleurs, notre laboratoire a été le premier à avoir identifié la cible des auto-anticorps anti-protéines citrullinées (ACPA) et à proposer leur implication dans la physiopathologie de la PR. Les ACPA sont très spécifiques de cette maladie auto-immune fréquente (0,5 à 1 % de la population mondiale) et souvent sévère. Ils apparaissent précocement chez les patients, avant même les premiers signes cliniques de la maladie. Ils sont donc d’un grand intérêt diagnostique ([19], et pour revue voir [20]). Ils sont très certainement des acteurs-clés dans l’auto-entretien de l’inflammation, cause de la destruction articulaire. La cible majeure des ACPA dans le tissu synovial des patients atteints de PR est la fibrine désiminée (chaînes α et β) [21]. En 2003, un lien génétique direct entre certains haplotypes portés par PADI4 et la susceptibilité à la PR a été observé dans des populations asiatiques [22]. Malgré une étude divergente [23], ce lien ne semble pas exister dans les populations caucasiennes (pour revue voir [24]). De plus, dans le tissu synovial des patients atteints de PR, les PAD2 et 4 ont été détectées à proximité des dépôts de fibrine désiminée, l’intensité de leur expression étant corrélée avec celle de l’inflammation [25]. Plus récemment, il a été montré que la protéolyse de l’extrémité amino-terminale de plusieurs cytokines/chémokines est régulée par désimination [26]. Dans le cas de l’IL-8 (interleukine-8, CXCL8), la désimination d’une seule arginine en position 5 réduit la liaison de l’IL-8 aux glycosaminoglycanes (héparine et héparine sulfate), sa protéolyse par la thrombine ou la plasmine et son activité chimiotactique vis-à-vis des polynucléaires neutrophiles. De manière plus générale, la désimination semble donc impliquée directement dans divers mécanismes moléculaires liés à l’inflammation.
Enfin, l’expression ectopique de PAD4 a été notée dans de nombreuses tumeurs, en particulier dans des adénocarcinomes [27]. Pourtant, la surexpression de PAD4 dans les cellules hématopoïétiques entraîne leur arrêt en phase G1 du cycle cellulaire et leur apoptose [28].
Désimination et noyau : du code « histone » au réseau chromatinien extracellulaire
PAD4 présente la singularité d’être aussi présente dans le noyau. En 2004, deux équipes indépendantes démontraient sa capacité à modifier en citrullines les arginines mono-méthylées des histones [29, 30]. En coordination avec d’autres modifications post-traductionnelles comme la méthylation des arginines des histones nucléosomales, la désimination joue donc aussi un rôle dans l’information épigénétique, participant à la plasticité du code « histone » (pour revue voir [31]) et donc au contrôle de l’expression génique. Il a ainsi été montré que la désimination des histones réprime l’expression de gènes induits par les œstrogènes ou par p53. Plus récemment, il a été montré que, dans des polynucléaires neutrophiles purifiés à partir de sang périphérique, l’activité de PAD4 entraîne, via la désimination des histones H3 et H4, la décondensation de la chromatine [32]. Ce processus semble mis en jeu lors de l’activation des neutrophiles au cours de la réponse inflammatoire ou dans la réponse innée antimicrobienne : un large réseau de chromatine extracellulaire associé à des protéines granulaires se forme qui, tel un filet, piège bactéries ou champignons qui sont ensuite tués à l’aide de peptides antimicrobiens [33].
La désimination est donc une modification post-traductionnelle importante tant en biologie qu’en médecine. Depuis les années 2000, le nombre de travaux suggérant son implication dans de nombreux processus physiologiques et physiopathologiques est en constante augmentation.
Les PAD sont exprimées différentiellement selon les tissus, elles jouent un rôle-clé dans le contrôle de la protéolyse de nombreuses protéines structurales et elles participent à la régulation de l’expression génique. Elles sont directement impliquées dans plusieurs maladies auto-immunes fréquentes et dans diverses maladies neurodégénératives, mais aussi plus généralement dans l’inflammation et, peut-être, dans le développement de certains cancers.
Ces connaissances ont déjà conduit au développement de nouveaux outils diagnostiques pour détecter les ACPA, permettant d’identifier la PR à un stade précoce, de la traiter plus tôt et ainsi d’empêcher son évolution destructrice.
Conflit d’intérêts
Les auteurs déclarent n’avoir aucun conflit d’intérêts concernant les données publiées dans cet article.
Remerciements
Nos travaux sont financés par l’Université Paul Sabatier Toulouse 3, le CNRS, l’Inserm et les hôpitaux de Toulouse. Ils sont soutenus également par la Société française de dermatologie (SFD), la Société de recherche dermatologique (SRD), la Fondation Arthritis - Jacques Courtin et l’Institut de recherche Pierre Fabre.
Pour des précisions concernant les différentes pathologies citées dans cet article, consulter le site internet de l’Online mendelian inheritance in man (ONIM) : http://www.ncbi.nlm.nih.gov/omim.
Références
- Chavanas S, Méchin MC, Takahara H, et al. Comparative analysis of the mouse and human peptidylarginine deiminase gene clusters reveals highly conserved non-coding segments and a new human gene, PADI6. Gene 2004 ; 330 : 19-27. [CrossRef] [PubMed] [Google Scholar]
- Wright PW, Bolling LC, Calvert ME, et al. ePAD, an oocyte and early embryo-abundant peptidylarginine deiminase-like protein that localizes to egg cytoplasmic sheets. Dev Biol 2003 ; 256 : 73-88. [PubMed] [Google Scholar]
- Esposito G, Vitale AM, Leijten FP, et al. Peptidylarginine deiminase (PAD) 6 is essential for oocyte cytoskeletal sheet formation and female fertility. Mol Cell Endocrinol 2007 ; 273 : 25-31. [CrossRef] [PubMed] [Google Scholar]
- Nachat R, Méchin MC, Takahara H, et al. Peptidylarginine deiminase isoforms 1-3 are expressed in the epidermis and involved in the deimination of K1 and filaggrin. J Invest Dermatol 2005 ; 124 : 384-393. [CrossRef] [PubMed] [Google Scholar]
- Kamata Y, Taniguchi A, Yamamoto M, et al. Neutral cysteine protease bleomycin hydrolase is essential for the breakdown of deiminated filaggrin into amino acids. J Biol Chem 2009 ; 284 : 12829-12836. [CrossRef] [PubMed] [Google Scholar]
- Méchin MC, Sebbag M, Arnaud J, et al. Update on peptidylarginine deiminases and deimination in skin physiology and severe human diseases. Int J Cosmet Sci 2007 ; 29 : 147-168. [CrossRef] [PubMed] [Google Scholar]
- Méchin MC, Enji M, Nachat R, et al. The peptidylarginine deiminases expressed in human epidermis differ in their substrate specificities and subcellular locations. Cell Mol Life Sci 2005 ; 62 : 1984-1995. [CrossRef] [PubMed] [Google Scholar]
- Ying S, Dong S, Kawada A, et al. Transcriptional regulation of peptidylarginine deiminase expression in human keratinocytes. J Dermatol Sci 2009 ; 53 : 2-9. [CrossRef] [PubMed] [Google Scholar]
- Adoue V, Chavanas S, Coudane F, et al. Long-range enhancer differentially regulated by c-Jun and JunD controls peptidylarginine deiminase-3 gene in keratinocytes. J Mol Biol 2008 ; 384 : 1048-1057. [CrossRef] [PubMed] [Google Scholar]
- Chavanas S, Adoue V, Méchin MC, et al. Long-range enhancer associated with chromatin looping allows AP-1 regulation of the peptidylarginine deiminase 3 gene in differentiated keratinocyte. PLoS One 2008 ; 3 : e3408. [CrossRef] [PubMed] [Google Scholar]
- Méchin MC, Coudane F, Adoue V, et al. Deimination is regulated at multiple levels including auto-deimination of peptidylarginine deiminases. Cell Mol Life Sci 2010 ; 67 : 1491-1503. [CrossRef] [PubMed] [Google Scholar]
- Wood DD, Bilbao JM, O’Connors P, Moscarello MA. Acute multiple sclerosis (Marburg type) is associated with developmentally immature myelin basic protein. Ann Neurol 1996 ; 40 : 18-24. [CrossRef] [PubMed] [Google Scholar]
- Moscarello MA, Mastronardi FG, Wood DD. The role of citrullinated proteins suggests a novel mechanism in the pathogenesis of multiple sclerosis. Neurochem Res 2007 ; 32 : 251-256. [CrossRef] [PubMed] [Google Scholar]
- Musse AA, Li Z, Ackerley CA, et al. Peptidylarginine deiminase 2 (PAD2) overexpression in transgenic mice leads to myelin loss in the central nervous system. Dis Model Mech 2008 ; 1 : 229-240. [Google Scholar]
- Ishigami A, Ohsawa T, Hiratsuka M, et al. Abnormal accumulation of citrullinated proteins catalyzed by peptidylarginine deiminase in hippocampal extracts from patients with Alzheimer’s disease. J Neurosci Res 2005 ; 80 : 120-128. [CrossRef] [PubMed] [Google Scholar]
- Jang B, Kim E, Choi JK, et al. Accumulation of citrullinated proteins by up-regulated peptidylarginine deiminase 2 in brains of scrapie-infected mice: a possible role in pathogenesis. Am J Pathol 2008 ; 173 : 1129-1142. [CrossRef] [PubMed] [Google Scholar]
- Jang B, Jin JK, Jeon YC, et al. Involvement of peptidylarginine deiminase-mediated post-translational citrullination in pathogenesis of sporadic Creutzfeldt-Jakob disease. Acta Neuropathol 2010 ; 119 : 199-210. [CrossRef] [PubMed] [Google Scholar]
- Feng D, Imasawa T, Nagano T, et al. Citrullination preferentially proceeds in glomerular Bowman’s capsule and increases in obstructive nephropathy. Kidney Int 2005 ; 68 : 84-95. [CrossRef] [PubMed] [Google Scholar]
- Vincent C, Nogueira L, Clavel C, et al. Autoantibodies to citrullinated proteins: ACPA. Autoimmunity 2005 ; 38 : 17-24. [CrossRef] [PubMed] [Google Scholar]
- Sebbag M, Clavel C, Nogueira L, et al. Autoimmune response to post-translationally modified (citrullinated) proteins: prime suspect in the pathophysiology of rheumatoid arthritis. In : Zouali M, ed. The epigenetics of autoimmune diseases. New York : Wiley, 2009 : 279-308. [CrossRef] [Google Scholar]
- Masson-Bessière C, Sebbag M, Girbal-Neuhauser E, et al. The major synovial targets of the rheumatoid arthritis-specific antifilaggrin autoantibodies are deiminated forms of the alpha- and beta-chains of fibrin. J Immunol 2001 ; 166 : 4177-4184. [PubMed] [Google Scholar]
- Suzuki A, Yamada R, Chang X, et al. Functional haplotypes of PADI4, encoding citrullinating enzyme peptidylarginine deiminase 4, are associated with rheumatoid arthritis. Nat Genet 2003 ; 34 : 395-402. [CrossRef] [PubMed] [Google Scholar]
- Gandjbakhch F, Fajardy I, Ferre B, et al. A functional haplotype of PADI4 gene in rheumatoid arthritis: positive correlation in a French population. J Rheumatol 2009 ; 36 : 881-886. [CrossRef] [PubMed] [Google Scholar]
- Burr ML, Naseem H, Hinks A, et al. PADI4 genotype is not associated with rheumatoid arthritis in a large UK Caucasian Population. Ann Rheum Dis 2010 ; 69 : 666-670. [CrossRef] [PubMed] [Google Scholar]
- Foulquier C, Sebbag M, Clavel C, et al. Peptidyl arginine deiminase type 2 (PAD-2) and PAD-4 but not PAD-1, PAD-3, and PAD-6 are expressed in rheumatoid arthritis synovium in close association with tissue inflammation. Arthritis Rheum 2007 ; 56 : 3541-3553. [CrossRef] [PubMed] [Google Scholar]
- Proost P, Loos T, Mortier A, et al. Citrullination of CXCL8 by peptidylarginine deiminase alters receptor usage, prevents proteolysis, and dampens tissue inflammation. J Exp Med 2008 ; 205 : 2085-2097. [CrossRef] [PubMed] [Google Scholar]
- Chang X, Han J, Pang L, et al. Increased PADI4 expression in blood and tissues of patients with malignant tumors. BMC Cancer 2009 ; 9 : 40. [CrossRef] [PubMed] [Google Scholar]
- Yao H, Li P, Venters BJ, et al. Histone Arg modifications and p53 regulate the expression of OKL38, a mediator of apoptosis. J Biol Chem 2008 ; 283 : 20060-20068. [CrossRef] [PubMed] [Google Scholar]
- Cuthbert GL, Daujat S, Snowden AW, et al. Histone deimination antagonizes arginine methylation. Cell 2004 ; 118 : 545-553. [CrossRef] [PubMed] [Google Scholar]
- Wang Y, Wysocka J, Sayegh J, et al. Human PAD4 regulates histone arginine methylation levels via demethylimination. Science 2004 ; 306 : 279-283. [CrossRef] [PubMed] [Google Scholar]
- Ray-Gallet D, Gerard A, Polo S, Almouzni G. Variations sur le thème du « code histone ». Med Sci (Paris) 2005 ; 21 : 384-389. [Google Scholar]
- Wang Y, Li M, Stadler S, et al. Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation. J Cell Biol 2009 ; 184 : 205-213. [CrossRef] [PubMed] [Google Scholar]
- Gougerot-Pocidalo MA, El Benna J, My-Chan Dang P, Elbim C. Quand les polynucléaires neutrophiles attrapent les agents pathogènes dans leurs filets. Med Sci (Paris) 2007 ; 23 : 464-465. [CrossRef] [EDP Sciences] [PubMed] [Google Scholar]
Liste des tableaux
Liste des figures
 |
Figure 1 La désimination (ou citrullination) : une modification post-traductionnelle peu connue. A. La réaction de désimination est réalisée par les peptidyl-arginine désiminases (PAD) en présence de calcium. Les atomes sont représentés par des disques de couleur : le carbone en noir, l’azote en bleu et l’oxygène en rouge. Les hydrogènes ne sont pas représentés. B. Chez l’homme, les cinq gènes PADI sont regroupés sur le chromosome 1 en un seul locus recouvrant plus de 300 kilobases (les tailles reportées sont en kb). Une région conservée intergénique (IG1) localisée à plus de 80 kb du gène PADI1 participe à la régulation transcriptionnelle à longue distance de PADI3 et vraisemblablement de PADI1, à travers la formation d’une boucle chromatinienne. C. Dans la peau, les protéines désiminées (ou citrullinées) sont détectées par immunoréaction au niveau de la couche cornée (CC) de l’épiderme avec un antisérum anti-citrulline modifiée (AMC) (barre = 20 μm). La jonction dermo-épidermique est notée par une ligne pointillée blanche. |
| Dans le texte | |
 |
Figure 2 Les PAD1-3 et l’hydratation cutanée. A. Les PAD1-3 observées par immunomicroscopie confocale présentent une expression différentielle dans l’épiderme humain normal (barres = 10 μm). PAD1 et 3 colocalisent avec la filaggrine (Fil). B. En microscopie électronique : la filaggrine est immuno-détectée sur les grains de kératohyaline (GK) et dans la matrice des cornéocytes C1 à C4 ; PAD1 et PAD3 sont immunolocalisées sur les GK (images du milieu) et dans la matrice des cornéocytes (respectivement, C3-C4 et C3, images de droite). Barres = 200 nm ; billes d’or de 10 nm = filaggrine ; billes d’or de 5 nm = PAD1 ou PAD3 (flèches) ; des : desmosome. Les flèches correspondent aux billes d’or de 5 nm utilisées lors de l’immunomarquage en microscopie électronique avec les anticorps anti-PAD1 ou anti-PAD3. Ces flèches permettent de mieux repérer les petites billes de 5 nm, plus difficiles à voir que les billes de 10 nm correspondant, elles, à l’immunomarquage anti-filaggrine. C-D. Les PAD1 et PAD3 jouent un rôle-clé dans les dernières étapes du catabolisme de la filaggrine menant à la production du facteur naturel d’hydratation (FNH). |
| Dans le texte | |
 |
Figure 3 Modèles tridimensionnels de PAD3 et auto-désimination. A. Forme inactive, en absence de calcium. B. Forme active, en présence de calcium (*, cinq sites fixent le calcium). La liaison du calcium induit un changement structural important de l’enzyme qui entraîne son activation. En effet, en présence de calcium, les dix acides aminés majeurs du site actif se rapprochent les uns des autres pour structurer un site fonctionnel (Arg-346 et Arg-372 sont représentées en rouge, Trp-347 en gris, Asp-350 et Asp-472 en bleu, Gly-374 en noir, Val-468 en rose, His-470 en violet, Leu-640 en jaune et Cys-646 en vert). C. Grandissement au niveau des quatre acides aminés majeurs du site actif. En bas, à gauche : forme inactive, en absence de calcium (PAD3 [W8] Arg) ; en bas, au milieu : forme active, en présence de calcium (PAD3 [W9] Arg) sans auto-désimination ; en bas, à droite : forme auto-désiminée (PAD3 [W9] Cit 60-40). L’auto-désimination in silico a consisté à modifier en citrullines les arginines les plus accessibles (accessibilité aux solvants ≥ 40 %). Les distances calculées sont indiquées en picomètres. L’auto-désimination induit un élargissement du site actif de PAD3 en présence de calcium, l’augmentation des distances entre les quatre acides aminés Asp-350 (Cγ, jaune), Asp-472 (Cγ, blanc), His-470 (Nδ1, rose) et Cys-646 (Sγ, orange) pouvant atteindre 38 %. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




