Figure 1
Télécharger l'image originale
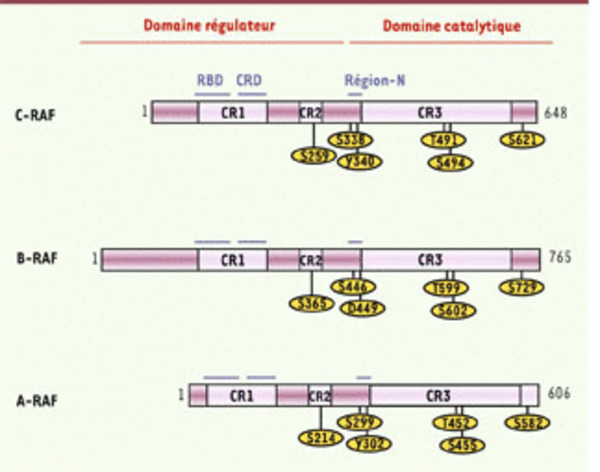
Structure des kinases RAF. Les isoformes de RAF (A-RAF, B-RAF, C-RAF) partagent trois régions conservées (les conserved regions CR1, CR2 et CR3). Le CR1 consiste en un domaine d’interaction avec RAS (Ras binding domain, RBD) suivi par un domaine riche en Cys (cystein rich domain, CRD), le CR2 est une région riche en résidus sérine/thréonine, et le CR3 porte l’activité kinase. Globalement, les kinases RAF sont ainsi organisées en deux parties fonctionnelles : un domaine aminoterminal régulateur, incluant CR1 et CR2, et un domaine carboxy-terminal catalytique. La présence d’une extension amino-terminale constitue la principale différence entre les isoformes de RAF. On peut noter l’existence d’une courte région localisée devant le domaine kinase, qui régule l’activation, appelée la N-région (pour marquer la présence de charges négatives à ce niveau). Plusieurs phosphorylations exerçant un rôle activateur sont concentrées dans la N-région, en particulier les résidus Ser 338 et Tyr 340 de C-RAF. Les phosphorylations activatrices directes de C-RAF portent également sur la boucle effectrice (Thr 491 et Ser 494). Le résidu Ser 621 constitue un résidu important pour le recrutement des protéines de la famille 14-3-3, car sa phosphorylation permet la formation de dimères entre C-RAF et B-RAF, ce qui constitue une étape importante de l’activation de ces kinases.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




