Figure 1.
Télécharger l'image originale
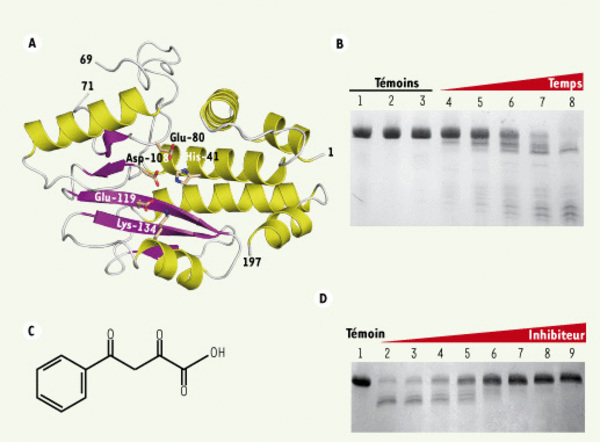
L’activité endonucléase de l’ARN polymérase du virus de la grippe est portée par le domaine PA-Nter. A. Structure tridimensionnelle du domaine PA-Nter. Les résidus formant le site actif sont annotés en fonction de leur position. B. Activité endonucléase manganèse-dépendante du domaine PA-Nter. Pour toutes les lignes, les concentrations en ARN, en protéine (PA-Nter) et en manganèse sont constantes, seul le temps de réaction varie entre les lignes 4 et 8 (respectivement 5, 10, 20, 40 et 80 minutes). La réaction est arrêtée par l’ajout d’EGTA (ethylene glycol tetraacetic acid) à une concentration finale de 1 mM. La ligne 1 correspond à l’ARN mis en présence de PA-Nter seul, la 2, l’ARN en présence de manganèse seul, la 3, l’ARN en présence de PA-Nter + manganèse + EGTA. C. Formule topologique de l’acide 2,4 dioxo-4-phénylbutanoïque. D. Inhibition de l’activité endonucléase de PA-Nter par l’acide 2,4 dioxo-4-phénylbutanoïque. Les concentrations du domaine PA-Nter, de l’ARN et du manganèse restent constantes. Les réactions se déroulent sur 40 minutes, seule la concentration en inhibiteur augmente entre la ligne 2 et la ligne 9 (respectivement 0, 6.5, 13, 20, 26, 40, 65, 130 µM). Un témoin de digestion a été réalisé en incubant l’ARN avec 1 mM de manganèse (ligne 1).
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




