| Issue |
Med Sci (Paris)
Volume 25, Number 1, Janvier 2009
|
|
|---|---|---|
| Page(s) | 37 - 44 | |
| Section | M/S revues | |
| DOI | https://doi.org/10.1051/medsci/200925137 | |
| Published online | 15 January 2009 | |
Des microparticules cellulaires dévoilent leur fonction fibrinolytique et protéolytique
Cell-derived microparticles unveil their fibrinolytic and proteolytic function
Inserm U919, Sérine Protéases et Physiopathologie de l’Unité neurovasculaire, CiNaps, UMR CNRS 6232, GIP Cyceron, boulevard Henri Becquerel, 14074 Caen Cedex, France
*
Eduardo.Angles-Cano@inserm.fr
Des microparticules cellulaires dont la taille varie entre 0,1 et 1 μm sont émises par des cellules activées ou en apoptose. Elles portent, associées à leur membrane, des protéines indiquant leur origine cellulaire et de la phosphatidylsérine qui transforme le feuillet membranaire externe en surface d’assemblage des facteurs de la coagulation. Cette propriété procoagulante est accentuée par la présence de facteur tissulaire (FT) sur certaines microparticules. Une nouvelle fonction pro-fibrinolytique et protéolytique est maintenant décrite pour des microparticules d’origine tumorale ou endothéliale portant des métalloprotéinases matricielles et/ou des composants du système d’activation du plasminogène. Ces microparticules concentrent le plasminogène à leur surface où il est transformé en plasmine par l’urokinase (uPA, urokinase plasminogen activator) liée à son récepteur uPAR. La fibrinolyse, la migration cellulaire, l’angiogenèse, la dissémination tumorale, ainsi que l’apoptose induite par le détachement cellulaire pourraient ainsi être modifiées par la présence de ces microparticules chargées en plasmine.
Abstract
Cell-derived microparticles (MP) are membrane microvesicles, 0.1-1 μm in size, shed by cells following activation or during apoptosis in a variety of pathological conditions. MPs released by blood cells or by vascular endothelial cells display molecular signatures that allow their identification and functional characterization. In addition, they provide tissue factor (TF) and a procoagulant phospholipid surface. Therefore, at present, the most strongly established applied research on MPs is their procoagulant activity as a determinant of thrombotic risk in various clinical conditions. Previous studies have indicated that MPs derived from malignant cells express matrix metalloproteinases, urokinase and its receptor (uPA/uPAR) that, in the presence of plasminogen, may act in concert to degrade extracellular matrix proteins. Recently, it was shown that MPs from TNFa-stimulated endothelial cells served as a surface for interaction with plasminogen and its conversion into plasmin by the uPA/ uPAR system expressed at their surface. This capacity of MPs to promote plasmin generation confers them a new profibrinolytic and proteolytic function that may be of relevance in fibrinolysis, cell migration, angiogenesis, dissemination of malignant cells, cell detachment and apoptosis.
© 2009 médecine/sciences - Inserm / SRMS
Origine et formation des microparticules
Les microparticules cellulaires (MP) sont des vésicules membranaires de petite taille (entre 0,1 et 1 µm) émises par des cellules activées ou en apoptose. Leur formation puis leur expulsion ont lieu à la suite d’un stimulus entraînant un influx calcique important [1, 2]. Cet influx calcique modifie l’activité des transporteurs transmembranaires des phospholipides (flippase, floppase et scramblase) qui, dans la cellule au repos, assurent le maintien de la phosphatidylsérine (PS) dans le feuillet cytoplasmique de la membrane [3]. La modification de l’activité de ces protéines conduit à l’exposition de la PS sur le feuillet membranaire externe, ce qui constitue une manifestation précoce de l’activation cellulaire et de l’apoptose [4]. L’augmentation de Ca2+ intracellulaire favorise également l’activation des calpaïnes intervenant dans la dissociation de structures membranaires du cytosquelette et favorisant le bourgeonnement de la membrane plasmique. L’ensemble de ces phénomènes conduit à la formation et à l’émission de MP portant à leur surface la PS (Figure 1), véritable stigmate reconnu par l’annexine V. Cette interaction entre la PS et l’annexine V est utilisée pour détecter et mesurer, principalement par cytométrie en flux, le nombre et la taille des MP présentes dans le sang circulant [5, 6]. Il est important de noter que la cytométrie en flux ne permet pas de détecter les MP dont la taille est inférieure à 300 nm, le nombre de MP obtenu par cette méthode reste donc sous-évalué
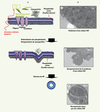 |
Figure 1. Formation d’une microparticule. A. Un stimulus induit un influx calcique important, entraînant une modification de l’activité des transporteurs (flippase, floppase et scramblase) gouvernant la répartition des phospholipides entre les deux feuillets membranaires. Ce même influx calcique entraîne une réorganisation du cytosquelette via l’activité protéolytique des calpaïnes. L’ensemble de ces événements conduit à un bourgeonnement de la membrane, puis à l’émission d’une microparticule exposant la phosphatidylsérine sur son feuillet externe. B. Aspect de la membrane plasmique d’une cellule CHO observée par microscopie électronique à transmission (1) au repos, (2), après stimulation par du plasminogène : vésiculation, et émission d’une microparticule (3). CHO : cellules ovariennes de hamster. |
La plupart des MP circulantes sont d’origine plaquettaire, mais le sang contient également des MP issues de leucocytes, de globules rouges et de cellules endothéliales [7–9]. Toute cellule vivante étant susceptible de produire des MP, la présence dans les fluides biologiques (sang, larmes, liquide céphalo-rachidien…) de MP d’origines cellulaires diverses serait la signature détectable d’un processus d’activation ou d’apoptose de cellules qui, séquestrées dans les tissus, sont inaccessibles à la détection par des moyens non invasifs.
L’exposition de la PS, le bourgeonnement membranaire et l’émission de MP précèdent généralement la fragmentation de l’ADN. Les MP émises après activation cellulaire se distinguent donc des corps apoptotiques qui sont en général de plus grande taille (> 1,5 µm) et englobent des fragments d’ADN. Les MP doivent également être distinguées des exosomes [10–12]. Ces petites vésicules d’origine endosomique, de taille (< 100 nm) inférieure à celle des MP, ont une composition protéique différente et sont sécrétées dans le milieu extracellulaire après fusion d’endosomes multivésiculaires avec la membrane plasmique. En raison de leur petite taille et de leur surface lipidique, les exosomes sont isolés par des centrifugations séquentielles suivies d’une centrifugation à très haute vitesse (100 000 g). La purification des MP suit également un protocole très précis comportant une succession de différentes centrifugations. Un consensus sur une méthode d’isolement n’a pas encore été obtenu (Tableau I), mais il paraît clair que la force gravitationnelle relative nécessaire pour sédimenter les MP (20 000 g, 45 à 90 min) est très différente de celle utilisée pour isoler les exosomes.
Différentes méthodes d’isolement des microparticules. CABA 1 : cellules issues de carcinome ovarien. U937 : lignées cellulaires issues de lymphomes monocytaires. HMEC-1 : cellules endothéliales microvasculaires. *Les MP obtenues par cette procédure contiendraient également des exosomes. LPS : lipopolysaccaride. TNF : tumor necrosis factor.
Molécules bioactives exprimées par les microparticules
Activité procoagulante des microparticules
Deux observations clés ont conduit à la découverte de MP procoagulantes dans le plasma frais dépourvu de plaquettes. Premièrement, l’identification par Chargaff (1946) d’une activité procoagulante dans le précipité obtenu par centrifugation de ce plasma à haute vitesse (30 000 g, 120 min) [13]. Puis, la confirmation par Wolf (1967) de ce phénomène et l’identification dans ces précipités, par microscopie électronique, de très petites particules d’origine plaquettaire [14]. Cette activité procoagulante des MP est associée à la présence de la PS dans le feuillet externe de la membrane et de facteur tissulaire (FT), une protéine transmembranaire synthétisée par les fibroblastes, les leucocytes et les cellules endothéliales. La PS joue un rôle pivot dans l’assemblage membranaire de facteurs de la coagulation et le FT est le principal initiateur de la séquence d’activation aboutissant à la formation de thrombine et, in fine, au caillot fibrino-plaquettaire. La description d’un défaut dans la translocation de phospholipides membranaires et dans la libération de MP plaquettaires, érythrocytaires et lymphocytaires chez des patients ayant un syndrome hémorragique (syndrome de Scott) a confirmé le rôle physiologique de ces MP dans la réponse hémostatique [15].
Ces caractéristiques, présence de PS et/ou de FT, ont orienté les travaux sur les MP dérivées de plaquettes ou de leucocytes vers l’étude de leur rôle dans la coagulation [7, 8]. Ainsi, leur activité procoagulante est actuellement considérée comme un déterminant du risque de thrombose au cours de plusieurs situations pathologiques [16, 17].
Reconnaître l’identité cellulaire des microparticules
L’activation cellulaire provoquée par différents types de stimulus (inflammatoires, physiques, chimiques, infectieux) se manifeste par l’expression de médiateurs cellulaires et de facteurs protéolytiques. Les MP émises expriment également ces molécules (Tableau II) et reflètent directement l’état d’activation cellulaire.
Composants cellulaires portés par les microparticules. Selon leur origine cellulaire, les MP portent des éléments variés avec des fonctions ou des effets pathologiques pouvant être transmis à d’autres cellules. *Les MP obtenues par cette procédure contiendraient également des exosomes. WEHI 274.1 : cellules monocytaires tumorales de souris. THP1 : lignées monocytaires. HUVEC : cellules endothéliales isolées de cordon ombilical. CHO : cellules ovariennes de hamster. CPT : Camptothécine. CCR5 : chemokine (C-C motif) receptor 5. LPS : lipopolysaccharide.
La présence de glycoprotéines membranaires spécifiques de la cellule parentale [16, 17] a permis d’identifier l’origine des MP (plaquettaire, endothéliale, leucocytaire et érythrocytaire), mais aussi de considérer leur présence dans la circulation comme un indicateur soit de lésion endothéliale [18–20] soit d’activation plaquettaire [7]. Hormis ces glycoprotéines identitaires et les composants procoagulants, des études in vitro montrent que les MP transportent également d’autres composants bioactifs dérivés de la cellule parentale (récepteurs membranaires, cytokines, facteurs de transcription, ARNm) [21, 22] (Tableau II). Récemment, une analyse protéomique a permis de détecter un nombre important de protéines dans des MP de plusieurs origines [23, 24].
Systèmes protéolytiques des microparticules
Des études récentes indiquent qu’à l’activité procoagulante caractéristique des MP circulantes, nous devons maintenant ajouter une fonction pro-fibrinolytique complémentaire. Dans cet article, nous faisons une analyse des travaux récents rapportant l’existence d’une activité fibrinolytique et protéolytique sur des MP cellulaires (Tableau III).
Éléments protéolytiques présents sur les microparticules. Deux grands systèmes protéolytiques sont présents dans les MP: le système d’activation du plasminogène et/ou les métalloprotéinases. *Les MP obtenues par cette procédure contiendraient également des exosomes. Lacroix et al. [23] ont montré que le plasminogène peut se lier à la surface de MP, notamment via des récepteurs de type a-énolase, et ainsi permettre la formation de plasmine à la surface des MP. HMEC-1 : cellules endothéliales microvasculaires. CABA 1 : cellules issues de carcinome ovarien. HUVEC : cellules endothéliales isolées de cordon ombilical. PCR3 : cellules cancéreuses prostatiques. MMP : metalloprotéases matricielles. TNF : tumor necrosis factor. uPAR : urokinase plasminogen activator receptor. PAI : plasminogen activator inhibitor.
En effet, en 2007, Lacroix et al. [25] ont attribué aux MP d’origine endothéliale la capacité de générer de la plasmine et de développer une activité fibrinolytique et protéolytique péricellulaire. D’autres études indiquent que des métalloprotéinases matricielles (MMP) présentes sur des MP issues de cellules cancéreuses pourraient également induire une activité protéolytique [26–29]. Cette nouvelle fonction des MP résulte de la présence, sur la cellule parentale, de ces deux systèmes protéolytiques : le système des MMP et le système d’activation du plasminogène (Figure 2).
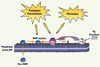 |
Figure 2. Interaction entre le système d’activation du plasminogène et les métalloprotéinases. Le plasminogène (Pg) circulant est concentré sur la membrane des microparticules (MP) par liaison aux résidus lysine de glycoprotéines membranaires via des sites de liaisons spécifiques. Il est transformé en plasmine (Pn) in situ par l’un des activateurs du plasminogène : l’uPA. La plasmine peut agir directement sur la fibrine (fibrinolyse) ou sur des protéines matricielles, ou encore en activant des pro-métalloprotéinases (pro-MMP) en MMP actives. |
Les MMP
Ce sont des endopeptidases sécrétées sous la forme de pro-enzymes (pro-MMP), dont l’activité dépend de leur activation et de l’incorporation du zinc dans le site catalytique [30]. Les 23 MMP actuellement décrites chez l’homme ont été initialement classifiées en fonction de leur spécificité pour un substrat (collagénase, gélatinase, stromelysine, matrilysine, métallo-élastase) et de leur localisation sur la membrane cellulaire (les membrane-type MMP, MT-MMP) [31]. Cependant, la multiplicité des substrats pour un même type de MMP a conduit à leur classification numérique (MMP-1, MMP-2 etc.). Les pro-MMP sont activées par un changement de conformation ou par une protéolyse limitée due à la plasmine ou à d’autres pro-MMP (Figure 2). La fonction des MMP activées est régulée par 4 types d’inhibiteurs de type tissulaire (TIMP-1 à TIMP-4, tissue inhibitor of metalloprotease).
Le système d’activation du plasminogène
Il est étroitement lié à la fibrinolyse et à la protéolyse péricellulaires [32]. La réaction centrale de ce système est la conversion du plasminogène en plasmine à la surface de la fibrine ou de la membrane cellulaire par l’activateur de type tissulaire (tPA) ou par l’activateur de type urokinase (uPA) lié à son récepteur spécifique l’uPAR. L’activation du plasminogène est conditionnée par une interaction entre ses sites de liaison et les résidus lysine en position carboxy-terminale présents dans des glycoprotéines de la membrane cellulaire, mais aussi de la matrice extracellulaire [33] ou de la fibrine (Figure 2). La plasmine générée in situ est capable de cliver des glycoprotéines membranaires, de dégrader directement certaines protéines de la matrice extracellulaire et la fibrine, mais aussi d’activer des précurseurs inactifs dont la pro-urokinase, des facteurs de croissance, ainsi que des MMP. Ce phénomène peut être inhibé tant au niveau des activateurs du plasminogène (par le plasminogen activator inhibitor, PAI-1) qu’au niveau de la plasmine (par l’a2-antiplasmine).
Le système d’activation du plasminogène, en étroite interaction avec le système des MMP, constitue la plus importante source d’activité protéolytique péricellulaire (dégradation de protéines matricielles, libération de facteurs de croissance de la cellule ou de la matrice extracellulaire, génération de molécules bioactives) au cours de l’inflammation, de l’angiogenèse [34] et de processus pathologiques comme les cancers [35] et l’athérosclérose [36]. Une défaillance de ce système peut conduire à des accidents ischémiques vasculaires. À l’opposé, différentes études montrent les conséquences dramatiques d’une protéolyse péricellulaire exacerbée sur l’adhérence, l’organisation et la survie cellulaires, pouvant aboutir au détachement de cellules de la matrice extracellulaire et à la mort cellulaire par apoptose [37].
Les métalloprotéinases matricielles (MMP)
Les cellules tumorales malignes possèdent un potentiel protéolytique important, caractérisé par la production de MMP et d’uPA, nécessaires à leur dissémination et à l’invasion tissulaire. Dans une série d’études publiées depuis 1994, la présence de ces enzymes protéolytiques a été identifiée, in vitro et in vivo [26, 27, 38–42], sur la membrane de vésicules tumorales isolées (par centrifugation à 100 000 g) de surnageants de culture de lignées tumorales humaines ou de liquides d’ascite obtenus chez des patientes atteintes de cancer ovarien [27, 40]. La détection de l’activité enzymatique par zymographie et de la protéine-support par immuno-empreinte a permis d’identifier l’uPA et son récepteur uPAR, la proMMP-2, la proMMP-9 et leurs formes actives, ainsi que des complexes entre les MMP et leur inhibiteur TIMP-1. Une corrélation positive a été trouvée entre la sévérité du cancer et la quantité de MP et des MMP. Une bande protéolytique ayant la masse moléculaire du tPA a été également détectée par zymographie dans des MP provenant d’une lignée de carcinome de la prostate [43]. Un modèle de matrice extracellulaire en trois dimensions (Matrigel) a permis de mettre en évidence une action concertée entre l’uPA et les pro-MMP des MP dans la dégradation de protéines matricielles en présence de plasminogène. Le mécanisme proposé suggère que la membrane de MP fonctionnerait en offrant une large surface d’activation de MMP via la formation de plasmine par l’uPA [27, 41, 42]. Ces résultats ont été récemment confirmés par l’étude des MP isolées d’ascites prélevées chez des sujets atteints de cancer de l’ovaire [29].
Les MMP sont également portées par des MP non tumorales, provenant par exemple de cellules endothéliales humaines. En effet, la présence de proMMP-2, proMMP-9, de leurs formes actives ainsi que celle de la MT1-MMP et des inhibiteurs TIMP-1 et TIMP-2 sur des MP obtenues de surnageants de culture de ces cellules a été démontrée par Taraboletti et al. [28]. Ces MP favorisent la migration de cellules endothéliales et modulent leur capacité angiogénique dans le Matrigel1 : l’effet stimulateur sur la formation de tubes, observé à de faibles concentrations de MP, se transforme en effet inhibiteur à des concentrations plus fortes, suggérant un défaut d’implantation cellulaire sur la matrice dégradée par l’activité protéolytique des MP.
Enfin, certains types de MP peuvent stimuler la production de MMP par des fibroblastes [44], des cellules endothéliales [45], ou des cellules malignes [46] et contribuer ainsi de manière indirecte à la protéolyse péricellulaire.
Il convient de signaler que dans les études que nous venons de citer [18, 22, 26–29, 38–45] les MP, appelées aussi microvésicules par ces auteurs, ont été isolées par centrifugation à 100 000 g. Nous ne pouvons donc pas écarter une contribution des exosomes à ces résultats.
Système d’activation du plasminogène
Hormis la présence du système uPA/uPAR sur la membrane de MP tumorales, démontrée par l’équipe de Dolo et al. [27], Brodsky et al. ont également rapporté la présence de l’uPAR sur des MP obtenues par stimulation de cellules endothéliales avec des concentrations élevées de PAI-1 [47].
Cependant, la réalité de la génération de plasmine à la surface des MP n’avait pas encore été déterminée, et c’est Lacroix et al. qui ont récemment décrypté les caractéristiques de cette réaction, dotant les MP d’une nouvelle fonction pro-fibrinolytique [25]. Ces auteurs ont montré que les MP endothéliales expriment des sites de liaison du plasminogène, en particulier l’a-énolase, qui joue un rôle pivot dans la fixation initiale du plasminogène via ses sites de liaison à la lysine. D’autres récepteurs du plasminogène, comme l’annexine II, pourraient être également présents sur les MP en fonction de leur origine cellulaire. L’uPA liée à son récepteur uPAR sur ces MP, transforme le plasminogène en plasmine, laquelle peut agir sur la fibrine ou participer à la dégradation de protéines matricielles directement ou en activant des MMP. Cette séquence de réactions ressemble au mécanisme d’activation du plasminogène décrit sur les surfaces cellulaires. La quantité de plasmine générée dépend de la concentration de plasminogène péricellulaire et de la charge en activateurs présents sur les MP. In vivo, les MP dotées de cette fonction pourraient donc former et transporter la plasmine et développer ainsi non seulement une activité fibrinolytique mais participer également à la migration cellulaire et à l’angiogenèse. En effet, tout comme pour les MMP exprimées par les MP endothéliales [28], on observe un effet-dose de la plasmine : à faibles doses les MP génératrices de plasmine favorisent la formation de tubules angiogéniques en Matrigel, mais, si la quantité de plasmine formée sur les MP est importante, la matrice est dégradée, ce qui favorise le détachement cellulaire et inhibe la formation de tubules. Reste à démontrer quelles conséquences in vivo aura cette série de réactions.
Plusieurs questions restent également posées quant au rôle de ces MP pro-fibrinolytiques dans la dissolution des caillots et à leur importance fonctionnelle dans la circulation. Hormis les MP d’origine cancéreuse ou articulaire (fibroblastes), d’autres types cellulaires pourraient également émettre des MP, ce qui devra être analysé dans d’autres études. Notamment, celles qui synthétisent un activateur qui, ancré à la membrane cellulaire, pourrait se retrouver sur les MP.
Conclusions
L’ensemble de ces études sur les systèmes protéolytiques présents à la surface de MP (Tableau III) d’origines cellulaires diverses montre leur importance dans la dégradation de la matrice extracellulaire, et donc leur impact potentiel dans des processus physiologiques comme la fibrinolyse, l’angiogenèse [25, 28, 46] mais aussi dans des pathologies comme le cancer [27, 29] ou encore l’arthrite rhumatoïde [44].
Bien que les MP issues de cellules sanguines circulantes et de cellules endothéliales aient été étudiées de façon approfondie, aucune de ces études ne mentionne la présence de tPA à la surface des MP. Pourtant, le tPA est connu pour son rôle important dans la fibrinolyse. Si la présence de cet activateur du plasminogène, synthétisé principalement par les cellules endothéliales et les neurones, pouvait être démontrée sur des MP, il serait plus aisé de montrer leur impact dans des pathologies comme les accidents vasculaire cérébraux.
Le Matrigel est une membrane basale soluble extraite de la tumeur EHS (Engelbreth-Holm-Swarm) qui en se solidifiant forme une structure proche d’une membrane basale. Ses composants principaux sont la laminine, le collagène IV, l’entactine et l’héparane sulfate. Des cellules endothéliales cultivées sur ce support adoptent une organisation de tubes mimant la formation de capillaires.
Remerciements
Nous exprimons nos remerciements à Laurent Plawinski pour ses commentaires et critiques, à Didier Goux pour son expertise en microscopie électronique et aux experts pour leurs critiques constructives. LD et EAC sont membres du Septième Programme Cadre de la Communauté Européenne (FP7/2007-2013, grant n° 201024). Le projet sur les microparticules est développé dans le cadre d’un contrat d’interface Inserm-CHU de Caen octroyé à EAC.
Références
- Zwaal RF, Schroit AJ. Pathophysiologic implications of membrane phospholipid asymmetry in blood cells. Blood 1997; 89 : 1121–32. [Google Scholar]
- Dachary-Prigent J, Pasquet JM, Freyssinet JM, et al. Calcium involvement in aminophospholipid exposure and microparticle formation during platelet activation: a study using Ca2+-ATPase inhibitors. Biochemistry 1995; 34 : 11625–34. [Google Scholar]
- Martinez MC, Kunzelmann C, Freyssinet JM. Remodelage de la membrane plasmique et stimulation cellulaire. Med Sci (Paris) 2004; 20 : 189–95. [Google Scholar]
- Blanc L, Vidal M. Le signal eat-me des exosomes de réticulocytes. Med Sci (Paris) 2008; 24 : 462–3. [Google Scholar]
- Jy W, Horstman LL, Jimenez JJ, et al. Measuring circulating cell-derived microparticles. J Thromb Haemost 2004; 2 : 1842–51. [Google Scholar]
- Enjeti AK, Lincz LF, Seldon M. Detection and measurement of microparticles: an evolving research tool for vascular biology. Semin Thromb Hemost 2007; 33 : 771–9. [Google Scholar]
- Diamant M, Tushuizen ME, Sturk A, et al. Cellular microparticles: new players in the field of vascular disease ? Eur J Clin Invest. 2004; 34 : 392–401. [Google Scholar]
- Morel O, Morel N, Freyssinet JM, et al. Platelet microparticles and vascular cells interactions: A checkpoint between the haemostatic and thrombotic responses. Platelets 2008; 19 : 9–23. [Google Scholar]
- Boulanger CM, Amabile N, Tedgui A. Circulating microparticles: a potential prognostic marker for atherosclerotic vascular disease. Hypertension 2006; 48 : 180–6. [Google Scholar]
- Horstman LL, Jy W, Minagar A, et al. Cell-derived microparticles and exosomes in neuroinflammatory disorders. Int Rev Neurobiol 2007; 79 : 227–68. [Google Scholar]
- Heijnen HF, Schiel AE, Fijnheer R, et al. Activated platelets release two types of membrane vesicles: microvesicles by surface shedding and exosomes derived from exocytosis of multivesicular bodies and alpha-granules. Blood 1999; 94 : 3791–9. [Google Scholar]
- Chimini G. Le récepteur des phosphatidylsérines, une arlésienne qui nous surprend toujours. Med Sci (Paris) 2004; 20 : 501–2. [Google Scholar]
- Chargaff E, West R. The biological significance of the thromboplastic protein of blood. J Biol Chem 1946; 166 : 189–97. [Google Scholar]
- Wolf P. The nature and significance of platelet products in human plasma. Br J Haematol 1967; 13 : 269–88. [Google Scholar]
- Sims PJ, Wiedmer T, Esmon CT, et al. Assembly of the platelet prothrombinase complex is linked to vesiculation of the platelet plasma membrane. Studies in Scott syndrome: an isolated defect in platelet procoagulant activity. J Biol Chem 1989; 264 : 17049–57. [Google Scholar]
- Lynch SF, Ludlam CA. Plasma microparticles and vascular disorders. Br J Haematol 2007; 137 : 36–48. [Google Scholar]
- Morel O, Toti F, Hugel B, et al. Procoagulant microparticles: disrupting the vascular homeostasis equation ? Arterioscler Thromb Vasc Biol 2006; 26 : 2594–604. [Google Scholar]
- Combes V, Simon AC, Grau GE, et al. In vitro generation of endothelial microparticles and possible prothrombotic activity in patients with lupus anticoagulant. J Clin Invest 1999; 104 : 93–102. [Google Scholar]
- Jimenez JJ, Jy W, Mauro LM, et al. Endothelial microparticles (EMP) as vascular disease markers. Adv Clin Chem 2005; 39 : 131–57. [Google Scholar]
- Abid Hussein MN, Meesters EW, Osmanovic N, et al. Antigenic characterization of endothelial cell-derived microparticles and their detection ex vivo. J Thromb Haemost 2003; 1 : 2434–43. [Google Scholar]
- Morel O, Toti F, Hugel B, et al. Cellular microparticles: a disseminated storage pool of bioactive vascular effectors. Curr Opin Hematol 2004; 11 : 156–64. [Google Scholar]
- Deregibus MC, Cantaluppi V, Calogero R, et al. Endothelial progenitor cell derived microvesicles activate an angiogenic program in endothelial cells by a horizontal transfer of mRNA. Blood 2007; 110 : 2440–8. [Google Scholar]
- Smalley DM, Root KE, Cho H, et al. Proteomic discovery of 21 proteins expressed in human plasma-derived but not platelet-derived microparticles. Thromb Haemost 2007; 97 : 67–80. [Google Scholar]
- Miguet L, Pacaud K, Felden C, et al. Proteomic analysis of malignant lymphocyte membrane microparticles using double ionization coverage optimization. Proteomics 2006; 6 : 153–71. [Google Scholar]
- Lacroix R, Sabatier F, Mialhe A, et al. Activation of plasminogen into plasmin at the surface of endothelial microparticles: a mechanism that modulates angiogenic properties of endothelial progenitor cells in vitro. Blood 2007; 110 : 2432–9. [Google Scholar]
- Dolo V, Ginestra A, Ghersi G, et al. Human breast carcinoma cells cultured in the presence of serum shed membrane vesicles rich in gelatinolytic activities. J Submicrosc Cytol Pathol 1994; 26 : 173–80. [Google Scholar]
- Dolo V, D’Ascenzo S, Violini S, et al. Matrix-degrading proteinases are shed in membrane vesicles by ovarian cancer cells in vivo and in vitro. Clin Exp Metastasis 1999; 17 : 131–40. [Google Scholar]
- Taraboletti G, D’Ascenzo S, Borsotti P, et al. Shedding of the matrix metalloproteinases MMP-2, MMP-9, and MT1-MMP as membrane vesicle-associated components by endothelial cells. Am J Pathol 2002; 160 : 673–80. [Google Scholar]
- Graves LE, Ariztia EV, Navari JR, et al. Proinvasive properties of ovarian cancer ascites-derived membrane vesicles. Cancer Res 2004; 64 : 7045–9. [Google Scholar]
- Page-McCaw A, Ewald AJ, Werb Z. Matrix metalloproteinases and the regulation of tissue remodelling. Nat Rev Mol Cell Biol 2007; 8 : 221–33. [Google Scholar]
- Khrestchatisky M, Rivera S, Jourquin J, et al. Le système MMP/TIMP dans le système nerveux. Med Sci (Paris) 2004; 20 : 55–60. [Google Scholar]
- Lijnen HR. Elements of the fibrinolytic system. Ann NY Acad Sci 2001; 936 : 226–36. [Google Scholar]
- Miles LA, Hawley SB, Baik N, et al. Plasminogen receptors: the sine qua non of cell surface plasminogen activation. Front Biosci 2005; 10 : 1754–62. [Google Scholar]
- Pepper MS. Angiogenèse et morphogenèse de l’arbre vasculaire : de la biologie cellulaire à la clinique. Med Sci (Paris) 2000; 16 : 1378–86. [Google Scholar]
- Dano K, Behrendt N, Hoyer-Hansen G, et al. Plasminogen activation and cancer. Thromb Haemost 2005; 93 : 676–81. [Google Scholar]
- Garcia-Touchard A, Henry TD, Sangiorgi G, et al. Extracellular proteases in atherosclerosis and restenosis. Arterioscler Thromb Vasc Biol 2005; 25 : 1119–27. [Google Scholar]
- Rossignol P, Luttun A, Martin-Ventura JL, et al. Plasminogen activation: a mediator of vascular smooth muscle cell apoptosis in atherosclerotic plaques. J Thromb Haemost 2006; 4 : 664–70. [Google Scholar]
- Dolo V, Ginestra A, Cassara D, et al. Selective localization of matrix metalloproteinase 9, beta1 integrins, and human lymphocyte antigen class I molecules on membrane vesicles shed by 8701-BC breast carcinoma cells. Cancer Res 1998; 58 : 4468–74. [Google Scholar]
- Ginestra A, La Placa MD, Saladino F, et al. The amount and proteolytic content of vesicles shed by human cancer cell lines correlates with their in vitro invasiveness. Anticancer Res 1998; 18 : 3433–7. [Google Scholar]
- Ginestra A, Miceli D, Dolo V, et al. Membrane vesicles in ovarian cancer fluids: a new potential marker. Anticancer Res 1999; 19 : 3439–45. [Google Scholar]
- Ginestra A, Monea S, Seghezzi G, et al. Urokinase plasminogen activator and gelatinases are associated with membrane vesicles shed by human HT1080 fibrosarcoma cells. J Biol Chem 1997; 272 : 17216–22. [Google Scholar]
- Angelucci A, D’Ascenzo S, Festuccia C, et al. Vesicle-associated urokinase plasminogen activator promotes invasion in prostate cancer cell lines. Clin Exp Metastasis 2000; 18 : 163–70. [Google Scholar]
- Millimaggi D, Festuccia C, Angelucci A, et al. Osteoblast-conditioned media stimulate membrane vesicle shedding in prostate cancer cells. Int J Oncol 2006; 28 : 909–14. [Google Scholar]
- Distler JHW, Jüngel A, Huber LC, et al. The induction of matrix metalloproteinase and cytokine expression in synovial fibroblasts stimulated with immune cell microparticles. Proc Natl Acad Sci USA 2005; 102 : 2892–7. [Google Scholar]
- Millimaggi D, Mari M, D’Ascenzo S, et al. Tumor vesicle-associated CD147 modulates the angiogenic capability of endothelial cells. Neoplasia 2007; 9 : 349–57. [Google Scholar]
- Janowska-Wieczorek A, Wysoczynski M, Kijowski J, et al. Microvesicles derived from activated platelets induce metastasis and angiogenesis in lung cancer. Int J Cancer 2005; 113 : 752–60. [Google Scholar]
- Brodsky SV, Malinowski K, Golightly M, et al. Plasminogen activator inhibitor-1 promotes formation of endothelial microparticles with procoagulant potential. Circulation 2002; 106 : 2372–8. [Google Scholar]
- Gross PL, Furie BC, Merrill-Skoloff G, et al. Leukocyte-versus microparticle-mediated tissue factor transfer during arteriolar thrombus development. J Leukoc Biol 2005; 78 : 1318–26. [Google Scholar]
- Del Conde I, Shrimpton CN, Thiagarajan P, et al. Tissue-factor-bearing microvesicles arise from lipid rafts and fuse with activated platelets to initiate coagulation. Blood 2005; 106 : 1604–11. [Google Scholar]
- Abrahams VM, Straszewski SL, Kamsteeg M, et al. Epithelial ovarian cancer cells secrete functional Fas ligand. Cancer Res 2003; 63 : 5573–81. [Google Scholar]
- Simák J, Holada K, D’Agnillo F, et al. Cellular prion protein is expressed on endothelial cells and is released during apoptosis on membrane microparticles found in human plasma. Transfusion 2002; 42 : 334–42. [Google Scholar]
- Mack M, Kleinschmidt A, Brühl H, et al. Transfer of the chemokine receptor CCR5 between cells by membrane-derived microparticles: a mechanism for cellular human immunodeficiency virus 1 infection. Nat Med 2000; 6 : 769–75. [Google Scholar]
Liste des tableaux
Différentes méthodes d’isolement des microparticules. CABA 1 : cellules issues de carcinome ovarien. U937 : lignées cellulaires issues de lymphomes monocytaires. HMEC-1 : cellules endothéliales microvasculaires. *Les MP obtenues par cette procédure contiendraient également des exosomes. LPS : lipopolysaccaride. TNF : tumor necrosis factor.
Composants cellulaires portés par les microparticules. Selon leur origine cellulaire, les MP portent des éléments variés avec des fonctions ou des effets pathologiques pouvant être transmis à d’autres cellules. *Les MP obtenues par cette procédure contiendraient également des exosomes. WEHI 274.1 : cellules monocytaires tumorales de souris. THP1 : lignées monocytaires. HUVEC : cellules endothéliales isolées de cordon ombilical. CHO : cellules ovariennes de hamster. CPT : Camptothécine. CCR5 : chemokine (C-C motif) receptor 5. LPS : lipopolysaccharide.
Éléments protéolytiques présents sur les microparticules. Deux grands systèmes protéolytiques sont présents dans les MP: le système d’activation du plasminogène et/ou les métalloprotéinases. *Les MP obtenues par cette procédure contiendraient également des exosomes. Lacroix et al. [23] ont montré que le plasminogène peut se lier à la surface de MP, notamment via des récepteurs de type a-énolase, et ainsi permettre la formation de plasmine à la surface des MP. HMEC-1 : cellules endothéliales microvasculaires. CABA 1 : cellules issues de carcinome ovarien. HUVEC : cellules endothéliales isolées de cordon ombilical. PCR3 : cellules cancéreuses prostatiques. MMP : metalloprotéases matricielles. TNF : tumor necrosis factor. uPAR : urokinase plasminogen activator receptor. PAI : plasminogen activator inhibitor.
Liste des figures
 |
Figure 1. Formation d’une microparticule. A. Un stimulus induit un influx calcique important, entraînant une modification de l’activité des transporteurs (flippase, floppase et scramblase) gouvernant la répartition des phospholipides entre les deux feuillets membranaires. Ce même influx calcique entraîne une réorganisation du cytosquelette via l’activité protéolytique des calpaïnes. L’ensemble de ces événements conduit à un bourgeonnement de la membrane, puis à l’émission d’une microparticule exposant la phosphatidylsérine sur son feuillet externe. B. Aspect de la membrane plasmique d’une cellule CHO observée par microscopie électronique à transmission (1) au repos, (2), après stimulation par du plasminogène : vésiculation, et émission d’une microparticule (3). CHO : cellules ovariennes de hamster. |
| Dans le texte | |
 |
Figure 2. Interaction entre le système d’activation du plasminogène et les métalloprotéinases. Le plasminogène (Pg) circulant est concentré sur la membrane des microparticules (MP) par liaison aux résidus lysine de glycoprotéines membranaires via des sites de liaisons spécifiques. Il est transformé en plasmine (Pn) in situ par l’un des activateurs du plasminogène : l’uPA. La plasmine peut agir directement sur la fibrine (fibrinolyse) ou sur des protéines matricielles, ou encore en activant des pro-métalloprotéinases (pro-MMP) en MMP actives. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




