| Issue |
Med Sci (Paris)
Volume 24, Number 10, Octobre 2008
|
|
|---|---|---|
| Page(s) | 885 - 890 | |
| Section | Recherche et partenariat | |
| DOI | https://doi.org/10.1051/medsci/20082410885 | |
| Published online | 15 October 2008 | |
L’Initiative Médicaments Innovants
Développement de l’innovation biomédicale en Europe
The Innovative Medicine Initiative (IMI)
1
Institut de Recherches Servier
2
Institut de Recherches Internationales Servier
L’initiative médicaments innovants (IMI) est l’une des initiatives technologiques conjointes mise en oeuvre dans le cadre du 7e programme cadre Recherche et Développement communautaire (2007-2013). Lancée par la Commission Européenne et la Fédération Européenne des Industries et Associations Pharmaceutiques, elle a pour objectif d’identifier et lever les « goulots d’étranglements » de la recherche et du développement de nouveaux candidats médicaments. IMI, officiellement lancée le 30 avril 2008, renforcera les possibilités de partenariats public-privé en focalisant des efforts de recherche sur les éléments critiques de la découverte de nouveaux candidats médicaments tels que la prédiction de l’efficacité et de la sécurité, la gestion des connaissances et la formation. Cette initiative renforcera l’attractivité de l’Europe dans les sciences biomédicales et à terme conduira à apporter de nouveaux traitements au profit des malades.
Abstract
The Innovative Medicine Initiative (IMI) is a joint technology initiative jointly implemented by the European Commission and by the European Federation of Pharmaceutical Industries and Associations (EFPIA). The objective of IMI, officially launched on April 30th 2008, is to identify and address the bottlenecks of the drug discovery and development process. IMI will reinforce the public-private partnerships and will be focused towards critical nodes of the drug discovery such as efficacy predictivity, safety predictivity, knowledge management and education and training. This initiative will also reinforce the attractivity of Europe for biomedical science and will then lead to the discovery of novel therapeutic strategies for the patients.
© 2008 médecine/sciences - Inserm / SRMS
L’Initiative Médicaments Innovants, IMI, est une « initiative technologique conjointe » officiellement lancée à Bruxelles le 30 avril 2008, mise en œuvre par la Commission Européenne et la Fédération Européenne des Industries et Associations Pharmaceutiques (EFPIA) dans le but d’améliorer les processus de découverte de nouveaux médicaments et d’augmenter la compétitivité de l’Europe dans le secteur biopharmaceutique. Par la mise en place d’une nouvelle structure de partenariats public-privé, IMI conduira à lever certains des « goulots d’étranglement » rencontrés dans le processus de la découverte des médicaments et, par une meilleure coopération entre acteurs, permettra de mettre à la disposition des malades des traitements mieux adaptés, plus efficaces et avec un niveau de sécurité amélioré.
Dans le cadre de cet article il a été souhaité non seulement faire une présentation générale de IMI mais surtout apporter des éléments concrets concernant la mise en œuvre des partenariats et également introduire les priorités scientifiques retenues pour les premiers appels à projets, c’est-à-dire les axes de recherche qui forment les premières pierres d’une recherche précompétitive1 européenne.
Pourquoi IMI : définition et organisation de IMI
La recherche et le développement d’un médicament nouveau, c’est-à-dire la traduction d’une nouvelle cible moléculaire en une nouvelle thérapie ayant une efficacité démontrée, sont des processus longs et complexes. En moyenne, sur plus de 10 000 molécules évaluées durant les phases de recherche préclinique, seule une passera l’ensemble des étapes lui permettant d’être mise à la disposition des patients. La probabilité pour une molécule nouvelle de passer les phases de recherche préclinique, c’est-à-dire de la première étude réglementaire de toxicologie à la mise sur le marché, est voisine de 6 % [1]. Les raisons principales qui conduisent à arrêter le développement d’un candidat médicament sont dans 25 % des cas le manque d’efficacité thérapeutique confirmée dans les études cliniques, dans 20 % des cas l’identification de phénomènes toxiques durant les phases d’évaluation préclinique et dans 12 % des cas l’identification d’effets secondaires pendant les phases de développement clinique. Ces raisons soulignent les principaux « goulots d’étranglement » de la recherche biopharmaceutique. Elles justifient la nécessité de réaliser des efforts de recherche particuliers dans le but d’améliorer la prédictivité des études de pharmacologie et de toxicologie préclinique et d’identifier des biomarqueurs [2], qu’ils soient des marqueurs d’activité pour confirmer l’hypothèse initiale ou des marqueurs d’efficacité permettant de définir les populations de patients qui bénéficieront le plus d’une nouvelle thérapie (Figure 1). L’objectif de IMI est de lever ces barrières et par là d’accélérer la mise à disposition auprès des malades et des médecins qui les prescrivent des médicaments nouveaux à forte valeur médicale ajoutée. C’est pourquoi Servier s’est mobilisé dès les premières réunions informelles entre acteurs industriels européens et a défendu la mise en place d’approches innovantes de partenariats public-privé dans le but de lever les verrous de la recherche pharmaceutique comme le décrit le Strategic Research Agenda, programme stratégique de IMI (www.imi-europe.org).
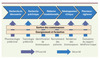 |
Figure 1. Les « goulots d’étranglements » de la Recherche et du Développement pharmaceutiques. |
Cet agenda stratégique, préparé conjointement par des représentants des industries pharmaceutiques européennes, des petites et moyennes entreprises, des instituts de recherche publics, des associations de patients et des agences réglementaires de chaque pays impliqué, définit les thèmes de recherche faisant l’objet d’un consensus général. L’agenda stratégique doit être compris comme un programme évolutif, qui sera mis à jour, ajusté et adapté en fonction des besoins et connaissances nouvelles.
IMI, Joint Technology Initiative du 7e programme cadre européen, est une entité légale créée à Bruxelles dans le but de mettre en œuvre et de contrôler la réalisation des recommandations publiées dans l’agenda stratégique de IMI. Cette entité est placée sous la responsabilité des entreprises membres de la Fédération Européenne des Industries et Associations Pharmaceutiques (EFPIA), de la Commission Européenne et des représentants des différents groupes de recherche publics des états membres de l’Union Européenne. Son objectif est de favoriser la recherche précompétitive en Europe, d’assurer la qualité scientifique des projets qui seront réalisés et par là de renforcer l’attractivité scientifique et médicale de l’Europe.
Le niveau de financement alloué au programme IMI est de 2 milliards d’euros sur une période de 5 ans (2008-2013). Cet investissement majeur pour la santé provient pour moitié de l’Union Européenne et pour moitié de la contribution apportée par l’industrie pharmaceutique. La formule retenue, par laquelle l’industrie pharmaceutique européenne contribue au succès du programme IMI par l’allocation de ressources dédiées aux projets soutenus, est sans précédent. Cette formule permet de dédier l’intégralité de l’aide publique aux petites et moyennes entreprises, aux instituts de recherche publics et aux associations de patients. De leur côté les industries européennes du médicament s’engagent dans les projets retenus en apportant ressources, matériels et expertises. IMI se caractérise donc par la mise en place d’un modèle nouveau de partenariats entre les entreprises européennes du médicament, fédérées par projet dans un « consortium privé », et les petites et moyennes entreprises, les agences réglementaires, les instituts publics de recherche et les associations de patients, fédérés par projet dans un « consortium public », dans le but de renforcer les liens entre ces différents partenaires de la recherche biomédicale. Bien que des laboratoires non européens puissent également être impliqués dans ces consortiums publics, les financements prévus sont destinés à soutenir la recherche réalisée en Europe.
En France, cette forme de partenariat public-privé arrive en complément des modèles qui existent actuellement et dans lesquels Servier est impliqué de longue date, tels que les partenariats soutenus par l’Agence Nationale de la Recherche (ANR), les projets labellisés par les Pôles de compétitivité ou le soutien et la formation de jeunes chercheurs par l’intermédiaire des contrats CIFRE [3–5].
L’agenda de recherche stratégique
Établi en partenariat étroit entre les représentants de l’industrie pharmaceutique, des instituts académiques, des associations de patients et des agences réglementaires, l’agenda stratégique de IMI représente une « feuille de route » et fixe les objectifs à atteindre visant à accroître l’attractivité et la productivité de la recherche biomédicale en Europe. Ces recommandations sont groupées en 4 chapitres ; la prédiction de la sécurité des médicaments, la prédiction de l’efficacité des nouveaux produits, la gestion des connaissances, l’enseignement et la formation (www.imi-europe.org).
Prédictivité de l’évaluation de la sécurité des médicaments
Une des principales difficultés de la recherche de nouveaux candidats médicaments est de réussir à prédire le plus tôt possible les phénomènes toxiques qui peuvent apparaître avec de nouveaux produits. L’utilisation de méthodes moléculaires, protéomiques et génomiques combinée à des études chez l’animal doit conduire à améliorer la prédictivité des tests réalisés, à mieux définir les caractéristiques des molécules synthétisées et à réduire le recours à l’expérimentation chez l’animal [6]. Les principales propositions concernent le développement de biomarqueurs, d’études in silico, l’évaluation des phénomènes de carcinogenèse. La recherche en pharmacovigilance avec l’optimisation des centres de données et l’amélioration des méthodologies est également concernée dans cet appel à projets dans le but de mieux prévenir les risques liés à l’utilisation des médicaments. Enfin la création d’un centre européen dédié à la recherche sur la sécurité des médicaments est proposée.
Prédictivité de l’efficacité des nouveaux traitements
Dans tous les domaines thérapeutiques, il est nécessaire de mettre en place des approches multiples et complexes dans le but de tester si la modulation d’une cible moléculaire entraîne une réponse physio-pharmacologique et si cette réponse est associée à l’effet thérapeutique attendu. Dans sa première version, l’agenda stratégique est centré sur les aires thérapeutiques suivantes : cancer, pathologies cérébrales et psychiatriques, maladies inflammatoires, maladies infectieuses et maladies métaboliques. Bien sûr d’autres pathologies majeures auraient pu être sélectionnées dans le cadre de cet agenda stratégique. Cependant, les domaines thérapeutiques retenus représentent des besoins médicaux largement non couverts qui affectent des millions de patients et pour lesquels une majorité des industriels impliqués dans IMI conduisent des recherches en Europe. La mise au point et la validation de modèles animaux prédictifs, la recherche de biomarqueurs, et la réalisation d’études de recherche clinique dans ces différents domaines représentent les objectifs principaux des partenariats entre les instituts de recherche publics et privés voulus pour mieux prédire l’efficacité des candidats médicaments dans le cadre de IMI.
Gestion des connaissances
L’ensemble des données générées dans le cadre des approches de biologie moléculaire (génomique, protéomique, métabolomique), des stratégies « translationnelles » (banques de ressources biologiques, données anonymisées d’essais cliniques, toxicoépidémiologie), de la recherche biopharmaceutique (toxicogénomique, biomarqueurs, pharmacologie clinique et expérimentale) demandent des moyens croissants d’analyse et d’intégration [7]. La compréhension et l’intégration de l’ensemble de ces données permettront de les exploiter en développant des outils de modélisation et de simulation et en développant les approches dites de « biologie systémique ». Il est nécessaire pour réussir de telles approches de fédérer les stratégies et les fonctionnements afin d’établir les standards nécessaires à une telle intégration des données de biologie - qu’il s’agisse des résultats de l’évaluation de biomarqueurs ou de la conservation des échantillons biologiques - avec l’enregistrement des observations cliniques. La création de bases de données et de modèles adaptés permettra d’améliorer en partie le suivi des nouveaux médicaments durant les phases de développement et de commercialisation.
Enseignement et formation
Dans un quatrième pilier fondateur de IMI, il a été reconnu nécessaire de développer en Europe une filière permettant de renforcer la formation des professionnels de la découverte et du développement des médicaments. C’est pourquoi l’agenda stratégique de IMI propose la création d’une Académie Européenne pour la Recherche de Médicaments (EMRA : European Medicines Research Academy). L’EMRA sera un réseau d’Universités et d’Instituts de formation. Son centre sera hébergé au sein d’une Université dans un centre de coordination et aura pour mission de favoriser l’harmonisation des enseignements en Europe au profit des acteurs clés du processus de découverte et d’enregistrement du médicament. Quatre axes majeurs ont été retenus en priorité :
-
Des programmes sur le développement intégré des médicaments pour les différents acteurs impliqués dans la vie du médicament, des scientifiques aux organisations de patients.
-
Des programmes sur la sécurité des médicaments pour les scientifiques des industries de santé et les professionnels de la médecine.
-
Des programmes sur les aspects réglementaires du médicament.
-
Des programmes spécifiques au profit des biostatisticiens, des bio-informaticiens et des informaticiens qui participent à la recherche de nouveaux candidats médicaments.
Dans tous les cas il est important de réaliser que la recherche et le développement de nouveaux médicaments requièrent une approche « transdisciplinaire » impliquant un grand nombre de spécialités scientifiques des sciences de la vie mais également de nombreux domaines technologiques tels que les biotechnologies, les nanotechnologies, les technologies médicales (imagerie, biophysique) et les technologies de l’information.
Processus général de la soumission et de l’évaluation des projets
Les processus de sélection des projets, résumés dans la Figure 2, sont différents de ceux mis en place dans le 7e programme cadre européen. Sur la base des éléments décrits dans le Strategic Research Agenda, le conseil de gouvernance de IMI, en fonction du plan opérationnel annuel, approuve les thèmes de recherche et les appels à projets proposés par le Groupe des Directeurs de Recherche de l’EFPIA. Le groupe des Directeurs de recherche de l’EFPIA est également en charge de la constitution des consortiums privés qui seront parties prenantes des projets.
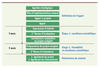 |
Figure 2. Processus d’évaluation des projets. Le processus d’évaluation des projets est réalisé en trois temps. Dans un premier temps (définition de l’appel), les sujets de recherche annuels sont proposés par le Groupe de Directeurs de recherche de l’EFPIA et approuvés par le groupe de travail de IMI. Dès la publication des appels à projets, les consortiums publics sont formés et soumettent des expressions d’intérêt (étape 1) évaluées par un comité scientifique d’experts en fonction des piliers de IMI. Les membres des consortiums privés se définissent sur les expressions d’intérêt. Après sélection, les projets complets sont préparés conjointement par les consortiums publics et privés (étape 2) et sont évalués par des comités d’experts indépendants avant de pouvoir être mis en œuvre. |
Tous les appels à projets sont structurés de manière identique, à savoir : (1) une description générale des questions posées dans un appel à projets donné, (2) les attendus en termes de résultats tangibles, (3) les noms des membres des consortiums privés appartenant à l’EFPIA qui ont exprimé la volonté de s’engager et d’apporter leur contribution aux projets (4) ainsi que le rôle qu’ils proposent de tenir dans le cadre des projets retenus, (5) la durée totale du projet, (6) le niveau de la contribution en nature apportée par les industriels de l’EFPIA au projet et enfin (7) les attentes des industriels de la part du consortium public.
Suite à la publication des appels à projets et afin d’y répondre, des consortiums « publics » sont formés. Indépendamment des consortiums privés, ces consortiums publics soumettent à IMI des propositions de programmes de recherche sous forme d’« expressions d’intérêt » en réponse aux appels à projets. Dans les 3 mois qui suivent la réception des expressions d’intérêt, une première évaluation scientifique et sélection est réalisée par des experts indépendants et par des représentants des consortiums privés. Dès cette première étape d’évaluation, la confidentialité des proposition et les intérêts des différents partenaires sont préservées par des accords de confidentialité stricts. Ce n’est qu’après cette première étape de sélection que les consortiums publics retenus sont invités à rejoindre les consortiums privés pour travailler en étroite collaboration dans le but de finaliser la rédaction des programmes de recherche. Les projets préparés par l’ensemble des partenaires contiennent une description complète des activités de recherche incluant les éléments de partage de la propriété intellectuelle.
Afin de faciliter cet échange entre consortiums publics et privés, et de réduire la durée de finalisation du projet de recherche à une durée de 2 mois, le groupe des directeurs de recherche de l’EFPIA a identifié, parmi les industriels participants à chaque priorité scientifique, des chefs de file (leaders et coleaders). À titre d’exemple Servier et Sanofi-Aventis sont associés pour piloter, dans le cadre du diabète, l’axe concernant la biologie des cellules β de l’îlot de Langerhans. L’évaluation finale de ces projets de collaboration est effectuée par des comités d’experts indépendants reflétant un équilibre entre les expertises publiques et privées. Après cette dernière étape de validation dont la durée prévue est de 1 mois, les projets retenus seront financés et mis en œuvre. Les deux principales particularités de IMI en comparaison aux programmes habituels du 7e programme cadre Européen tiennent dans la définition des appels à projets et dans la nature de leur financement. Les appels à projets soumis sont définis par les industriels du médicament et les projets retenus seront ceux qui répondent aux besoins des industriels. C’est donc le projet qui définit le consortium. En ce sens, la structure et la composition des consortiums proposés doivent être adaptées aux objectifs du projet et aux moyens nécessaires pour les atteindre. La seconde particularité est que le financement des projets sera apporté à 50 % par les industries membres de l’EFPIA par une contribution en nature à la réalisation du projet. Les 50 % restants sont apportés par la Communauté Européenne exclusivement aux petites et moyennes entreprises, aux laboratoires académiques, aux associations de patients et aux agences gouvernementales.
Cellule opérationnelle du Groupe Technique National IMI France
Afin de mieux positionner la France dans la compétition qui s’annonce, un Groupe Technique National (GTN) « IMI France » a été mis en place, copiloté par le Ministère de la Recherche (DGRI), le Ministère de l’Industrie (DGE) et l’Inserm.
Les missions et objectifs confiés à ce GTN IMI France sont de :
-
faciliter les échanges entre les parties prenantes françaises (membres de la plate-forme, acteurs français de la recherche biomédicale tant publics que privés),
-
permettre aux acteurs et aux opérateurs de contribuer à la constitution de consortiums compétitifs : entreprises pharmaceutiques, entreprises de biotechnologie, entreprises du dispositif médical et du diagnostic, institutions et chercheurs académiques, pôles de compétitivité, universités, associations professionnelles et associations de patients,
-
faciliter les contacts avec les partenaires européens et les réseaux existants ou en préparation,
-
sensibiliser les acteurs français aux enjeux de IMI et renforcer leur participation aux futurs appels à propositions.
Une cellule opérationnelle, placée sous la responsabilité de la gouvernance du GTN IMI France et avec le soutien de cette dernière (Daniel Vasmant, DGE - Michèle Longuet, DGRI et Philippe Arhets, Inserm) permet de coordonner de façon concrète l’ensemble des activités liées à IMI, en particulier :
-
Informer les demandeurs sur les objectifs, actions et spécificités des activités développées par IMI.
-
Assurer et coordonner à l’échelle nationale la circulation de l’information auprès de la communauté et des structures relais/supports (cellules Europe des organismes et institutions, réseaux locaux, régionaux, dispositifs de soutiens spécifiques, etc.).
-
Faciliter les mises en relation entre partenaires (profils intéressants) intéressés à participer aux projets IMI et les porteurs de projets en préparation, y compris à l’échelle européenne en s’appuyant sur le réseau PCN ; participer à l’identification des structures « GTN IMI like » dans les principaux États-membres et États associés à IMI et établir des liens opérationnels.
-
Mettre en place et gérer une base de données des partenaires et partenariats académiques et PME français pour IMI.
Priorités scientifiques
Durant la première année du programme IMI lancé en 2008, 18 appels à projets ont été lancés. Les appels à projets retenus pour cette première année concernent la prédictivité de la sécurité du médicament et la pharmacovigilance, la prédictivité de l’efficacité des nouveaux traitements et enfin l’enseignement et la formation (http://imi.europa.eu). Parmi près de 150 expressions d’intérêt reçues lors de ce premier appel, seul un nombre limité de projets seront retenus pour chacun des différents appels afin que les moyens mis en œuvre pour chaque projet puissent en garantir la compétitivité. Ceci correspond à la volonté des industriels du médicament de travailler ensemble sur quelques projets phares plutôt que de favoriser une multiplicité de projets de petite taille.
Sécurité et pharmacovigilance
En continuité avec le programme « PredTox », projet collaboratif réalisé grâce au support du 6e programme cadre européen, le projet « PredTox II » a pour but de mesurer la valeur prédictive de l’utilisation des technologies de biologie moléculaire (génomique, protéomique) en association avec les études de toxicologie conventionnelle afin d’améliorer les éléments de décision liés aux risques toxicologiques des candidats médicaments.
À coté du projet PredTox II, quatre appels à projets sont définis dans le cadre de la sécurité du médicament. Ces appels à projets concernent la recherche de biomarqueurs dans le but d’améliorer la prédictivité de la toxicologie entre espèces, l’analyse et l’évaluation du risque d’immunogénicité, l’étude de la carcinogenèse non génotoxique et l’utilisation de systèmes experts in silico.
Enfin l’analyse des données pharmacoépidémiologiques en faveur d’une pharmacovigilance et d’une gestion des risques proactive représente le sujet d’un appel à projet dédié à la pharmacovigilance.
Efficacité
Les appels à projets préparés dans le but d’améliorer l’efficacité des nouveaux candidats médicaments ciblent le diabète, les pathologies neurologiques, la douleur, les maladies psychiatriques et neurodégénératives, et les maladies inflammatoires, l’asthme sévère et la bronchopneumopathie chronique obstructive (BPCO). Dans chacun des domaines thérapeutiques ciblés, les appels à projets concernent la mise en œuvre de stratégies visant à établir de nouveaux modèles expérimentaux, identifier des biomarqueurs (marqueurs biochimiques, marqueurs génétiques, méthodes d’imagerie) permettant de mieux définir les populations de patients pouvant répondre de façon optimale à telle ou telle thérapeutique. La mise en place d’approches intégrées précliniques et cliniques afin de mieux identifier les doses efficaces et sûres pour de nouvelles approches thérapeutiques représente un objectif clé de ces appels à projets.
Enseignement et formation
Cinq appels à projets sont retenus dans le cadre de l’enseignement et de la formation. Ces appels ont pour but de renforcer l’attractivité de l’Europe et d’harmoniser les enseignements dans les secteurs suivants : sécurité des médicaments, médecine pharmaceutique, développement intégré des médicaments et pharmacovigilance. Des programmes établis permettront aux différents acteurs de la vie scientifique et économique du médicament de mieux appréhender les spécificités de la découverte, le développement, l’évaluation des nouveaux traitements - éléments regroupés sous le terme de médecine pharmaceutique - et les caractéristiques méthodologiques, éthiques, réglementaires et économiques qui encadrent le développement de nouveaux médicaments - éléments regroupés sous le terme de développement intégré des médicaments. Enfin, il est anticipé d’établir une plateforme d’excellence paneuropéenne dans le cadre d’une Académie Européenne de Recherche de Médicaments (EMRA) pour harmoniser les enseignements et soutenir des doctorants dans le cadre de thèses en relation directe avec les besoins répertoriés dans IMI.
Durant la seconde année du programme IMI des appels à projets dans les domaines du cancer, des maladies infectieuses, des maladies inflammatoires, des maladies métaboliques seront lancés ainsi que des projets dans les domaines de la sécurité du médicament et du partage des connaissances.
Conclusion
L’Initiative Médicaments Innovants a pour objectifs de renforcer l’attractivité et la compétitivité de l’Europe dans le domaine de la recherche médicale et thérapeutique et de redonner à l’Europe un rôle de premier plan dans l’innovation thérapeutique. Pour une entreprise pharmaceutique comme Servier mais aussi pour chacun des laboratoires académiques et industriels qui s’engagera dans ces projets, l’Initiative Médicaments Innovants constitue une opportunité unique d’y contribuer et de renforcer l’excellence de la recherche biopharmaceutique. Les projets mis en place dans le cadre de IMI contribueront à ouvrir de nouveaux horizons visant à améliorer la prise en charge des maladies aujourd’hui sans recours en favorisant l’émergence de vraies innovations thérapeutiques et en accélérant leur mise à disposition auprès des patients. Ils permettront, par la définition de nouveaux réseaux dans le cadre de partenariats public-privé de mieux partager les connaissances générées et de promouvoir la formation de talents. Enfin, IMI, en impliquant des acteurs d’origine diverse, contribuera à atteindre l’un des principaux objectifs de l’Union Européenne qui consiste à construire l’économie fondée sur le savoir la plus compétitive et la plus dynamique du monde.
Références
- Kola I, Landis J. Can the pharmaceutical industry reduce attrition rate ? Nat Rev Drug Discov 2004; 3 : 711–5. [Google Scholar]
- Frank R, Hargreaves R. Clinical biomarkers in drug discovery and development. Nat Rev Drug Discov 2003; 2 : 566–80. [Google Scholar]
- Canet E, Grassy G. Formation à la recherché et partenariats de recherche public-privé. Contribuer ensemble à l’excellence scientifique et à la croissance économique. Med Sci (Paris) 2006; 22 : 664–8. [Google Scholar]
- Demotes-Mainard J, Canet E, Segard L. Public-private partnership models in France and in Europe. Thérapie 2006; 61 : 325–34. [Google Scholar]
- Canet E. Médicen Paris region, pôle de compétitivité mondial et recherche en neuroscience. Med Sci (Paris) 2007; 23 : 435–9. [Google Scholar]
- Kramer JA, Sagartz JE, Morris DL. The application of discovery toxicology and pathology towards the design of safer pharmaceutical lead candidates. Nat Rev Drug Discov 2007; 6 : 636–49. [Google Scholar]
- Roux M. Biologie systémique. Standards et modèles. Collection Écrin. Paris : Omniscience, 2007 : 288 p. [Google Scholar]
Liste des figures
 |
Figure 1. Les « goulots d’étranglements » de la Recherche et du Développement pharmaceutiques. |
| Dans le texte | |
 |
Figure 2. Processus d’évaluation des projets. Le processus d’évaluation des projets est réalisé en trois temps. Dans un premier temps (définition de l’appel), les sujets de recherche annuels sont proposés par le Groupe de Directeurs de recherche de l’EFPIA et approuvés par le groupe de travail de IMI. Dès la publication des appels à projets, les consortiums publics sont formés et soumettent des expressions d’intérêt (étape 1) évaluées par un comité scientifique d’experts en fonction des piliers de IMI. Les membres des consortiums privés se définissent sur les expressions d’intérêt. Après sélection, les projets complets sont préparés conjointement par les consortiums publics et privés (étape 2) et sont évalués par des comités d’experts indépendants avant de pouvoir être mis en œuvre. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




