| Issue |
Med Sci (Paris)
Volume 24, Number 2, Février 2008
|
|
|---|---|---|
| Page(s) | 163 - 168 | |
| Section | M/S revues | |
| DOI | https://doi.org/10.1051/medsci/2008242163 | |
| Published online | 15 February 2008 | |
Les canaux TRP (transient receptor potential)
Une nouvelle famille de canaux à expression variée
Transient receptor potential, TRP channels: a new family of channels broadly expressed
Laboratoire de Physiopathologie Cardiovasculaire, Inserm U637, CHU Arnaud de Villeneuve, 371, avenue du Doyen Gaston Giraud, 34295 Montpellier Cedex 5, France
*
vassort@montp.inserm.fr
*
fauconnier@montp.inserm.fr
Les canaux TRP (transient receptor potential) représentent une nouvelle grande famille qui comprend plus de 50 canaux perméables aux cations, exprimés de la levure à l’homme. Sur la base des homologies structurelles, cette famille est divisée en 7 groupes : TRPC1-7 Canonique, TRPV1-6 Vanilloïde, TRPM1-8 Mélastatine, TRPP1-3 Polycystine, TRPML Mucolipine, TRPA Ankyrine et les TRPN (nompC) non représentés chez les mammifères. Le clonage a permis la caractérisation de ces canaux peu dépendants du potentiel et présentant généralement une perméabilité non spécifique pour les cations. Ils sont activés par des ligands très variés. Certains, tels divers composés ou la température et le pH, agissent directement tandis que d’autres impliquent une cascade de transduction du signal. Ces canaux sont présents dans une grande variété de types cellulaires. Leur rôle est essentiel pour que l’organisme intègre les informations issues du monde extérieur et au niveau cellulaire pour détecter les caractéristiques de l’environnement. L’impact de mutations ou du comportement anormal de ces canaux dans les diverses pathologies humaines est multiple et majeur.
Abstract
Transient receptor potential, TRP channels are a new superfamily of functionally versatile non-selective cation channels present from yeast to mammals. On the basis of their structural homology, TRP channels are subdivided in 7 groups : TRPC1-7 Canonical, TRPV1-6 Vanilloid, TRPM1-8 Melastatin, TRPP1-3 Polycystin, TRPML Mucolipin, TRPA Ankyrin and TRPN (NO mechanotransducer potential C), the latter not expressed in mammals. Their cloning and heterologous expression allowed to demonstrating that these channels are generally weakly voltage-dependent. They are activated by various ligands involving a signal transduction cascade as well as directly by multiple compounds, heat and pH. TRP channels are found in a broad range of cell types. TRP channels are essential in allowing animals to sense the outside world and cells to sense their local environment. Following mutations or anomalous behaviour, these channels have a major role in several human diseases.
© 2008 médecine/sciences - Inserm / SRMS
Les canaux ioniques, et particulièrement ceux qui sont perméables au Ca2+, occupent une position majeure dans le contrôle des activités cellulaires que relaient les changements de la concentration calcique intracellulaire. Les études électrophysiologiques et de fluorescence ont permis de distinguer les canaux calciques directement activés par le potentiel et dont l’identité moléculaire et la structure tridimensionnelle sont maintenant bien connues, de ceux qui sont activés par la stimulation des récepteurs (receptor-operated channel, ROC) ou la déplétion des réservoirs calciques intracellulaires (store-operated channel, SOC).
La nouvelle famille des canaux TRP
Tout récemment est apparue une superfamille très variée de canaux perméables aux cations et présents dans la plupart des types cellulaires des mammifères, les canaux TRP. L’archétype de ce canal a été découvert chez Drosophila melanogaster où il joue un rôle dans la phototransduction impliquant un signal calcique ; une mutation de son gène entraîne une réponse transitoire du potentiel bien que la lumière soit maintenue [1].
Chaque sous-unité TRP est constituée de six domaines transmembranaires avec un pore entre les cinquième et sixième segments transmembranaires, structure semblable à celle des canaux potassiques sensibles au potentiel (Figure 1). Comme ces derniers, les TRP s’assemblent en homo- ou hétéro-tétramères pour former un canal cationique non sélectif [2–4]. En fonction des homologies de leurs acides aminés, les TRP sont regroupés en 7 familles : TRPC, TRPM, TRPV, TRPA, TRPP, TRPML et TRPN. Aux 13 membres de cette superfamille de TRP décrits chez la drosophile correspondent 28 membres chez les mammifères où les TRPN ne sont pas représentés.
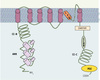 |
Figure 1. Structure des canaux TRPC. Éléments structuraux communs aux TRPC. ANK : motif ankyrine ; CC-N et CC-C : domaines coil-coil amino- et carboxy-terminaux impliqués respectivement dans la dimérisation et dans la liaison avec la calmoduline. CIRB : motif de liaison au récepteur calmoduline/IP3 ; PDZ : motif PDZ de liaison à d’autres protéines. Le motif EWKFAR est commun aux TRPC, de même que le motif LFW situé dans la région présomptive du pore. Il y a plusieurs sites de glycosylation potentiels sur les boucles externes (non représentés). |
Tous les canaux TRP sont perméables aux cations. La plupart sont perméables au Ca2+ avec un rapport de perméabilité PCa/PNa variant de 0,3 à 10. La structure du pore joue un rôle essentiel dans la perméabilité et la sélectivité d’un canal particulier. L’impact fonctionnel des modifications pore-structure sur les propriétés des canaux TRP a été récemment résumé [5]. Les canaux TRP sont activés de façon très variée par des messagers intra- ou extracellulaires, des composés chimiques, des stimulations mécaniques ou un stress osmotique [6, 7]. Ils sont peu sensibles au potentiel de membrane ce qui les distingue des canaux dépendant du potentiel dont l’étude a été si fructueuse depuis l’avènement du « patch-clamp ». Certains seraient constitutivement ouverts tandis que d’autres sont activés en fonction de l’état de remplissage des réservoirs calciques intracellulaires. De plus, certains de ces canaux apparaissent localisés dans les membranes intracellulaires. De façon remarquable, les propriétés biophysiques de ces canaux ont été initalement décrites après leur ré-expression hétérologue, même si certaines informations varient de façon marquée avec le type cellulaire utilisé pour la ré-expression, le niveau d’expression et l’environnement. La mise en évidence de leur rôle physiologique ou pathologique dans un type cellulaire donné est rendue très difficile par l’absence de modulateurs naturels ou synthétiques. De plus, un certain nombre des TRP sont des hétéromères et forment des canaux fonctionnels spécifiques. L’utilisation de variants dominant-négatifs ou d’ARN antisens peut perturber tant les homo- que les hétéromères. Enfin, beaucoup de ces canaux ont un très lent renouvellement si bien que leur knockdown effectif peut prendre plusieurs jours. Des souris transgéniques pour l’un ou plusieurs de ces canaux sont disponibles. Cependant une certaine redondance fonctionnelle, due à la capacité qu’ont ces canaux d’exécuter des rôles similaires, qui compense l’absence d’une activité protéique, retarde les conclusions définitives.
Les canaux TRPC canoniques
Cette famille, que caractérise une séquence commune EWKFAR (Figure 1), est subdivisée en TRPC1, TRPC2, TRPC3/6/7 et TRPC4/5. Ces canaux sont tous activés en réponse à une stimulation des récepteurs activant diverses isoformes de la phospholipase C, PLC, et sont notablement modulés par la calmoduline et diverses autres protéines fixant le Ca2+ [8]. Typiquement les canaux TRPC3/6/7 sont activés plus spécifiquement par le diacylglycérol, DAG, tandis que le mécanisme d’activation des TRPC1/4/5 par la PLC reste controversé (Figure 2).
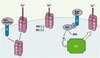 |
Figure 2. Mécanismes d’activation des canaux TRPC. L’activité de ces canaux, perméables au Ca2+ et aux autres cations, peut être accrue au moins potentiellement de trois façons : (1) par une voie de transduction du signal impliquant la PLC et la production de DAG à la suite de la stimulation de divers récepteurs (muscariniques, purinergiques, etc.) et médiée par une protéine G ; (2) par translocation suite à l’activation de récepteurs sensibles à l’EGF et à l’insuline (à gauche), et (3) par la vidange des réservoirs calciques intracellulaires (à droite). Noter aussi que l’activité des TRPC peut être modulée par les protéine kinases C, PKC et la tyrosine kinase, src. |
Il a été suggéré que tous ces canaux canoniques sont activés par la déplétion des réservoirs du Ca2+ intracellulaire [9]. De plus, le canal TRPC1 est identifié comme un composant des canaux sensibles à l’étirement chez les vertébrés. TRPC1, en particulier, pourrait être associé à Orai11 et former un complexe TRPC1-Orai1-STIM1 (stromal interacting molecule)2 contribuant à la fonction SOC [10]. TRPC6 a été la première protéine de cette famille dont on a démontré qu’elle était un élément essentiel de l’activation des canaux cationiques non sélectifs activés par la stimulation α1-adrénergique précédemment décrite dans le muscle lisse de la veine porte du lapin [11]. Le même rôle est dévolu à TRPC3 dans l’artère de l’oreille tandis que, dans ce même tissu, l’angiotensine active les canaux TRPC1 et TRPC6 par des voies spécifiques de transduction du signal, respectivement dépendantes ou non de la PKC [12]. Enfin, l’insuline induit la translocation de TRPC3 dans les cardiomyocytes ventriculaires de souris tandis que cet effet apparaît nettement réduit dans un modèle de souris diabétique, ob/ob [13]. TRPC3 est colocalisé avec VAMP2 (vesicle-associated membrane protein 2), une protéine SNARE qui régulerait l’expression à la surface de TRPC3 lors d’une stimulation par un agoniste [14, 32] (→).
(→) m/s 2008, n° 2, p. 142.
Ces canaux TRPC peu sélectifs permettent aussi une entrée de Na+. Les modifications du gradient sodique vont interférer avec la distribution des ions Ca2+ notamment par l’échangeur Na+/Ca2+. Ainsi une modeste élévation du Na+ associée à une faible dépolarisation peut être suffisante pour induire une entrée de Ca2+. De plus, il apparaît que le TRPC3 et l’échangeur Na+/Ca2+ forment un complexe protéique activable par la PLC dans les cardiomyocytes de rat [15]. De façon similaire, l’association étroite de TRPC7, ré-exprimé dans des cellules HEK, avec la pompe calcique du réticulum sarcoplasmique, SERCA, permet un contrôle local de la concentration calcique et prévient l’inhibition du canal par les ions Ca2+ entrant par ce canal lors de son activation [16].
Les canaux TRPV « Vanilloïde »
Les six membres de cette famille, TRPV1/TRPV2, TRPV3, TRPV4, TRPV5/TRPV6 forment des complexes tétramériques qui contiennent trois à cinq résidus ankyrine dans leur domaine amino-terminal. Les canaux TRPV1-4 sont tous activés par la chaleur et agissent comme chimiosenseurs pour un bon nombre de ligands endogènes ou synthétiques [31]. Ils jouent aussi un rôle important comme éléments sensibles à l’étirement dans tout le règne animal [17]. Les canaux TRPV1-4 présentent un rapport de perméabilité PCa/PNa de 1 à 10 tandis que les TRPV5/TRPV6 sont 100 fois plus perméables au Ca2+, même si en l’absence de Ca2+ ils laissent passer le Na+. Le canal TRPV1 est activé par la capsaïcine, anandamide, divers eicosanoïdes, leucotriènes B4, N-arachidonoyl dopamine, adénosine et 2-amino ethoxyphénylborate (2-APB), le pH acide et une température modérée (> 43°C) (Figure 3A). TRPV2 est un élément sensible à l’hypotonicité et à l’étirement dans le muscle lisse vasculaire [18]. TRPV3 est activé par le camphre et 2-APB, et TRPV4 par l’α-phorbol, le 4α-phorbol, et le 12,13-didécanoate, 4-αPDD. Exprimé dans la plupart des tissus et de façon très abondante dans le rein, TRPV4 est aussi activé par l’hypotonicité via une phosphorylation en Tyr-253 par une tyrosine kinase [19]. TRPV5 est essentiel à la réabsorption du Ca2+ dans le rein, et TRPV6 à la réabsorption du Ca2+ dans l’intestin. Ces deux canaux sont régulés par une inactivation dépendante du Ca2+ (demi-inactivation ≈ 100 nM). Ils sont aussi bloqués par le Mg2+, propriété qui ne dépend que d’un seul résidu aspartate dans le filtre de sélectivité du pore du canal. Les analyses structure-fonction indiquent que les propriétés de perméabilité et de sélectivité des TRPV5 et TRPV6 sont principalement déterminées par un anneau de quatre résidus aspartate, de façon similaire à l’anneau de quatre résidus chargés négativement (aspartate ou glutamate) du pore des canaux calciques dépendant du potentiel [5].
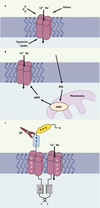 |
Figure 3. Exemples de mécanismes d’activation succincts de TRPV, TRPM ou TRPML. A. Les TRPV et notamment TRPV1 sont activés par les divers facteurs indiqués. B. Le TRPM2 est activé par les radicaux libres, ROS qui par l’activation de la poly-ADP-ribose polymérase, PARP dans les mitochondries, augmentent la concentration d’ADP-ribose, ADPR. C. Activation du complexe PKD1-PKD2. La fixation d’un anticorps, IgG sur le domaine REJ de PKD1 agissant comme un récepteur, démasque une protéine G et entraîne l’activation de PKD2 la sous-unité canal permettant le passage de Ca2+. |
Les canaux TRPM « Mélastatine »
Les 8 canaux TRPM, TRPM1/TRPM3, TRPM2/TRPM8, TRPM4/TRPM5, TRPM6/TRPM7 ont été ainsi nommés après la découverte de la protéine TRPM1 dont le gène est exprimé dans des cellules de mélanomes y compris métastasiques. Une corrélation inverse existe entre son expression et la progression du mélanome. Tous les autres membres de cette famille TRPM sont aussi liés à des tumeurs humaines [20]. Ces canaux sont impliqués dans la tumorigenèse, la prolifération et la différenciation cellulaires. De plus, TRPM2 et TRPM7 pourraient être des inducteurs de mort cellulaire. Ces canaux montrent une perméabilité très variable pour le Ca2+ et le Mg2+ : certains sont imperméables au Ca2+ (TRPM4, TRPM5), d’autres ont une très forte perméabilité pour les deux cations (TRPM6 et TRPM7, ainsi que des variants de TRPM3).
TRPM2, TRPM6 et TRPM7 sont des canaux couplés à une enzyme et forment des « chanzymes » (channels plus enzymes), de telle sorte que le domaine enzymatique pourrait réguler l’activité du canal ou vice versa [21]. Ainsi TRPM2 montre une activité ADP-ribose hydrolase associée au motif NUDT9 (human nucleoside diphosphate linked moiety X-type motif 9) de la zone carboxy-terminale. TRPM2 serait un détecteur du statut redox cellulaire (Figure 3B). Le stress oxydatif active TRPM2 en augmentant le largage d’ADP-ribose de la mitochondrie. La délétion du domaine NUDT9 supprime l’activation par H2O2. TRPM6 et TRPM7 participent à l’homéostasie du Mg2+. Ils présentent une forte perméabilité pour cet ion tout en étant régulés par sa concentration intracellulaire. Leur longue queue carboxy-terminale est liée à un domaine ayant une activité α-kinase formant ainsi une protéine bifonctionnelle [22].
TRPM3, le plus proche du canal TRPM1, forme un canal perméable au Ca2+ activé par les variations d’osmolarité extracellulaire, la déplétion des réservoirs calciques et la D-érythro-sphingosine. Les canaux TRPM4/TRPM5 sont, quant à eux, imperméants au Ca2+ mais conduisent les ions monovalents avec une conductance de 20-25 pS. Ces deux canaux sont de bons candidats pour former le canal cationique non sélectif endogène activé par Ca2+. TRPM4 est exprimé dans les cellules du nœud sino-auriculaire et est impliqué dans le contrôle de l’activité rythmique cardiaque et ses perturbations [23]. PIP2 est un puissant modulateur de TRPM4 de telle sorte que la dégradation du PIP2 lors de l’activation des PLC par certains médiateurs (α1-adrénergique, muscarinique, angiotensine…) constitue un frein important à l’activité de TRPM4 [24]. TRPM5 est essentiel pour la transduction des goûts sucré, amer et protéique (umami). TRPM8 est activé par le froid et les agents pharmacologiques donnant cette sensation comme le menthol. L’analyse des souris transgéniques déficientes en TRPM8 confirme que ce canal est le principal détecteur de l’environnement au froid [25]. Ce canal apparaît dépendant du voltage pour des potentiels supérieurs à + 100 mV (demi-activation ≃ + 200 mV). Le froid induit un déplacement de la courbe d’activation permettant une activation du canal dans une gamme de potentiels plus physiologiques (demi-activation ≃ + 25 mV à 5-10°C). Les échanges de segments dans le domaine carboxy-terminal entre le TRPM8, sensible au froid et le TRPV1, sensible au chaud, ont permis de comprendre le rôle d’une séquence d’acides aminés dans l’activation par la température et le phosphatidylinositol 4,5-biphosphate, PIP2 [26]. Les effets de la température, mais pas ceux du PIP2, disparaissent quand les résidus de cette séquence chargés positivement sont neutralisés [27]. Ainsi température, potentiel et PIP2 interagiraient de façon allostérique pour contrôler l’activité de ce thermo-canal.
Les canaux TRPML « Mucopolipine »
Les trois membres chez les mammifères, TRPML 1-3 sont relativement courts, moins de 600 acides aminés. TRPML1 inclut un domaine lipase. Constitutivement actifs, ces canaux voient leur activité augmentée par le Ca2+, inhibée par l’acidose et bloquée par l’amiloride. Ils sont nécessaires pour la formation et le recyclage des lysosomes. TRPML2 et TRPML3 sont peu caractérisés. TRPML3 serait important pour la maturation des cellules ciliaires ainsi que pour le transport des vésicules intracellulaires.
Les canaux TRPP « Polycystine »
Cette famille comprend deux groupes, les canaux PKD1 (polycystic kidney disease 1)-like - TRPP1-like, incluant TRPP1, PKDREJ, PKD1L1, PKD1L2 et PKD1L3 ainsi que les PKD2 (polycystic kidney disease 2)-like - TRPP2-like incluant PKD2, PKD2L1 et PKD2L2 aujourd’hui renommés TRPP2, TRPP3 et TRPP5 respectivement. Les mutations de TRPP1 et TRPP2 sont responsables de la maladie polykystique autosomique dominante3 [28]. Ces deux groupes sont structurellement très différents. TRPP1 comprend 11 segments transmembranaires, un très long domaine extracellulaire et un domaine carboxy-terminal qui interagit avec celui de TRPP2 (Figure 3C). Très probablement ces deux protéines doivent être couplées pour former un canal actif. TRPP2 est nécessaire pour les mouvements ciliaires et est impliqué dans le développement du cœur, des muscles squelettiques et des reins. TRPP3 est impliqué dans le développement de la rétine et des poils.
Les canaux TRPA « Ankyrine »
Le seul représentant de cette famille chez les mammifères, TRPA, est activé par le froid intense et par les substances « piquantes » contenant de l’isothiocyanate et de l’allicine, comme l’ail et l’oignon, ainsi que par l’élément psychoactif de la marijuana ; mais il est insensible au menthol et à la capsaïcine. Il serait aussi responsable de la transduction mécanosensible impliquée dans la réponse auditive des mammifères.
Les canaux TRPN « NO-mécanosensible »
Caractérisés par une séquence de 29 ankyrines dans le domaine amino-terminal, ces canaux mécano-transducteurs sont impliqués dans l’audition chez les vers, mouches et le poisson zébre. Ils ne sont pas représentés chez les mammifères.
TRP et canalopathies
Des altérations de la fonction des canaux ioniques sont la cause de nombreuses maladies ou canalopathies directement associées à un gène codant pour une protéine-canal. À ce jour, cinq canalopathies sont attribuables à un TRP. L’altération de TRPC6 est responsable d’une maladie rénale protéinurique, la glomérulosclérose segmentale focale, celle de TRPM6 est liée à l’hypomagnésie et une hypocalcémie secondaire, celle de TRPP2 à la polykystose rénale dominante autosomique et TRPML1 à la mucolipidose de type IV4. TRPM7 serait associé à deux pathologies neurodégénératives, la sclérose latérale amyotrophique et la démence parkinsonnienne retrouvée avec une forte incidence dans la population de certaines îles du Pacifique, suggérant une relation complexe entre génome et environnement [29, 30].
De plus, des perturbations des fonctions physiologiques médiées par les canaux ioniques peuvent résulter d’une variation de leur expression ou d’une sensibilisation/désensibilisation conduisant à des réponses anormales à des stimulus physiologiques ou pathologiques. La plupart des TRP sont des cibles potentielles pour les facteurs pathogènes alors que la régulation anormale des fonctions canalaires influence notablement le développement des maladies neurodégéneratives, cardiovasculaires [11] et respiratoires. Répondant à des stimulus variés et multiples, les TRP agissent comme des intégrateurs de ces signaux externes et internes. Ainsi, les TRP sont impliqués dans la douleur, le vieillissement, le cancer et de nombreuses maladies systémiques.
La maladie polykystique rénale autosomique dominante, PKD (autosomal dominant polycystic kidney disease, ADPKD), est fréquente, survenant chez environ 1/ 1000. Caractérisée par de multiples lésions kystiques dans le parenchyme rénal, la maladie touche beaucoup d’autres organes (foie, pancréas, vaisseaux cérébraux, valves cardiaques, tractus colique). C’est la plus fréquente des maladies héréditaires rénales. La moitié des cas resteront asymptomatiques pendant toute la durée de la vie. Elle est à l’origine de 10 % à 15 % des insuffisances rénales chroniques terminales.
La mucolipidose de type IV est une maladie de surcharge lysosomale se traduisant cliniquement par un retard psychomoteur et des anomalies oculaires à type d’opacités cornéennes, de dégénérescence rétinienne ou de strabisme. Il s’agit d’une affection très rare, principalement présente dans la population askhénaze, au sein de laquelle la fréquence des hétérozygotes est de 1/100 et l’incidence de la maladie de 1 pour 40 000 (site internet Vaincre les maladies lysosomales).
Références
- Montell C, Jones K, Hafen E, et al. Rescue of the Drosophila phototransduction mutation trp by germline transformation. Science 1985; 230 : 1040–3. [Google Scholar]
- Clapham DE. TRP channels as cellular sensors. Nature 2003; 426 : 517–24. [Google Scholar]
- Schaefer M. Homo- and heteromeric assembly of TRP channel subunits. Pflugers Arch 2005; 451 : 35–42. [Google Scholar]
- Venkatachalam K, Montell C. TRP Channels. Annu Rev Biochem 2007; 76 : 387–417. [Google Scholar]
- Owsianik G, Talavera K, Voets T, et al. Permeation and selectivity of TRP channels. Annu Rev Physiol 2006; 68 : 685–717. [Google Scholar]
- Nilius B, Voets T. TRP channels: a TR(I)P through a world of multifunctional cation channels. Pflugers Arch 2005; 451 : 1–10. [Google Scholar]
- Pedersen SF, Owsianik G, Nilius B. TRP channels: an overview. Cell Calcium 2005; 38 : 233–52. [Google Scholar]
- Zhu MX. Multiple roles of calmodulin and other Ca2+-binding proteins in the functional regulation of TRP channels. Pflugers Arch 2005; 451 : 105–15. [Google Scholar]
- Vazquez G, Wedel BJ, Aziz O, et al. The mammalian TRPC cation channels. Biochim Biophys Acta 2004; 1742 : 21–36. [Google Scholar]
- Ambudkar IS, Ong HL, Liu X, et al. TRPC1: the link between functionally distinct store-operated calcium channels. Cell Calcium 2007; 42 : 213–23. [Google Scholar]
- Inoue R, Jensen LJ, Shi J, et al. Transient receptor potential channels in cardiovascular function and disease. Circ Res 2006; 99 : 119–31. [Google Scholar]
- Saleh SN, Albert AP, Peppiatt CM, et al. Angiotensin II activates two cation conductances with distinct TRPC1 and TRPC6 channel properties in rabbit mesenteric artery myocytes. J Physiol 2006; 577 : 479–95. [Google Scholar]
- Fauconnier J, Lanner JT, Sultan A, et al. Insulin potentiates TRPC3-mediated cation currents in normal but not in insulin-resistant mouse cardiomyocytes. Cardiovasc Res 2007; 73 : 376–85. [Google Scholar]
- Singh BB, Lockwich TP, Bandyopadhyay BC, et al. VAMP2-dependent exocytosis regulates plasma membrane insertion of TRPC3 channels and contributes to agonist-stimulated Ca2+ influx. Mol Cell 2004; 15 : 635–46. [Google Scholar]
- Eder P, Poteser M, Groschner K. TRPC3: a multifunctional, pore-forming signalling molecule. Handb Exp Pharmacol 2007; 179 : 77–92. [Google Scholar]
- Lemonnier L, Trebak M, Lievremont JP, et al. Protection of TRPC7 cation channels from calcium inhibition by closely associated SERCA pumps. Faseb J 2006; 20 : 503–5. [Google Scholar]
- O’Neil RG, Heller S. The mechanosensitive nature of TRPV channels. Pflugers Arch 2005; 451 : 193–203. [Google Scholar]
- Muraki K, Iwata Y, Katanosaka Y, et al. TRPV2 is a component of osmotically sensitive cation channels in murine aortic myocytes. Circ Res 2003; 93 : 829–38. [Google Scholar]
- Xu H, Zhao H, Tian W, et al. Regulation of a transient receptor potential (TRP) channel by tyrosine phosphorylation. SRC family kinase-dependent tyrosine phosphorylation of TRPV4 on TYR-253 mediates its response to hypotonic stress. J Biol Chem 2003; 278 : 11520–7. [Google Scholar]
- Kraft R, Harteneck C. The mammalian melastatin-related transient receptor potential cation channels: an overview. Pflugers Arch 2005; 451 : 204–11. [Google Scholar]
- Scharenberg AM. TRPM2 and TRPM7: channel/enzyme fusions to generate novel intracellular sensors. Pflugers Arch 2005; 451 : 220–7. [Google Scholar]
- Levitan IB, Cibulsky SM. Biochemistry. TRP ion channels: two proteins in one. Science 2001; 293 : 1270–1. [Google Scholar]
- Demion M, Bois P, Launay P, et al. TRPM4, a Ca2+-activated nonselective cation channel in mouse sino-atrial node cells. Cardiovasc Res 2007; 73 : 531–8. [Google Scholar]
- Nilius B, Mahieu F, Prenen J, et al. The Ca2+-activated cation channel TRPM4 is regulated by phosphatidylinositol 4,5-biphosphate. EMBO J 2006; 25 : 467–78. [Google Scholar]
- Bautista DM, Siemens J, Glazer JM, et al. The menthol receptor TRPM8 is the principal detector of environmental cold. Nature 2007; 448 : 204–8. [Google Scholar]
- Calvino B. L’hypersensibilité à la chaleur au cours de l’inflammation: le rôle du récepteur TRPV1. Med Sci (Paris) 2003; 19 : 649–51. [Google Scholar]
- Brauchi S, Orta G, Mascayano C, et al. Dissection of the components for PIP2 activation and thermosensation in TRP channels. Proc Natl Acad Sci USA 2007; 104 : 10246–51. [Google Scholar]
- Fischer E, Pontoglio M. Polarité planaire et polykystose rénale. Med Sci (Paris) 2006; 22 : 576–8. [Google Scholar]
- Kiselyov K, Soyombo A, Muallem S. TRPpathies. J Physiol 2007; 578 : 641–53. [Google Scholar]
- Nilius B, Owsianik G, Voets T, et al. Transient receptor potential cation channels in disease. Physiol Rev 2007; 87 : 165–217. [Google Scholar]
- Sharif Naeini R, Ciura S, Bourque CW. Les TRPV, des canaux qui vous donnent soif ! Med Sci (Paris) 2006; 22 : 1035–7. [Google Scholar]
- Tareste D. Énergie libérée par la machinerie de fusion SNAREpin. Med Sci (Paris) 2007; 24 : 142–3. [Google Scholar]
Liste des figures
 |
Figure 1. Structure des canaux TRPC. Éléments structuraux communs aux TRPC. ANK : motif ankyrine ; CC-N et CC-C : domaines coil-coil amino- et carboxy-terminaux impliqués respectivement dans la dimérisation et dans la liaison avec la calmoduline. CIRB : motif de liaison au récepteur calmoduline/IP3 ; PDZ : motif PDZ de liaison à d’autres protéines. Le motif EWKFAR est commun aux TRPC, de même que le motif LFW situé dans la région présomptive du pore. Il y a plusieurs sites de glycosylation potentiels sur les boucles externes (non représentés). |
| Dans le texte | |
 |
Figure 2. Mécanismes d’activation des canaux TRPC. L’activité de ces canaux, perméables au Ca2+ et aux autres cations, peut être accrue au moins potentiellement de trois façons : (1) par une voie de transduction du signal impliquant la PLC et la production de DAG à la suite de la stimulation de divers récepteurs (muscariniques, purinergiques, etc.) et médiée par une protéine G ; (2) par translocation suite à l’activation de récepteurs sensibles à l’EGF et à l’insuline (à gauche), et (3) par la vidange des réservoirs calciques intracellulaires (à droite). Noter aussi que l’activité des TRPC peut être modulée par les protéine kinases C, PKC et la tyrosine kinase, src. |
| Dans le texte | |
 |
Figure 3. Exemples de mécanismes d’activation succincts de TRPV, TRPM ou TRPML. A. Les TRPV et notamment TRPV1 sont activés par les divers facteurs indiqués. B. Le TRPM2 est activé par les radicaux libres, ROS qui par l’activation de la poly-ADP-ribose polymérase, PARP dans les mitochondries, augmentent la concentration d’ADP-ribose, ADPR. C. Activation du complexe PKD1-PKD2. La fixation d’un anticorps, IgG sur le domaine REJ de PKD1 agissant comme un récepteur, démasque une protéine G et entraîne l’activation de PKD2 la sous-unité canal permettant le passage de Ca2+. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




