| Issue |
Med Sci (Paris)
Volume 23, Number 6-7, Juin-Juillet 2007
|
|
|---|---|---|
| Page(s) | 590 - 592 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20072367590 | |
| Published online | 15 June 2007 | |
Implication de la voie des microARN dans la réplication du VIH-1
Interplay between HIV-1 replication and the microRNA-silencing pathway
Laboratoire de Virologie Moléculaire, Institut de Génétique Humaine, CNRS UPR 1142, 141, rue de la Cardonille, 34396 Montpellier Cedex 5, France
Les microARN (miARN) sont des petits ARN simple-brin de 19-25 nucléotides qui régulent l’expression des gènes chez les organismes eucaryotes [1]. Ils sont exprimés à partir de gènes codants ou non-codants sous forme de transcrits primaires (Figure 1). Ces transcrits, également appelés pri-miARN, subissent deux étapes de clivage : l’une est réalisée dans le noyau par une RNase appelée Drosha, qui génère des miARN précurseurs, ou pré-miARN, qui sont exportés dans le cytoplasme par l’intermédiaire de l’exportine 5 ; l’autre est réalisée dans le cytoplasme par une autre RNase appelée Dicer, qui engendre des ARN double-brin de miARN à partir des pré-miARN. Les ARN double-brin s’associent à un complexe multi-protéique appelé RISC (RNA-induced silencing complex), au sein duquel l’un des brins est dégradé, tandis que l’autre sert de guide au complexe pour cibler des ARN messagers (ARNm) et bloquer leur traduction et/ou les déstabiliser par un mécanisme encore mal compris. Un miARN peut cibler un ARNm par le jeu d’un appariement de bases avec une ou plusieurs séquences présentes dans sa région 3’ non-traduite. Or, la complémentarité entre un miARN et sa cible est souvent imparfaite, rendant difficile l’identification et l’étude des cibles des miARN. Malgré cela, plusieurs travaux ont montré que les miARN peuvent réguler de nombreuses voies biologiques au cours du développement, de la différenciation ou de l’apoptose cellulaire par exemple.
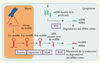 |
Figure 1. Voie de synthèse et d’action des miARN. Les miARN (représentés en rouge) sont transcrits dans le noyau, clivés par Drosha, exportés dans le cytoplasme, puis clivés par Dicer avant de servir de guide pour cibler des ARNm et bloquer leur traduction ou les dégrader. Les siARN (représentés en vert) sont apportés de façon artificielle dans les cellules pour cibler et dégrader spécifiquement des ARNm. |
Le cycle réplicatif de certains virus est également soumis à des régulations par les miARN [2]. L’ARN du virus foamy et celui du virus de l’hépatite C sont chacun ciblés par un miARN cellulaire qui, pour le premier, réprime sa réplication (il s’agit du miR-32), et pour le second, la potentialise (il s’agit du miR-122, qui est à ce jour le seul exemple de miARN capable de stimuler la production d’ARN). L’analyse des séquences de certains virus et le clonage systématique des petits ARN isolés à partir de cellules infectées ont également révélé l’existence de miARN viraux. Ces miARN, principalement codés par des virus à ADN, joueraient un rôle important pendant l’infection, comme en témoigne par exemple le cas du miR-S1 codé par le virus simien 40 ou celui du miR-LAT codé par le virus de l’herpès simplex de type I.
Récemment, nous avons montré que l’expression de miARN cellulaires peut aussi être soumise à des régulations par des virus [3]. L’analyse du profil d’expression des miARN cellulaires au cours de l’infection par le virus de l’immunodéficience de type I, ou VIH-1, a montré que plusieurs miARN sont régulés : 6 miARN sont significativement diminués, et 11 sont augmentés. Dans quel but le VIH-1 altère-t-il de façon spécifique l’expression de ces miARN ? Certains résultats laissent penser que cela permettrait au VIH-1 de moduler l’expression de certains gènes cellulaires qui potentialiseraient sa réplication. En effet, parmi les 6 miARN diminués, deux miARN (les miR-17-5p et 20a) sont capables de cibler l’ARNm qui code pour PCAF (pCAF, CREB-binding protein associated factor), une protéine cellulaire qui joue un rôle essentiel dans l’activation de l’expression des gènes du VIH-1 (Figure 2) [4]. PCAF possède une activité acétyl-transférase qui lui permettrait d’acétyler les histones et de lever la répression chromatinienne au niveau du promoteur du VIH-1. PCAF est également un co-activateur essentiel de la protéine Tat, car l’acétylation de Tat par PCAF module son activité vis-à-vis du promoteur [5]. Donc, en diminuant l’expression de ces 2 miARN, le VIH-1 facilite l’expression de PCAF et permet ainsi une activation efficace du promoteur viral.
 |
Figure 2. Régulation par le VIH-1 de l’expression de PCAF par l’intermédiaire des miR-17-5p et 20a. Le VIH-1 bloque l’expression des miR-17-5p et 20a, permettant une meilleure expression de PCAF. PCAF acétyle (Ac) les nucléosomes (représenté en rose), ce qui permet de lever la répression chromatinienne au niveau du promoteur du VIH-1. PCAF acétyle également Tat et permet ainsi de réguler l’activité transcriptionnelle de Tat vis-à-vis du promoteur viral. Ce mécanisme permet une meilleure expression des gènes viraux et favorise la réplication du virus. |
Comment le VIH-1 régule-t-il l’expression de ces miARN ? Les 6 miARN diminués lors de l’infection sont exprimés à partir d’un même pri-miARN, appelé pri-miR-17/92, qui est localisé dans l’un des introns d’un gène dont la fonction n’est pas connue [6]. Des résultats indiquent que le VIH-1 pourrait réguler de façon négative l’activité du promoteur qui contrôle leur expression. Pour les 11 miARN qui sont augmentés, les analyses par microarray montrent que 4 ne sont exprimés qu’après infection par le VIH-1. Leur expression est donc manifestement induite en présence du virus. Dans tous les cas, peu d’informations existent concernant la régulation de l’expression de ces miARN et il reste donc à déterminer quels sont les mécanismes mis en jeu.
Des observations indiquent clairement que Dicer et Drosha, les deux RNases impliquées dans la biogenèse des miARN, répriment la réplication du VIH-1. Cela a pu être mis en évidence en utilisant des siARN, des petits ARN couramment utilisés en laboratoire pour éteindre de façon spécifique l’expression des gènes, et qui empruntent pour cela une voie similaire à celle utilisée par les miARN (Figure 1). L’utilisation de siARN capables de bloquer l’expression de Dicer ou de Drosha s’accompagne d’une augmentation de la cinétique de réplication du virus dans des cellules de patients infectés et dans différentes lignées cellulaires. Ces résultats indiquent donc que la voie des miARN est inhibitrice de la réplication du VIH-1. La régulation de l’expression de PCAF, résultante de la diminution de l’expression des miR-17-5p et 20a par le VIH-1, explique en partie pourquoi l’inhibition de Dicer et Drosha s’accompagne d’une meilleure réplication du VIH-1. Mais des observations suggèrent que d’autres cibles cellulaires des miARN régulés par le VIH-1 pourraient également être impliquées. Ainsi, on peut imaginer que les miARN augmentés par le VIH-1 pourraient cibler des gènes antiviraux, alors que les gènes ciblés par les miARN diminués pourraient être des gènes nécessaires à la réplication virale, comme dans l’exemple de PCAF [7]. Une autre hypothèse est que certains miARN pourraient être régulés dans le cadre d’un mécanisme de défense mis en place par la cellule pendant l’infection. En effet, des études ont montré que des miARN peuvent être induits en réponse à une infection microbienne [8, 9]. Ces miARN n’ont pas été identifiés dans notre analyse microarray, mais il est fort probable que certains miARN soient mis en jeu de manière spécifique en fonction du type de pathogène détecté par la cellule.
L’implication de la voie des miARN dans le cycle réplicatif du VIH-1 ouvre de nouvelles perspectives thérapeutiques. En effet, arriver à réactiver le virus qui est entré dans une phase de latence réplicative représente un enjeu majeur du traitement du VIH-1 [10]. L’utilisation de siARN permettant de cibler et de dégrader des ARNm s’est montrée efficace dans le traitement de certaines pathologies dans des modèles animaux, et des essais sont actuellement réalisés chez l’homme [11]. Aussi, en ciblant par des siARN les ARNm qui codent pour des protéines essentielles de la voie des miARN, telles que Dicer ou Drosha, cela permettrait de réactiver le virus et de procéder à son éradication par la conjonction de la trithérapie. Par ailleurs, comprendre comment le VIH-1 régule ces miARN et arriver à caractériser leurs cibles représentent également des enjeux déterminants pour mieux comprendre les mécanismes de l’infection par le VIH-1.
Références
- Bartel DP. MicroRNAs : genomics, biogenesis, mechanism, and function. Cell 2004; 116 : 281–97. [Google Scholar]
- Scaria V, Hariharan M, Maiti S et al. Host-virus interaction : a new role for microRNAs. Retrovirology 2006; 3 : 68. [Google Scholar]
- Triboulet R, Mari B, Lin YL et al. Suppression of microRNA-silencing pathway by HIV-1 during virus replication. Science 2007; 315 : 1579–82. [Google Scholar]
- Kiernan RK, Vanhulle C, Schiltz L et al. HIV-1 Tat transcriptional activity is regulated by acetylation. EMBO J 1999; 18 : 6106–18. [Google Scholar]
- Brès V, Tagami H, Péloponèse JM et al. Differential acetylation of Tat coordinates its interaction with the co-activators cyclin T1 and PCAF. EMBO J 2002; 21 : 6811–9. [Google Scholar]
- Ota A, Tagawa H, Karnan S et al. Identification and characterization of a novel gene, C13orf25, as a target for 13q31-q32 amplification in malignant lymphoma. Cancer Res 2004; 64 : 3087–95. [Google Scholar]
- Goff S. Host factors exploited by retroviruses. Nat Rev Microbiol 2007; 5 : 253–63. [Google Scholar]
- Navarro L, Dunoyer P, Jay F et al. A plant miARN contributes to antibacterial resistance by repressing auxin signaling. Science 2006; 312 : 436–9. [Google Scholar]
- Taganov KD, Boldin MP, Chang KJ et al. NF-κB-dependent induction of microRNA miR-146, an inhibitor targeted to signaling proteins of innate immune responses. Proc Natl Acad Sci USA 2006; 103 : 12481–6. [Google Scholar]
- Marcello A. Latency : the hidden HIV-1 challenge. Retrovirology 2006; 3 : 7. [Google Scholar]
- Kim DH, Rossi JJ. Strategies for silencing human disease using RNA interference. Nat Rev Genet 2007; 8 : 173–84. [Google Scholar]
© 2007 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Voie de synthèse et d’action des miARN. Les miARN (représentés en rouge) sont transcrits dans le noyau, clivés par Drosha, exportés dans le cytoplasme, puis clivés par Dicer avant de servir de guide pour cibler des ARNm et bloquer leur traduction ou les dégrader. Les siARN (représentés en vert) sont apportés de façon artificielle dans les cellules pour cibler et dégrader spécifiquement des ARNm. |
| Dans le texte | |
 |
Figure 2. Régulation par le VIH-1 de l’expression de PCAF par l’intermédiaire des miR-17-5p et 20a. Le VIH-1 bloque l’expression des miR-17-5p et 20a, permettant une meilleure expression de PCAF. PCAF acétyle (Ac) les nucléosomes (représenté en rose), ce qui permet de lever la répression chromatinienne au niveau du promoteur du VIH-1. PCAF acétyle également Tat et permet ainsi de réguler l’activité transcriptionnelle de Tat vis-à-vis du promoteur viral. Ce mécanisme permet une meilleure expression des gènes viraux et favorise la réplication du virus. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




