| Issue |
Med Sci (Paris)
Volume 23, Number 4, Avril 2007
|
|
|---|---|---|
| Page(s) | 345 - 346 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2007234345 | |
| Published online | 15 April 2007 | |
Les cellules stromales contrôlent la mobilité des lymphocytes au sein des ganglions lymphatiques
Lymphocyte migration in stromal cell networks
1
Lymphocyte Biology Section, Laboratory of Immunolgy, NIAID, NIH, 10 Center Dr Bethesda, MD 20892, États-Unis
2
CNRS, IPMC, Université de Nice-Sophia Antipolis, Inserm E03-44, Sophia Antipolis, 660, route des Lucioles, 06560 Valbonne, France
Les ganglions lymphatiques (GL) permettent l’initiation de la réponse immunitaire en concentrant dans un même organe les cellules présentatrices d’antigènes (CPA) dérivant de la lymphe et les rares lymphocytes spécifiques de ces antigènes provenant du sang [1]. La structure des GL est formée par les cellules stromales qui créent un espace tridimensionnel dans lequel les cellules hématopoïétiques (lymphocytes, CPA, etc.) transitent et se regroupent en zones distinctes : follicules B pour les lymphocytes de type B et zone T pour les lymphocytes de type T (Figure 1).
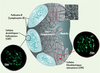 |
Figure 1. Organisation des ganglions lymphatiques. Au sein des GL, les lymphocytes T et B ségrègent en zones distinctes où résident deux populations différentes de cellules stromales ici schématisées et observées par microscopie confocale au sein de coupes de GL. Tandis que les CFR colonisent la zone T, les CDF engendrent un réseau au sein des follicules B. L’image de microscopie électronique révèle la densité lymphocytaire extrême au sein des GL. |
Afin de mieux appréhender le phénomène par lequel les lymphocytes ségrégent et transitent jusqu’à leurs zones respectives, notre laboratoire a entrepris d’étudier comment les lymphocytes se déplacent et se repèrent/localisent au sein des GL, en combinant différentes techniques d’imagerie [2].
En 2002, les premiers travaux d’imagerie dynamique réalisés sur des GL ex vivo ont révélé l’extraordinaire mobilité des lymphocytes T et B au sein de leurs zones respectives [3]. Pour les cellules T, ce mouvement semble aléatoire [4]. Cependant, lorsque les cellules T naïves s’approchent des follicules B, elles rebroussent chemin et adoptent à nouveau un mouvement aléatoire alternant des trajectoires rectilignes interrompues par des changements de direction soudains, un comportement qui nous a laissé présager l’influence de signaux physiques et/ou chimiques jusqu’alors invisibles.
Le maintien de la structure des GL est assuré par un réseau dense de cellules stromales. Les cellules fibroblastiques réticulaires (CFR) sont les principales cellules stromales colonisant la zone T tandis que les cellules dendritiques folliculaires (CDF) résident dans les follicules B (Figure 1) [5, 6]. Ces 2 types de cellules stromales peuvent être distingués par leur expression d’antigènes spécifiques : par exemple, des anticorps dirigés contre certains récepteurs du système du complément reconnaîtront spécifiquement les CDF mais pas les CFR. Un marquage des chimiokines indique que CXCL13 est produite par les CDF mais pas par les CFR alors que pour CCL19 et CC21, c’est l’inverse. Plusieurs groupes ont émis l’hypothèse selon laquelle le réseau de CFR guidait les lymphocytes T au sein des GL [7, 8]. Cependant, du fait de l’extrême densité de ce réseau, la simple observation microscopique de coupes de GL ne permet pas de distinguer un modèle dans lequel les lymphocytes utilisent ces cellules pour se mouvoir d’un modèle où, à l’inverse, ils se déplacent en évitant ce réseau.
Afin de répondre à cette question, nous avons utilisé la microscopie biphotonique. À ce jour, cette technique est la seule capable de suivre, à une profondeur de 150-300 μm et en temps réel, le mouvement de lymphocytes au sein des GL d’une souris anesthésiée. Afin de visualiser simultanément, à l’intérieur des GL, les mouvements des lymphocytes par rapport aux cellules stromales, un double marquage différentiel de ces cellules s’est avéré nécessaire. Pour ce faire, nous avons irradié des souris exprimant la GFP (green fluorescent protein) dans toutes les cellules de leur organisme. L’irradiation permet de conserver les cellules stromales radio-résistantes tout en éliminant les cellules du système hématopoïétique, système que nous avons restauré dans notre étude par une transplantation de moelle osseuse prélevée sur une souris normale qui n’exprime pas la GFP. Après quelques semaines, les souris « chimères » possédaient un système stromal vert au sein duquel se déplaçaient des lymphocytes non fluorescents, donc invisibles. Afin de suivre le comportement des lymphocytes au sein de ce réseau fluorescent vert, nous avons purifié des lymphocytes T d’une souris normale puis les avons marqués à l’aide d’une drogue émettant une fluorescence « rouge » avant de les re-injecter dans les souris chimères. Les GL de ces animaux possédaient alors un système stromal vert dans lequel se déplaçaient les lymphocytes endogènes invisibles (issus de la moelle osseuse transplantée) ainsi qu’un petit nombre de lymphocytes rouges que l’on a pu suivre au cours du temps. L’analyse en 4 dimensions (x,y,z et temps) des données acquises nous a révélé que les lymphocytes se déplacent à la surface des CFR, suivant et adaptant leur morphologie à celle des cellules stromales visualisées simultanément (Figure 2). Ces données ont donc montré, pour la première fois, que les CFR constituent des « rails » sur lesquels les lymphocytes migrent dans les GL.
 |
Figure 2. Exemple d’une cellule T se déplaçant sur des CFR. La suite d’images acquise par microscopie biphotonique représente les positions chronologiques d’une cellule T (rouge) se déplaçant dans le GL d’une souris chimère anesthésiée. Les lymphocytes endogènes sont invisibles (non fluorescents) et le réseau de CFR exprimant la GFP apparaît en vert. Le dernier panel représente l’ensemble de toutes les positions de la cellule T et révèle son parcours. Le temps est indiqué en minutes : secondes (Tiré de [2] © 2006, avec l’autorisation de Elsevier). |
Si les lymphocytes suivent le réseau des CFR dans la zone T, l’absence de CFR dans les follicules B implique que les lymphocytes B se déplacent à l’intérieur de ces régions en utilisant un support distinct. Localisées dans les follicules B, les CDF forment un réseau stromal impliqué dans la présentation antigènique aux lymphocytes B. De plus, les CDF sécrètent les chimiokines CXCL13 et BAFF (B-cell-activating-factor) : CXCL13 est nécessaire à la formation des follicules B, et, en son absence, les lymphocytes B ne se regoupent plus en follicules, et BAFF contrôle la survie des lymphocytes B [9, 10]. Au delà de ces rôles, nous avons cherché à savoir si les CDF représentaient l’équivalent des CFR dans les follicules B. En utilisant les souris chimériques décrites ci-dessus, et en focalisant notre attention sur les follicules B, nous avons pu montrer qu’à l’instar des CFR dans la zone T, au sein des follicules B, les CDF constituent le support que les lymphocytes B utilisent pour migrer.
Pendant longtemps, les cellules stromales des GL ont été perçues comme étant des cellules « inertes » dont la seule fonction est d’organiser la structure de l’organe dans lequel la réponse immunitaire se met en place. Nos données ont révélé que ces cellules jouent un rôle tout aussi important en créant des supports que les lymphocytes utilisent pour se mouvoir au sein des GL.
Perspectives
Pourquoi et comment les cellules T et B utilisent les cellules stromales pour se déplacer au sein des GL ? En d’autres termes, quelles molécules contrôlent la reconnaissance, l’adhérence et la mobilité des lymphocytes ?
Il est vraisemblable que de multiples molécules d’adhérence et des chimiokines soient individuellement ou collectivement impliquées dans ces phénomènes. L’identification de ces molécules est cruciale pour pouvoir comprendre comment toute réponse immunitaire se met en place et elle pourrait s’avérer être une étape clé dans l’élaboration de nouvelles drogues capables d’interférer avec toute réponse immunitaire pathologique.
Remerciements
Cette étude a été financée par le NIH (National Institutes of Health) et l’Inserm (Institut National de la Santé et de la Recherche Médicale). Je tiens également à remercier tous mes collègues niçois et américains qui ont participé à cette étude ainsi que Saba Dewas et Nathalie Dautin pour leurs commentaires avisés lors de la rédaction de cette Nouvelle.
Références
- Willard-Mack CL. Normal structure, function, and histology of lymph nodes. Toxicol Pathol 2006; 34 : 409–24. [Google Scholar]
- Bajenoff M, Egen JG, Koo LY, et al. Stromal cell networks regulate lymphocyte entry, migration, and territoriality in lymph nodes. Immunity 2006; 25 : 989–1001. [Google Scholar]
- Miller MJ, Wei SH, Parker I, Cahalan MD. Two-photon imaging of lymphocyte motility and antigen response in intact lymph node. Science 2002; 296 : 1869–73. [Google Scholar]
- Wei SH, Parker I, Miller MJ, Cahalan MD. A stochastic view of lymphocyte motility and trafficking within the lymph node. Immunol Rev 2003; 195 : 136–59. [Google Scholar]
- Gretz JE, Anderson AO, Shaw S. Cords, channels, corridors and conduits: critical architectural elements facilitating cell interactions in the lymph node cortex. Immunol Rev 1997; 156 : 11–24. [Google Scholar]
- Cyster JG, Ansel KM, Reif K, et al. Follicular stromal cells and lymphocyte homing to follicles. Immunol Rev 2000; 176 : 181–93. [Google Scholar]
- Kaldjian EP, Gretz JE, Anderson AO, et al. Spatial and molecular organization of lymph node T cell cortex: a labyrinthine cavity bounded by an epithelium-like monolayer of fibroblastic reticular cells anchored to basement membrane-like extracellular matrix. Int Immunol 2001; 13 : 1243–53. [Google Scholar]
- Anderson AO, Shaw S. T cell adhesion to endothelium: the FRC conduit system and other anatomic and molecular features which facilitate the adhesion cascade in lymph node. Semin Immunol 1993; 5 : 271–82. [Google Scholar]
- Gunn MD, Ngo VN, Ansel KM, et al. A B-cell-homing chemokine made in lymphoid follicles activates Burkitt’s lymphoma receptor-1. Nature 1998; 391 : 799–803. [Google Scholar]
- Hase H, Kanno Y, Kojima M, et al. BAFF/BLyS can potentiate B-cell selection with the B-cell coreceptor complex. Blood 2004; 103 : 2257–65. [Google Scholar]
© 2007 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Organisation des ganglions lymphatiques. Au sein des GL, les lymphocytes T et B ségrègent en zones distinctes où résident deux populations différentes de cellules stromales ici schématisées et observées par microscopie confocale au sein de coupes de GL. Tandis que les CFR colonisent la zone T, les CDF engendrent un réseau au sein des follicules B. L’image de microscopie électronique révèle la densité lymphocytaire extrême au sein des GL. |
| Dans le texte | |
 |
Figure 2. Exemple d’une cellule T se déplaçant sur des CFR. La suite d’images acquise par microscopie biphotonique représente les positions chronologiques d’une cellule T (rouge) se déplaçant dans le GL d’une souris chimère anesthésiée. Les lymphocytes endogènes sont invisibles (non fluorescents) et le réseau de CFR exprimant la GFP apparaît en vert. Le dernier panel représente l’ensemble de toutes les positions de la cellule T et révèle son parcours. Le temps est indiqué en minutes : secondes (Tiré de [2] © 2006, avec l’autorisation de Elsevier). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




