| Issue |
Med Sci (Paris)
Volume 23, Number 3, Mars 2007
|
|
|---|---|---|
| Page(s) | 257 - 258 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/2007233257 | |
| Published online | 15 March 2007 | |
La calréticuline détermine l’immunogénicité de la chimiothérapie et de la radiothérapie antitumorales
Calreticulin exposure dictates the immunogenicity of cancer cell death
Institut National de la Santé et de la Recherche Médicale, U805, Immunologie et immunothérapie des tumeurs, CIC BT507, IGR/Curie/Inserm,Faculté Paris Sud-Université Paris XI, Institut Gustave Roussy, 39, rue Camille Desmoulins, 94805 Villejuif, France
La chimiothérapie est utilisée en clinique afin d’induire la mort des cellules cancéreuses et parvenir ainsi à faire régresser les tumeurs. Bien que les effets cytotoxiques antitumoraux directs de la chimiothérapie soient bien connus, les conséquences indirectes de l’action des agents cytotoxiques et en particulier le déclenchement d’une réponse immunitaire de l’hôte contre sa tumeur n’ont été que très récemment décrits. C’est l’objectif de ce texte d’expliquer cette nouvelle notion de chimiothérapie immunogène puis d’évoquer les implications cliniques potentielles d’une découverte très récente qui a permis de mettre en évidence les mécanismes moléculaires responsables de l’immunogénicité des cellules cancéreuses mourantes.
La chimiothérapie immunogène
La chimiothérapie entraîne la mort des cellules cancéreuses. Cependant, afin d’éliminer les cellules tumorales résiduelles résistantes à ce traitement et les cellules souches cancéreuses, l’induction d’une mort cellulaire « immunogène », c’est-à-dire capable de déclencher une réponse immunitaire de l’hôte contre sa propre tumeur, est également un objectif des traitements anticancéreux [1–3]. Le concept de « chimiothérapie immunogène » a récemment été introduit par les études menées chez la souris par l’équipe de G. Kroemer [4]. En utilisant des modèles de cancer colique chez les rongeurs, cette équipe a montré la capacité qu’ont certains agents anticancéreux de déclencher une réponse immunitaire. Ainsi, alors que des cellules tumorales tuées par la mitomycine C sont incapables de déclencher une réponse immunitaire, les cellules traitées par les anthracyclines (par exemple doxorubicine, idarubicine, mitoxantrone) sont capables d’activer le système immunitaire. En effet, les cellules dendritiques de l’hôte vont pouvoir activer les lymphocytes T CD4+ et CD8+ qui deviennent alors cytotoxiques et producteurs d’IFNγ, ces deux propriétés étant corrélées à la fonte tumorale. Dans ce cas, l’effet thérapeutique observé est non seulement attribuable à l’effet cytotoxique direct de la chimiothérapie, mais aussi à l’intervention du système immunitaire de l’hôte (Figure 1A). Cette réponse immunitaire est toutefois nettement diminuée en présence d’inhibiteurs de caspases, ce qui souligne le rôle majeur de la mort cellulaire, et plus précisément de l’apoptose, dans ce mécanisme. Il a enfin été montré que l’événement clé responsable de l’immunogénicité des cellules cancéreuses mourantes est la phagocytose de ces cellules tumorales par les cellules dendritiques. Toutefois, l’équipe de G. Kroemer n’a découvert que très récemment la molécule responsable de la phagocytose des corps apoptotiques : il s’agit d’une protéine appelée « calréticuline », cruciale pour l’immunogénicité des cellules cancéreuses apoptotiques [5].
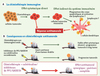 |
Figure 1. La chimiothérapie immunogène et ses conséquences en chimiothérapie antitumorale. |
Calréticuline et immunogénicité des cellules tumorales mourantes
La calréticuline est une protéine très conservée chez tous les organismes vivants. Elle est responsable du stockage du calcium dans le réticulum endoplasmique et joue également un rôle de protéine chaperon en cas de stress cellulaire [6–8]. Cette protéine a cependant aussi été identifiée comme un marqueur cellulaire membranaire indispensable pour la phagocytose des cellules mourantes [9]. La découverte de la calréticuline comme médiateur clé de l’immunogénicité des cellules cancéreuses mourantes provient de la comparaison fonctionnelle, puis structurale, entre cellules cancéreuses traitées ou non traitées par chimiothérapie en présence ou en l’absence d’inhibiteurs de mort cellulaire. En effet, l’observation initiale d’une forte immunogénicité des cellules traitées par l’anthracycline « doxorubicine » (même pendant un temps extrêmement court de trente minutes) et d’une diminution de cette immunogénicité en présence d’inhibiteurs de la mort cellulaire a conduit à rechercher des différences dans les profils de protéines exprimés à la membrane des cellules traitées ou non par la doxorubicine et dont le processus d’apoptose est ou non bloqué. Cette comparaison a permis d’établir une corrélation entre la présence de la calréticuline à la surface des cellules cancéreuses et l’immunogénicité de ces dernières. Les auteurs ont ensuite démontré une parfaite corrélation entre : (1) d’une part la phagocytose des cellules cancéreuses mourantes par les cellules dendritiques et l’expression membranaire de la calréticuline à la surface des cellules cancéreuses ; (2) d’autre part la présence de calréticuline et le rejet tumoral. Cette dernière observation est en accord avec les données précédemment obtenues par Casares et al. et souligne l’importance des cellules dendritiques pour l’immunogénicité des cellules cancéreuses mourantes [5].
L’expression forcée de la calréticuline : un moyen d’accroître l’immunogénicité de la chimiothérapie
Un des points forts de cette découverte repose sur l’identification des bases moléculaires impliquées dans la translocation de la calréticuline à la membrane, ce qui ouvre des perspectives d’application thérapeutique immédiate. Après avoir remarqué que le traitement par des anthracyclines conduit à la phosphorylation de eIF2a (une protéine clé de l’initiation de la traduction, hyperphosphorylée en cas de stress cellulaire), les auteurs ont montré que l’inhibition pharmacologique du complexe PP1/GADD34 (impliqué dans la déphosphorylation de eIF2a) par la tautomycine ou le salubrinal était capable d’induire l’expression de la calréticuline. Par ailleurs, l’administration de ces composés à des souris porteuses de tumeurs et traitées par une chimiothérapie non immunogène (comme la mitomycine C ou l’étoposide) agit en synergie et induit une réponse antitumorale remarquable. Ces résultats suscitent donc plusieurs espoirs : (1) celui de vaincre la chimiorésistance des tumeurs par la modulation pharmacologique de PP1/GADD34 ou EIF2a (Figure 1B) ; (2) celui de pouvoir anticiper in vitro ou in vivo l’absence d’immunogénicité compte tenu du traitement, et donc de la compenser.
L’objectif des auteurs de cette étude est donc maintenant, dans le cadre du CIC (centre d’investigation clinique) BT507- INSERM de l’Institut Gustave Roussy, de démontrer dans une étude prospective : (1) la corrélation entre l’exposition de la calréticuline in vivo après traitement cytotoxique et la survie sans progression tumorale ; (2) l’efficacité des agents bloquant PP1/GADD34 dans la réponse aux traitements cytotoxiques.
Références
- Lake RA, van der Most RG. A better way for a cancer cell to die. N Engl J Med 2006; 354 : 2503–4. [Google Scholar]
- Zitvogel L, Tesniere A, Kroemer G. Cancer despite immunosurveillance: immunoselection and immunosubversion. Nat Rev Immunol 2006; 6 : 715–27. [Google Scholar]
- Zitvogel L, Casares N, Pequignot MO, Chaput N, Albert ML, Kroemer G. Immune response against dying tumor cells. Adv Immunol 2004; 84 : 131–79. [Google Scholar]
- Casares N, Pequignot MO, Tesniere A, et al. Caspase-dependent immunogenicity of doxorubicin-induced tumor cell death. J Exp Med 2005; 202 : 1691–701. [Google Scholar]
- Obeid M, Tesniere A, Ghiringhelli F, et al. Calreticulin exposure dictates the immunogenicity of cancer cell death. Nat Med 2006; 13 : 54–61. [Google Scholar]
- Krause KH, Michalak M. Calreticulin. Cell 1997; 88 : 439–43. [Google Scholar]
- Sadasivan B, Lehner PJ, Ortmann B, Spies T, Cresswell P. Roles for calreticulin and a novel glycoprotein, tapasin, in the interaction of MHC class I molecules with TAP. Immunity 1996; 5 : 103–14. [Google Scholar]
- Bedard K, Szabo E, Michalak M, Opas M. Cellular functions of endoplasmic reticulum chaperones calreticulin, calnexin, and ERp57. Int Rev Cytol 2005; 245 : 91–121. [Google Scholar]
- Gardai SJ, McPhillips KA, Frasch SC, et al. Cell-surface calreticulin initiates clearance of viable or apoptotic cells through trans-activation of LRP on the phagocyte. Cell 2005; 123 : 321–34. [Google Scholar]
© 2007 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. La chimiothérapie immunogène et ses conséquences en chimiothérapie antitumorale. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




