| Issue |
Med Sci (Paris)
Volume 22, Number 10, Octobre 2006
|
|
|---|---|---|
| Page(s) | 822 - 824 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/20062210822 | |
| Published online | 15 October 2006 | |
Les cellules souches de la moëlle osseuse au secours de la maladie d’Alzheimer
Bone marrow stem cells to the rescue of Alzheimer’s disease
Endocrinologie Moléculaire, Centre de recherche du CHUL et Département d’anatomie et de Physiologie, Faculté de médecine, Université Laval, 2705, boulevard Laurier, Québec (Québec) G1V 4G2, Canada
La maladie d’Alzheimer est la forme la plus courante de démence chez les humains. Cette maladie est caractérisée par la présence de dépôts de peptide β-amyloïde (βA) dans le parenchyme du cerveau et le réseau microvasculaire. Ces dépôts extracellulaires sont aussi connus sous le nom de plaques amyloïdes ou plaques séniles. Le développement des plaques va de pair avec le déficit cognitif, cependant le mécanisme exact en cause dans la mort des neurones qui s’ensuit et qui marque la maladie reste aujourd’hui encore hypothétique et fortement débattu comme en témoignent les nombreuses publications sur le sujet. Les corps amyloïdiens sont toujours accompagnés de microglies, les cellules immunitaires du cerveau.
Rôle des microglies dans la maladie d’Alzheimer
Beaucoup d’études ont démontré la présence de microglies dans les amas amyloïdes de cerveaux humains et de souris transgéniques exprimant la maladie [1–3]. Le rôle de ces cellules dans la progression des plaques séniles et du déficit cognitif représente actuellement un sujet très discuté. Les plaques séniles de souris transgéniques APP (β-amyloid precursor protein) (ces souris portent l’APP humaine mutée et développent la maladie après 15 mois) sont constituées de microglies dont les ramifications atteignent le centre de la plaque, ce qui remet grandement en question l’idée selon laquelle ces cellules n’infiltrent pas la forme sphérique des agrégats extracellulaires [4]. On peut remarquer que ce phénomène ne se limite pas seulement à quelques plaques, mais touche la très grande majorité des corps amyloïdiens (Figure 1). Nous avons voulu déterminer l’origine de ces cellules et greffer des souris APP/PS1 (Presenilil 1) : irradiées avec des cellules souches de la moelle osseuse marquées avec la protéine GFP (green fluorescent protein), ces souris expriment deux transgènes mutés et développent la maladie plus rapidement, c’est-à-dire après 6 mois. Nous avons observé que les microglies résidantes étaient attirées vers les plaques peu après le développement de la maladie. De leur côté, les cellules provenant de la moelle osseuse infiltrent les dépôts amyloïdiens seulement lorsque ceux-ci atteignent un certain volume. Cependant, ce processus de recrutement est très dynamique et semble disparaître chez les animaux plus âgés. Ce résultat est fort intéressant, puisqu’il suggère que les plaques sont constituées de deux types de cellules microgliales : les résidantes et celles qui sont originaires de la moelle osseuse. Ces dernières sont attirées durant une période précise de la maladie, tandis que les cellules microgliales résidantes sont associées à la βA tout au long de la progression de la maladie.
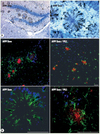 |
Figure 1. Infiltration des microglies dans les plaques séniles de souris transgéniques APPswe. A. Les microglies sont les cellules brunes dans les plaques (sphères étoilées de microglies). B. En rouge, les plaques ; en vert, les microglies ; en bleu, les noyaux (DAPI) (reproduit avec l’autorisation de Cell Press et Elsevier). |
Les isoformes βA40 et βA42 se chargent de la transmigration des monocytes vers le tissu cérébral. Ces protéines favorisent la production de molécules inflammatoires sécrétées par les cellules microgliales et endothéliales. Ces dernières produisent des chimiokines qui amorcent la transmigration cellulaire vers le foyer inflammatoire et ainsi attirent ces nouvelles microglies immunocompétentes et phagocytaires (Figure 2). Par conséquent, ces cellules sont tout à fait en mesure d’éliminer les protéines toxiques du système nerveux central, mais elles n’effectuent ce travail que durant une très courte période. De plus, les microglies résidantes ne possèdent que peu – et parfois pas – cette capacité phagocytaire pour la βA.
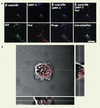 |
Figure 2. Les microglies provenant de la moelle osseuse phagocytent le peptide β-amyloïde in vivo (A et B). Il faut noter la présence du peptide β-amyloïde (rouge) dans les lysosomes (LAMP-2) des microglies (iba1) provenant de la moelle osseuse (GFP) (reproduit avec l’autorisation de Cell Press et Elsevier). |
D’où vient maintenant la controverse sur les propriétés neurodégénératives des microglies ? L’analyse des cerveaux se fait malheureusement lorsque le patient est décédé et, dans bien des cas, dans les phases très tardives de la maladie. Notre étude démontrant un recrutement très transitoire des cellules phagocytaires du sang peut sans doute expliquer pourquoi les différentes analyses histopathologiques infirment la présence de βA dans les microglies et dénient à ces dernières la capacité de produire des molécules inflammatoires. Il faut noter que ceci est aussi le cas pour les souris APP vieillissantes dont les plaques sont dépourvues de cellules provenant de la moelle osseuse. Il est également possible que les microglies résidantes participent à la progression des dépôts d’amyloïdes, tandis que celles qui sont dérivées de la moelle osseuse éliminent la βA.
Pour déterminer le rôle de chaque sous-type de microglies, nous avons créé une nouvelle souris transgénique exprimant la thymidine kinase (TK) sous le contrôle du promoteur CD11b afin de permettre l’expression de la TK uniquement dans les cellules myéloïdes. L’administration du ganciclovir, qui permet d’inhiber la réplication de l’ADN dans ce système, cause chez ces souris un arrêt de la différenciation de toutes les cellules myéloïdes, et notamment des microglies provenant de la moelle osseuse, sans pour autant altérer l’activité des microglies résidantes. En accouplant ces souris avec les souris APP/PS1, nous avons été en mesure d’inhiber complètement la prolifération de nouvelles microglies dans les plaques durant une période déterminée. L’inhibition de la prolifération microgliale entre la période de 5 à 6 mois a eu pour conséquence l’augmentation très significative du nombre de plaques, ainsi que leur volume, mettant ainsi en évidence le rôle neuroprotecteur et naturel de ces cellules dans la maladie d’Alzheimer. De plus, ces effets sont propres à cette période où le recrutement est le plus intense et le plus dynamique.
Conclusions
Les microglies provenant de la moelle osseuse offrent un potentiel formidable en vue du traitement de la maladie d’Alzheimer, puisqu’elles sont attirées vers les protéines toxiques et sont en mesure de les éliminer. Il est intéressant de noter que des protéines toxiques sont présentes dans d’autres maladies neurodégénératives, telle que l’alpha-synucléine dans la maladie de Parkinson et la superoxyde dismutase dans la sclérose latérale amyotrophique. Les cellules souches de la moelle osseuse pourront ainsi se diriger vers les différents foyers inflammatoires provoqués par ces protéines toxiques. Elles ont aussi l’avantage, contrairement aux autres types de cellules souches, d’infiltrer de façon naturelle les régions endommagées et de s’adapter aux conditions inflammatoires. De plus, le prélèvement des cellules souches hématopoïétiques évitera le rejet des cellules génétiquement modifiées, puisque le patient servira à la fois de donneur et de receveur. Il nous reste maintenant à trouver la façon de rendre ces cellules plus résistantes, à sélectionner de meilleurs phagocytes par exemple, plus spécifiques à la βA (ou à d’autres protéines toxiques), tout en évitant l’emballement de la réponse inflammatoire. Un très beau défi scientifique et médical à relever !
Références
- Dickson DW, Farlo J, Davies P, et al. Alzheimer’s disease. A double-labeling immunohistochemical study of senile plaques. Am J Pathol 1988; 132 : 86–101. [Google Scholar]
- Malm TM, Koistinaho M, Parepalo M, et al. Bone-marrow-derived cells contribute to the recruitment of microglial cells in response to beta-amyloid deposition in APP/PS1 double transgenic Alzheimer mice. Neurobiol Dis 2005; 18 : 134–42. [Google Scholar]
- Stalder AK, Ermini F, Bondolfi L, et al. Invasion of hematopoietic cells into the brain of amyloid precursor protein transgenic mice. J Neurosci 2005; 25 : 11125–32. [Google Scholar]
- Simard AR, Soulet D, Gowing G, et al. Bone marrow-derived microglia play a critical role in restricting senile plaque formation in Alzheimer’s disease. Neuron 2006; 49 : 489–502. [Google Scholar]
© 2006 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Infiltration des microglies dans les plaques séniles de souris transgéniques APPswe. A. Les microglies sont les cellules brunes dans les plaques (sphères étoilées de microglies). B. En rouge, les plaques ; en vert, les microglies ; en bleu, les noyaux (DAPI) (reproduit avec l’autorisation de Cell Press et Elsevier). |
| Dans le texte | |
 |
Figure 2. Les microglies provenant de la moelle osseuse phagocytent le peptide β-amyloïde in vivo (A et B). Il faut noter la présence du peptide β-amyloïde (rouge) dans les lysosomes (LAMP-2) des microglies (iba1) provenant de la moelle osseuse (GFP) (reproduit avec l’autorisation de Cell Press et Elsevier). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




