Figure 2.
Télécharger l'image originale
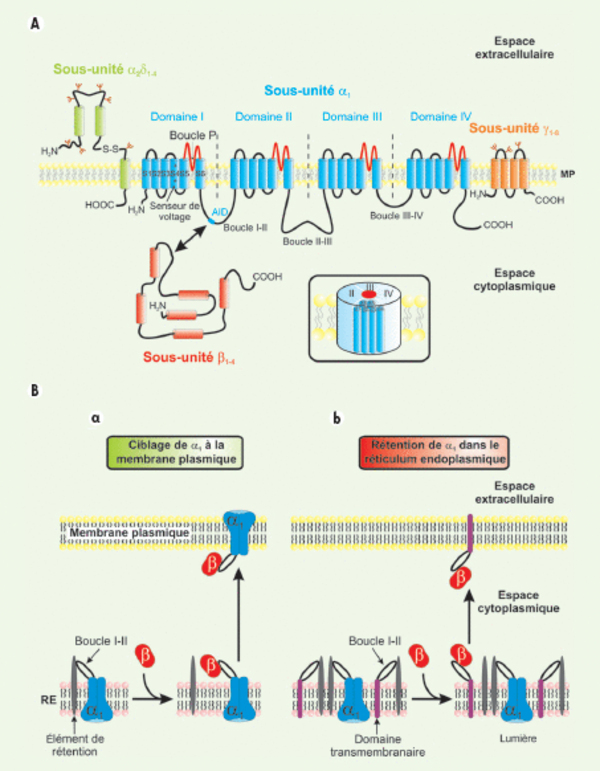
Organisation membranaire présumée des canaux calciques dépendants du voltage et des sous-unités régulatrices. A. Les CCDV (HSA et BSA) se composent d’une sous-unité principale α1 (en bleu) formant le pore ionique. Elle se compose de quatre domaines (domaines I à IV) constitués chacun par six segments transmembranaires (S1 à S6). Ces quatre domaines sont reliés entre eux par des boucles cytoplasmiques reliant les domaines I à II (boucle I-II), II à III (boucle II-III) et III à IV (boucle III-IV). Les segments S4, riches en résidus basiques arginines et lysines, constituent le senseur de voltage. Les boucles extracellulaires et transmembranaires reliant les segments S5 et S6 (boucles P, en rouge) forment le pore ionique. L’insert représente l’organisation « tridimensionnelle » de cette sous-unité α1. Les sous-unités régulatrices des canaux HSA sont également représentées. Ces sous-unités auxiliaires modulent les propriétés biophysiques de la sous-unité α1B. La sous-unité β (en rouge) est entièrement cytoplasmique et interagit avec la sous-unité α1 via une séquence AID présente sur la boucle I-II. La sous-unité γ (en orange) est entièrement membranaire et glycosylée. La sous-unités α2δ (en vert) est essentiellement extracellulaire et ancrée à la membrane plamique (MP) par la partie δ de la protéine. Les parties α2 et δ sont reliées entre elles via deux ponts disulfures. B. La sous-unité β est responsable du ciblage fonctionnel de la sous-unité α1B à la membrane plasmique. a. Immédiatement après sa synthèse, et en absence de sous-unité b, la sous-unité α1 (en bleu) est retenue au niveau de la membrane du réticulum endoplasmique (RE) par une interaction entre la boucle cytoplasmique I-II et un élément de rétention encore non identifié (en gris). L’expression d’une sous-unité β (en rouge) lève cette rétention par interaction avec la boucle cytoplasmique I-II de la sous-unité α1B, et cela quelle que soit l’isoforme b. À la suite de cette interaction, le complexe α1/b est adressé à la membrane plasmique. b. Il est possible d’interférer avec le processus de ciblage de la sous-unité α1 à la membrane plasmique en surexprimant une protéine chimère (en violet) constituée d’un domaine transmembranaire et de la boucle cytoplasmique I-II de la sous-unité α1. Après sa synthèse, la protéine chimère est retenue, au même titre que la sous-unité α1, au niveau de la membrane du réticulum endoplasmique via une interaction entre la boucle I-II et l’élément de rétention. La surexpression de la protéine chimère vis-à-vis de la sous-unité α1 entraîne la séquestration des sous-unités b au niveau de la membrane plasmique. Les sous-unités α1 ne sont plus ciblées correctement et restent dans la membrane du réticulum endoplasmique où elles ne sont pas fonctionnelles. AID : alpha interaction domain ; S-S : pont disulfure ; NH2 : extrémité aminoterminale ; COOH : extrémité carboxyterminale ; MP : membrane plasmique.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




