| Issue |
Med Sci (Paris)
Volume 22, Number 2, Février 2006
|
|
|---|---|---|
| Page(s) | 131 - 137 | |
| Section | M/S revues | |
| DOI | https://doi.org/10.1051/medsci/2006222131 | |
| Published online | 15 February 2006 | |
Histologie de la peau et des follicules pileux
Histology of skin and hair follicle
1
Laboratoire d’histologie (EA3410), UFR Léonard de Vinci, 74, rue Marcel Cachin, 93000 Bobigny, France
2
Service de Dermatologie I, Hôpital Saint-Louis, 1, avenue Claude Vellefaux, 75010 Paris, France
La peau est complexe, morphologiquement et biochimiquement. Le défi de ces dernières années a été de localiser précisément ses molécules de structure. Dans cet article, l’histologie normale de la peau et des follicules pilo-sébacés est brièvement décrite avec une iconographie en microscopies optique et électronique, afin de mieux comprendre où sont situées les molécules jouant un rôle clé dans la cohésion et la différenciation de l’épiderme, la mélanogenèse, la présentation des antigènes aux lymphocytes T, l’adhérence dermo-épidermique, la résistance et l’élasticité du derme et de l’hypoderme et, enfin, le renouvellement des follicules pileux. Les données présentées ont été établies par la confrontation d’études en peau normale, sur des souris invalidées et chez des patients souffrant de pathologies auto-immunes ou de génodermatoses. L’histologie moléculaire de la peau éclaire sous un autre jour la physiologie de la peau ; elle doit être connue pour valider les essais de thérapie génique ou cellulaire.
Abstract
The skin consists of an outer epidermis, the dermis, and the hypodermis. It includes nerves, blood vessels, glands and hair follicles. Epidermis is a continually renewing, stratified squamous epithelium. It is populated by keratinocytes (80 %) and dendritic cells (20 %) : melanocytes, Langerhans and Merkel cells. In standard histology, keratinocytes are arranged in layers that represent different stages of their differentiation while melanocytes and Langerhans cells appear as clear cells respectively between the basal and the supra-basal cells of epidermis. The Merkel cells cannot be clearly identified. Dendritic processes of the dendritic cells can only be recognized by immunocytochemistry. At the dermal-epidermal junction, a PAS reactive basement membrane follows the contour of the basal cells. Dermis consists of collagenous and elastic fibers embedded into an amorphous ground substance. Fibroblasts, macrophages, mast cells and lymphocytes are its resident cells. Hypodermis is composed of adipocyte lobules defined by fibrous connective tissue septa. Hair follicle consists of 3 parts : the lower portion, from the base of the follicle including hair bulb to the insertion of the arrector pili muscle or buldge ; the isthmus, from the insertion of the arrector pili to the entrance of the sebaceous duct, and the infundibulum, from the entrance of the sebaceous duct to the follicular orifice. The lower portion is composed of the dermal hair papilla, the hair matrix, the hair, and the inner and the outer root sheaths. The hair matrix cells within hair bulb give rise to the hair and to the inner root sheath. With the electron microscope, one can obtain a more detailed view of the characteristic skin structures. Much of them can now be explained in terms of function and in many instances, in correlation with its biochemical composition. An attempt has been made in this paper to precisely give the location of molecules that are relevant in basic skin functions and understanding of auto-immune and genetic diseases.
© 2006 médecine/sciences - Inserm / SRMS
La peau comprend quatre régions qui sont, de la surface vers la profondeur, l’épiderme, la jonction dermo-épidermique (JDE), le derme et l’hypoderme [1, 2]. Les follicules pilo-sébacés (FPS) sont des annexes de la peau provenant de l’épiderme embryonnaire, mais principalement situés dans le derme et l’hypoderme (Figure 1).
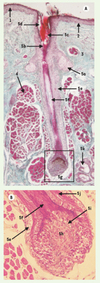 |
Figure 1. Coupe de paupière en paraffine. A. Coloration par trichrome de Masson. B. Coloration par hématéine-éosine. 1. Épiderme ; 2. Jonction dermo-épidermique ; 3. Derme, avec en vert les trousseaux de « fibres de collagène » ; 4. Muscle strié squelettique ; 5. Follicule pilo-sébacé, avec en 5 a : une glande sébacée, en 5b : l’isthme, en 5c : la tige pilaire, en 5d : l’infundibulum, en 5e : la gaine épithéliale externe, en 5f : la racine pilaire ; encadré, en 5g : le bulbe pileux, en 5h : la papille folliculaire, en 5 i : des cellules matricielles, en 5 j : la gaine épithéliale interne et en 5k : des glandes sudorales apocrines. Il n’y a pas d’hypoderme au niveau des paupières. |
L’épiderme
L’épiderme est un épithélium de revêtement, stratifié, pavimenteux, orthokératosique, non vascularisé mais innervé. Il est constitué de quatre types cellulaires : les kératinocytes, d’origine ectoblastique, les mélanocytes, provenant des crêtes neurales, les cellules de Langerhans, issues de la moelle hématopoiétique, et les cellules de Merkel, dérivant des cellules souches de l’épiderme embryonnaire. Les kératinocytes représentent 80 % des cellules de l’épiderme ; en migrant et se différenciant de sa profondeur vers sa superficie, ils lui donnent ses caractéristiques morphologiques (stratification, cellules superficielles pavimenteuses et anuclées). Les 20 % de cellules des autres types sont dispersés entre les kératinocytes.
Kératinocytes
Les kératinocytes assurent trois grandes fonctions liées à des structures histologiquement individualisables : la cohésion de l’épiderme, grâce à leur cytosquelette et à leurs systèmes de jonction, la fonction de barrière entre les milieux intérieur et extérieur, en rapport avec leur différenciation terminale et, enfin, la protection contre les radiations lumineuses, grâce aux mélanosomes de stade IV qu’ils ont phagocytés.
La microscopie optique (Figure 2) montre que les kératinocytes de l’épiderme se répartissent en quatre couches : basale (CB), spineuse (CS), granuleuse (CG) et cornée (CC).
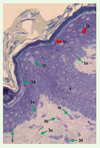 |
Figure 2. Coupe semi-fine, colorée par le bleu de toluidine. 1. Épiderme, avec en 1a : la couche basale, constituée d’une seule assise de cellules cylindriques, en 1b : la couche spineuse, constituée de kératinocytes polygonaux, à noyau arrondi, hérissés d’« épines » (→), en 1c : la couche granuleuse, formée de kératinocytes aplatis contenant des « grains » (→), en 1d : la couche cornée, dont les kératinocytes devenus des cornéocytes ont perdu leur noyau (orthokératose), en 1e : un mélanocyte, cellule claire de la couche basale, et en 1f : une cellule de Langerhans, cellule claire à noyau encoché de la couche granuleuse. 2. Jonction dermo-épidermique ; 3. Derme papillaire, avec en 3a : des fibres élastiques oxytalanes, en 3b : « fibres de collagène », en 3c : un fibroblaste et en 3d : un macrophage ; 4. Portion sus-isthmique d’un follicule pilo-sébacé. |
La microscopie électronique (Figures 3 et 4) met quant à elle en évidence des structures qui sont caractéristiques de la différenciation des kératinocytes de la peau et dont la composition biochimique est maintenant connue. Des mélanosomes de stade IV sont présents dans les kératinocytes de la CB, puis disparaissent. Les tonofilaments (TF) sont des filaments intermédiaires de 10 nm de diamètre, constitués des kératines K5-K14 et K15 dans la CB, et des paires K1-K10 et K2e-K 11 dans les couches suprabasales [3]. Les desmosomes sont les systèmes de jonction qui accrochent les kératinocytes entre eux, et sur lesquels s’insèrent les TF [4] ; leur abondance dans la CS rend compte des « épines » observées en optique. Ils se transforment en cornéodesmosomes dans la CC.
 |
Figure 3. Kératinocytes, mélanocyte, jonction dermo-épidermique et derme papillaire en microscopie électronique à faible (A) et fort (B, C et D) grossissements. 1. Kératinocyte de la couche basale de l’épiderme, avec en 1a : son noyau, en 1b : des tonofilaments rassemblés en trousseau. 2. Mélanocyte faisant saillie dans le derme, avec en 2a : son noyau, en 2b : le cytoplasme clair de son corps cellulaire, contenant des filaments de vimentine (double flèche) et un abondant réticulum endoplasmique rugueux (simple flèche), et en 2c : l’origine d’un prolongement. 3. Mélanosomes à eumélanine, à différents stades de maturation, avec en 3a : un mélanosome I, provenant de la voie des endosomes précoces, en 3b : un mélanosome II, avec ses lamelles non mélanisées qui contiennent l’antigène Pmel 17, en 3c : un mélanosome III, avec ses lamelles mélanisées grâce à la tyrosinase et à la TRP1 (tyrosinase-related protein 1), situées dans sa membrane limitante externe, en 3d : un mélanosome IV mature, capable de migrer dans les prolongements grâce à la myosine V et rab 23 et, en 3e : un mélanosome IV phagocyté par les kératinocytes. 4. Jonction dermo-épidermique, avec en 4a : la membrane du kératinocyte, en 4b : la lamina lucida, en 4c : la lamina densa, en 4d : un hémidesmosome, en 4e : les filaments d’ancrage dans la lamina lucida, en 4f : les fibrilles d’ancrage. 5. Derme papillaire superficiel, avec en 5a : les microfibrilles des fibres oxytalanes de 12 nm de diamètre, et en 5b : les fibres de collagène III présentant une striation périodique de 67 nm. |
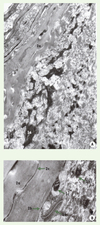 |
Figure 4. Différenciation terminale des kératinocytes. Clichés de microscopie électronique à faible (A) et fort (B) grossissement. 1. Couche granuleuse, avec en 1a : les grains de kératohyaline, très denses aux électrons, grands, étoilés, amorphes sans membrane limitante, en 1b : les kératinosomes, petits organites ovalaires, entourés d’une membrane et présentant une alternance de lamelles sombres et claires, en 1c : la fusion des kératinosomes avec la membrane cytoplasmique des kératinocytes, à l’interface couche granuleuse/couche basale, en 1d : un desmosome, sur les plaques duquel sont accrochés des tonofilaments. 2. Couche cornée, avec en 2a : la matrice cytoplasmique des cornéocytes ne présentant ni noyau, ni organite cellulaire, en 2b : un épaississement de 15 à 20 nm à la face interne de la membrane cytoplasmique, dénommé enveloppe cornée, et en 2c : des desmosomes modifiés, avec une ligne dense extracellulaire très épaisse, dénommés cornéodesmosomes. |
Ils contiennent des cadhérines transmembranaires (desmogléines Dsg1 et Dsg3 en particulier), des molécules strictement intracellullaires au niveau des plaques d’ancrage des TF (desmoplakines DP1 et DP2, envoplakine, plakoglobine et plakophillines PP1 et PP2). La cornéodesmosine est située au niveau de leur ligne dense extracellulaire dans les CG et CC. Les grains de kératohyaline correspondent aux grains vus en microscopie optique dans la CG : ils sont constitués de profilagrine, qui se transforme en filagrine dans la CC et forme la matrice cytoplasmique des cornéocytes. Les kératinosomes, invisibles en microscopie optique, apparaissent à la partie supérieure de la CS, près de l’appareil de Golgi, puis migrent vers la membrane cytoplasmique avec laquelle ils fusionnent à l’interface CG/CC, libérant leur contenu dans l’espace extracellulaire. Celui-ci est composé de lipides polaires (phospholipides, cholestérol et glucosylcéramides) et de protéines, en particulier de cornéodesmosine, d’enzymes impliquées dans le métabolisme des lipides, comme la stéroïde sulfatase et la β glucocérébrosidase, de protéases et d’antiprotéases, comme la protéine LEKTI [5].
L’enveloppe cornée, caractéristique des cornéocytes, apparaît brutalement quand disparaissent, par apoptose, le noyau des kératinocytes et tous les organites cytoplasmiques. Elle contient notamment la loricrine (70 %) et l’involucrine (2 %). Présentes dans le cytoplasme des kératinocytes de la CG, ces molécules forment l’enveloppe cornée en s’associant par des ponts disulfures et des liaisons Ne(γ glutamine) lysine, grâce à des transglutaminases TG k/e dont l'activité ne se manisfeste que dans la CG [6].
Mélanocytes
Les mélanocytes constituent, par leur nombre, la 2e population cellulaire de l’épiderme. Leur fonction est la synthèse des mélanines, eumélanines et phéomélanines, qui donnent à la peau sa couleur constitutive. Les premières ont également un rôle photoprotecteur [7].
En microscopie otpique (Figure 2), après fixation et coloration standard ou coupes semi-fines (SF), les mélanocytes se présentent comme des cellules arrondies, claires, à noyau rond et dense, situées exclusivement entre les kératinocytes de la CB (contrairement aux mélanocytes embryonnaires, fœtaux et tumoraux). Les dendrites ne sont pas observables, tandis que le pigment mélanique n’est visible que dans les peaux foncées.
Après congélation et DOPA (dihydroxyphénylalanine) réaction, les mélanocytes apparaissent dendritiques, avec un corps cellulaire situé entre les kératinocytes de la CB et des prolongements entre les kératinocytes suprabasaux. L’ensemble forme une unité de mélanisation, avec en moyenne 1 mélanocyte pour 10 kératinocytes basaux et 36 kératinocytes basaux et suprabasaux. Le phototype cutané ne dépend pas de la densité en mélanocytes : celle-ci est identique chez tous les individus pour une zone cutanée donnée, mais plus forte qu’ailleurs au niveau du visage (2 000/mm2), du cuir chevelu et des zones génitales (1 000/mm2).
Le diagnostic immunohistochimique des tumeurs mélaniques est facilité par l’utilisation d’anticorps (AC) marquant le cytoplasme du corps cellulaire et des dendrites, sur coupes en paraffine. L’AC antiprotéine S100 est très sensible, mais peu spécifique ; l’AC HMB 45, dirigé contre les protéines Pmel 17/gp 100, produits du locus Silver, est spécifique, mais peu sensible. Les AC A103 (anti-mélan A, produit du gène MART 1) et T311 (anti-tyrosinase) sont très spécifiques, et plus sensibles que l’AC HMB 45.
La microscopie électronique (Figure 3) met en évidence les organites pathognomoniques où s’effectue la synthèse des mélanines, les mélanosomes à différents stades de maturation. Les mélanosomes à eumélanine sont ovoïdes et contiennent des lamelles, tandis que les mélanosomes à phéomélanine sont ronds et contiennent des vésicules. Leur taille et leur mode de capture par les kératinocytes varient avec le phototype : petits et captés sous forme de complexes dans les peaux blanches, gros et captés isolément les uns des autres dans les peaux noires. Les mélanocytes n’établissent ni desmosomes avec les kératinocytes avoisinants, ni hémidesmosomes avec la matrice extracellulaire. En revanche, ils possèdent des contacts focaux.
Cellules de Langerhans
Les cellules de Langerhans [8] représentent 3 % à 8 % des cellules épidermiques. Elles appartiennent au groupe des cellules dendritiques présentatrices d’antigène aux lymphocytes T, et sont transépithéliales. Dans l’épiderme, leur fonction est de capturer les exo-antigènes par la voie des endosomes, de les apprêter et de les réexprimer en surface avec les molécules de classe II du complexe majeur d’histocompatibilité (CMH). Elles migrent ensuite dans les ganglions lymphatiques (→)
(→) m/s 2006, n° 2, p. 144).
En microscopie optique (Figure 2), après fixation et coloration standard ou coupes SF, elles apparaissent comme des cellules claires, à noyau encoché, situées le plus souvent au niveau de la CG. Après congélation et immunohistochimie, elles prennent un aspect dendritique, avec un corps cellulaire entouré de prolongements s’insinuant entre les kératinocytes suprabasaux.
En microscopie électronique, elles se caractérisent par un cytoplasme clair aux électrons, contenant des filaments intermédiaires différents des TF (constitués de vimentine), un appareil de Golgi très développé et, surtout, les granules de Birbeck en raquettes, qui leur sont spécifiques. Elles n’établissent pas de desmosomes avec les kératinocytes avoisinants.
Les cellules de Langerhans de l’épiderme possèdent des marqueurs spécifiques que n’ont pas les autres cellules dendritiques : le skin homing antigen CLA (lymphocyte-associated antigen), la E-cadhérine et la langerine (associée aux granules de Birbeck). Elles expriment également beaucoup d’autres marqueurs, en particulier les molécules de classe II (et I) du CMH, le CD1a et la protéine S100.
Cellules de Merkel
Les cellules de Merkel [9] constituent la population cellulaire minoritaire de l’épiderme. Elles sont relativement abondantes au niveau des lèvres, des paumes et du dos des pieds. Ce sont des mécanorécepteurs, mais elles ont aussi des fonctions inductives et trophiques sur les terminaisons nerveuses périphériques et les annexes cutanées.
Impossible à identifier avec certitude en microscopie optique standard, elles sont repérées, en microscopie électronique à faible grossissement, comme des cellules à noyau dense et contourné, situées entre les kératinocytes de la CB, au contact d’une terminaison nerveuse. À fort grossissement, leur cytoplasme contient de très nombreuses « vésicules à cœur dense », de 80 à 100 nm de diamètre, caractéristiques. Elles établissent des desmosomes avec les kératinocytes avoisinants, et présentent à leur surface des « cornes » qui s’enfonçent dans le cytoplasme des cellules avoisinantes. Les cellules de Merkel expriment des marqueurs de cellules nerveuses et de cellules épithéliales, notamment la kératine K20.
La jonction dermo-épidermique
La complexité de sa structure et son importance fonctionnelle font de la jonction dermo-épidermique (JDE) une zone à part entière [10, 11].
En microscopie optique (Figure 2), après fixation et coloration standard, la JDE n’est pas individualisée. Après colorations spéciales (PAS ou Giemsa lent, notamment), elle apparaît comme une ligne ondulée où alternent les saillies de l’épiderme dans le derme, dites « crêtes épidermiques », et celles du derme dans l’épiderme, dites « papilles dermiques », dont l’ensemble forme le derme papillaire.
En microscopie électronique (Figure 3), la JDE comprend la membrane des kératinocytes et des mélanocytes, la lamina lucida (LL), claire aux électrons, et la lamina densa (LD), dense aux électrons. En plus de cette ultrastructure de base, similaire à celle des autres lames basales de l’organisme, la JDE présente, au niveau des kératinocytes, des complexes d’ancrage de l’épiderme sur le derme, constitués par un hémidesmosome avec une plaque sur laquelle s’insèrent les tonofilaments, des filaments d’ancrage et des fibrilles d’ancrage insérées sur des plaques d’ancrage dermiques.
Les études immunohistochimiques ont montré qu’il existait, au niveau de la JDE, des constituants spécifiques, différents des constituants universels des membranes basales, particulièrement importants dans le maintien de l’adhérence dermo-épidermique : l’antigène BP 230 (bullous pemphigoid antigen 230 kDa) et la plectine, au niveau de la plaque d’ancrage des hémidesmosomes, l’intégrine α6β4 et l'antigène BP 180 (ou collagène XVII), molécules transmembranaires des hémidesmosome, les laminines 5 et 6 au niveau des filaments d'ancrage et le collagène VII au niveau des fibrilles d'ancrage.
Le derme et l’hypoderme
Derme et hypoderme sont des tissus conjonctifs d’origine mésoblastique. Ils contiennent également des vaisseaux, les récepteurs et nerfs de la sensibilité, les terminaisons nerveuses destinées aux vaisseaux et aux annexes et, parfois, du tissu musculaire lisse (poils, aréoles mammaires, pénis, périnée, scrotum) ou strié squelettique (expansions des muscles peauciers du visage).
Organisation architecturale
Le derme comporte deux zones : l’une superficielle, entre les crêtes épidermiques, ou « derme papillaire », formée de tissu conjonctif lâche, l’autre profonde, ou « derme réticulaire », formée d’un tissu conjonctif dense. Il se poursuit en profondeur, sans limite franche, par l’hypoderme, constitué constitué de lobules graisseux séparés par des septums interlobulaires servant de passage aux vaisseaux et aux nerfs destinés au derme. L’hypoderme s’étend jusqu’aux plans aponévrotiques ou périostés, sauf au niveau des paupières, des oreilles et des organes génitaux masculins, où il n’y a pas d’hypoderme.
Ces subdivisions du derme et de l’hypoderme sont sous-tendues par la vascularisation très systématisée de la peau : plexus anastomotiques superficiel, moyen et profond, respectivement sous le derme papillaire, le derme réticulaire et l’hypoderme ; capillaires, artères en candélabre de petit calibre et artères septales de moyen calibre, respectivement dans le derme papillaire, le derme réticulaire et l’hypoderme.
Éléments constitutifs du tissu conjonctif
Le tissu conjonctif du derme et de l’hypoderme comprend, comme tous les tissus conjonctifs, des cellules entourées d’une abondante matrice extracellulaire, elle-même constituée d’une substance fondamentale et de fibres élastiques [12], de collagène [13–15] et de réticuline.
Les fibres élastiques sont observées, en microscopie optique et après coloration standard par l’orcéine, au niveau du derme réticulaire, des septa interlobulaires de l’hypoderme et autour des annexes, sous forme de faisceaux ondulés, parfois anastomosés, entre les fibres de collagène. Les fibres élastiques du derme papillaire, dites fibres oxytalanes, ne sont visibles qu’après coloration spéciale (Figure 2). En microscopie électronique, les fibres élastiques du derme réticulaire apparaissent comme de vastes plages amorphes, claires aux électrons, constituées d’élastine, entourées d’un fin manchon de microfibrilles de 12 nm de diamètre, qui contiennent entre autres des fibrillines. Les fibres oxytalanes du derme papillaire sont exclusivement formées de microfibrilles (Figure 3). Entre les deux, les fibres d’élaunine forment un plexus parallèle à la jonction dermo-épidermique. Ce sont des fibres élastiques « immatures », plus courtes, moins larges et moins riches en plages d’élastine que les fibres du derme réticulaire.
Les fibres communément appelées « fibres de collagène » sont bien observées en microscopie optique après coloration standard par un trichrome (Figure 1). Elles apparaissent en trousseaux, d’une longueur indéfinie et d’un diamètre de 0,5 à 40 microns, les plus fins étant localisés au niveau du derme papillaire, et les plus épais au niveau du derme réticulaire. La microscopie électronique montre que ces « fibres de collagène », d’un diamètre moyen de 50 nm, présentent toujours une striation transversale périodique de 67 nm. Les « fibres de collagène » du derme et de l’hypoderme, ainsi définies histologiquement, sont constitués de collagènes I (60 % à 80 %), III (15 % à 25 %) et V (2 % à 5 %) qui, dans la grande famille des collagènes, appartiennent au sous-groupe des collagènes fibrillaires à striation périodique.
Les fibres de réticuline mises en évidence en microscopie optique, après imprégnation argentique, au niveau de la jonction dermo-épidermique et des lames basales des vaisseaux, des nerfs et des adipocytes, correspondent à des fibres isolées de collagène III (à striation périodique) (Figure 3).
Les cellules, plus abondantes au niveau du derme papillaire que réticulaire, englobent des cellules fixes et des cellules mobiles. Les premières sont les fibroblastes (CD34-) et les adipocytes à vésicule uniloculaire des lobules graisseux. Les secondes, d’origine hématopoïétique, sont les mastocytes et les macrophages et, en faible proportion dans les conditions physiologiques, des plasmocytes, des lymphocytes et des granulocytes.
La substance fondamentale est essentiellement constituée de mucopolysaccharides acides, en particulier d’acide hyaluronique, métachromatique au bleu de toluidine à pH acide.
Follicules pilo-sébacés
Architecture et définitions
Les FPS [16] comportent le poil et ses gaines, des glandes sébacées et, dans certains territoires, un muscle arrecteur et/ou des glandes sudorales apocrines (Figure 1). Les glandes sudorales eccrines sont toujours indépendantes des poils. Par définition, l’isthme est la zone où s’abouchent les glandes sébacées. La région sus-isthmique comprend la tige pilaire et l’infundibulum, cavité en communication avec la surface de la peau, bordée par un épithélium en continuité avec l’épiderme. La région sous-isthmique est formée par la racine du poil et ses gaines, épithéliale externe (GEE) et épithéliale interne (GEI). La zone particulièrement importante où sont situées les cellules souches du poil est parfois visible sous forme d’un renflement (buldge), situé juste sous l’insertion du muscle arrecteur [17].
Les follicules pilo-sébacés sont distribués sur toute la surface de la peau, à l’exception des paumes, des plantes et des faces latérales des doigts et des orteils. Les rapports entre le poil et les glandes sébacées déterminent trois types de FPS : (1) terminaux, au niveau des cheveux, de la barbe, du pubis et des aisselles, (2) velus (lanugineux), les plus nombreux, principaux producteurs de sébum, et (3) sébacés, présents sur le visage et le haut du tronc, et impliqués dans la pathogénie de l’acné. Les premiers, implantés dans la peau jusqu’à l’hypoderme, ont des poils raides, épais et longs, occupant toute la largeur de l’infundibulum, et des glandes sébacées rudimentaires ; les deuxièmes sont des follicules miniatures, donnant un duvet chez la femme, des poils plus épais et plus longs chez l’homme ; les troisièmes sont caractérisés par un petit poil insignifiant au sein d’un infundibulum très profond, à la partie basse duquel s’abouchent de nombreuses et volumineuses glandes sébacées.
Éléments constitutifs
Poils et gaines dérivent d’une invagination de l’épiderme, avec ses quatre types cellulaires, dans le derme (→)
(→) m/s 2006, n° 2, p. 138).
Cette invagination constitue d’abord la paroi de l’infundibulum, puis la gaine épithéliale externe (GEE), respectivement dans les régions sus- et sous-isthmiques. Au fur et à mesure qu’on s’éloigne de la surface cutanée, ces deux structures semblent s’amincir par disparition progressive de la couche granuleuse, puis de la couche spineuse : la GEE est alors réduite à une seule assise de cellules volumineuses et riches en glycogène, ce qui leur donne un aspect vacuolaire. À son extrémité profonde, l’invagination épidermique se renfle et forme le bulbe pileux, constitué de cellules matricielles mêlées à très nombreux mélanocytes. Il est creusé d’une cavité, la papille folliculaire, occupée par un tissu conjonctif richement vascularisé et innervé.
Les cellules matricielles, en proliférant puis en progressant vers la surface de la peau, renouvellent le poil proprement dit et sa gaine épithéliale interne (GEI), lors de la phase anagène du cycle pilaire. Les cellules médianes donnent la racine, puis la tige du poil. La racine des poils de gros calibre comprend, du centre vers sa périphérie, trois couches concentriques (la médullaire, le cortex et la cuticule), tandis que celle des poils fins et les tiges pilaires ne présente pas de médullaire. Les cellules latérales, quant à elles, donnent la GEI, située entre la GEE et la racine du poil, uniquement dans la région sous-isthmique. Pendant les phases catagènes, puis télogènes du cycle pilaire, il y a respectivement résorption de la région sous-isthmique, puis élimination de la vieille tige pilaire. Le follicule pileux est entouré par une lame basale analogue à celle de l’épiderme et par une gaine fibreuse, constituée de trousseaux denses de fibres de collagène et de très nombreux fibroblastes CD34+.
Les glandes sébacées sont des glandes exocrines tubulo-alvéolaires à sécrétion holocrine. Leur portion sécrétrice, située dans le derme, produit le sébum, constitué de lipides ; le canal excréteur, bordé d’un épithélium malpighien, déverse le sébum au niveau de l’isthme des follicules pilo-sébacés. Les glandes sudoripares à sécrétion apocrine sont des glandes exocrines tubulo-contournées présentes au niveau des aisselles, du périnée, du conduit auditif externe et des paupières (Figure 1). Leur portion sécrétrice, profondément située dans le derme, voire dans l’hypoderme, produit un liquide opaque, gras et alcalin. Leur canal excréteur, bistratifié, débouche dans l’infundibulum, en aval de la glande sébacée.
Le muscle arrecteur du poil est un muscle lisse tendu entre la jonction dermo-épidermique et la région sous-isthmique du poil ; il longe la face externe de la glande sébacée. Sa contraction provoque la verticalisation du poil, ou horripilation.

Références
- Prost-Squarcioni C, Heller M, Fraitag S. Histologie et histophysiologie de la peau et de ses annexes. Ann Dermatol Venereol 2005; 132 : 8S5–48. [Google Scholar]
- Prost-Squarcioni C, Heller M, Fraitag S. Histologie moléculaire de l’épiderme, de la jonction dermo-épidermique, du derme, du tissu conjonctif et des annexes cutanées. http://www.histo-moleculaire.com [Google Scholar]
- Ishida-Yamamoto A, Takahashi H, Iizuka H. Lessons from disorders of epidermal differentiation - associated keratins. Histol Histopathol 2002; 17 : 331–8. [Google Scholar]
- Chidgey MAJ. Desmosomes and disease. Histol Histopathol 1997; 12 : 1159–68. [Google Scholar]
- Fartasch M. The epidermal lamellar body : a fascinating secretory organelle. J Invest Dermatol 2004; 122 : 1137–8. [Google Scholar]
- Kalinin AE, Kajava AV, Steinert PM. Epithelial barrier function : assembly and structural features of the cornified cell envelope. BioEssays 2000; 24 : 789–90. [Google Scholar]
- Prost-Squarcioni C. Actualités sur les mélanocytes de la peau et la mélanogenèse chez l’homme. Morphologie 2001; 85 : 5–9. [Google Scholar]
- Valladeau J, Dezutter-Dambuyant C, Saeland S. Langerin/CD207 sheds light on formation of birbeck granules and their possible function in Langerhans cells. Immunol Res 2003; 28 : 93–107. [Google Scholar]
- Tachibana T. The Merkel cell : recent findings and unresolved problems. Arch Histol Cytol 1995; 58 : 379–96. [Google Scholar]
- Borradori L, Sonnenberg A. Structure and function of hemidesmosomes : more than simple adhesion complexes. J Invest Dermatol 1999; 112 : 411–8. [Google Scholar]
- Masunaga T, Shimizu H, Ishiko A, Nishikawa T. Evaluation of immunoelectron microscopic techniques in the study of basement membrane antigens. Histochem Cell Biol 1998; 110 : 107–11. [Google Scholar]
- Kielty CM, Sherratt MJ, Shuttleworth CA. Elastic fibres. J Cell Sci 2002; 115 : 2817–28. [Google Scholar]
- Van der Rest M, Garrone R. Collagen family of proteins. FASEB J 1991; 5 : 2814–23. [Google Scholar]
- Holbrook KA, Byers PH. Skin is a window on heritable disorders of connective tissue. Am J Med Gen 1989; 34 : 105–21. [Google Scholar]
- Fichard A, Chanut-Delalande H, Ruggiero F. Le syndrome d’Ehlers-Danlos : l’architecture matricielle en question. Med Sci (Paris) 2003; 19 : 443–52. [Google Scholar]
- Rogers GE. Hair follicle differentiation and regulation. Int J Dev Biol 2004; 48 : 163–70. [Google Scholar]
- Oshima H, Rochat A, Kedzia C, et al. Morphogenesis and renewal of hair follicles from adult multipotent stem cells. Cell 2001; 104 : 233–45. [Google Scholar]
Liste des figures
 |
Figure 1. Coupe de paupière en paraffine. A. Coloration par trichrome de Masson. B. Coloration par hématéine-éosine. 1. Épiderme ; 2. Jonction dermo-épidermique ; 3. Derme, avec en vert les trousseaux de « fibres de collagène » ; 4. Muscle strié squelettique ; 5. Follicule pilo-sébacé, avec en 5 a : une glande sébacée, en 5b : l’isthme, en 5c : la tige pilaire, en 5d : l’infundibulum, en 5e : la gaine épithéliale externe, en 5f : la racine pilaire ; encadré, en 5g : le bulbe pileux, en 5h : la papille folliculaire, en 5 i : des cellules matricielles, en 5 j : la gaine épithéliale interne et en 5k : des glandes sudorales apocrines. Il n’y a pas d’hypoderme au niveau des paupières. |
| Dans le texte | |
 |
Figure 2. Coupe semi-fine, colorée par le bleu de toluidine. 1. Épiderme, avec en 1a : la couche basale, constituée d’une seule assise de cellules cylindriques, en 1b : la couche spineuse, constituée de kératinocytes polygonaux, à noyau arrondi, hérissés d’« épines » (→), en 1c : la couche granuleuse, formée de kératinocytes aplatis contenant des « grains » (→), en 1d : la couche cornée, dont les kératinocytes devenus des cornéocytes ont perdu leur noyau (orthokératose), en 1e : un mélanocyte, cellule claire de la couche basale, et en 1f : une cellule de Langerhans, cellule claire à noyau encoché de la couche granuleuse. 2. Jonction dermo-épidermique ; 3. Derme papillaire, avec en 3a : des fibres élastiques oxytalanes, en 3b : « fibres de collagène », en 3c : un fibroblaste et en 3d : un macrophage ; 4. Portion sus-isthmique d’un follicule pilo-sébacé. |
| Dans le texte | |
 |
Figure 3. Kératinocytes, mélanocyte, jonction dermo-épidermique et derme papillaire en microscopie électronique à faible (A) et fort (B, C et D) grossissements. 1. Kératinocyte de la couche basale de l’épiderme, avec en 1a : son noyau, en 1b : des tonofilaments rassemblés en trousseau. 2. Mélanocyte faisant saillie dans le derme, avec en 2a : son noyau, en 2b : le cytoplasme clair de son corps cellulaire, contenant des filaments de vimentine (double flèche) et un abondant réticulum endoplasmique rugueux (simple flèche), et en 2c : l’origine d’un prolongement. 3. Mélanosomes à eumélanine, à différents stades de maturation, avec en 3a : un mélanosome I, provenant de la voie des endosomes précoces, en 3b : un mélanosome II, avec ses lamelles non mélanisées qui contiennent l’antigène Pmel 17, en 3c : un mélanosome III, avec ses lamelles mélanisées grâce à la tyrosinase et à la TRP1 (tyrosinase-related protein 1), situées dans sa membrane limitante externe, en 3d : un mélanosome IV mature, capable de migrer dans les prolongements grâce à la myosine V et rab 23 et, en 3e : un mélanosome IV phagocyté par les kératinocytes. 4. Jonction dermo-épidermique, avec en 4a : la membrane du kératinocyte, en 4b : la lamina lucida, en 4c : la lamina densa, en 4d : un hémidesmosome, en 4e : les filaments d’ancrage dans la lamina lucida, en 4f : les fibrilles d’ancrage. 5. Derme papillaire superficiel, avec en 5a : les microfibrilles des fibres oxytalanes de 12 nm de diamètre, et en 5b : les fibres de collagène III présentant une striation périodique de 67 nm. |
| Dans le texte | |
 |
Figure 4. Différenciation terminale des kératinocytes. Clichés de microscopie électronique à faible (A) et fort (B) grossissement. 1. Couche granuleuse, avec en 1a : les grains de kératohyaline, très denses aux électrons, grands, étoilés, amorphes sans membrane limitante, en 1b : les kératinosomes, petits organites ovalaires, entourés d’une membrane et présentant une alternance de lamelles sombres et claires, en 1c : la fusion des kératinosomes avec la membrane cytoplasmique des kératinocytes, à l’interface couche granuleuse/couche basale, en 1d : un desmosome, sur les plaques duquel sont accrochés des tonofilaments. 2. Couche cornée, avec en 2a : la matrice cytoplasmique des cornéocytes ne présentant ni noyau, ni organite cellulaire, en 2b : un épaississement de 15 à 20 nm à la face interne de la membrane cytoplasmique, dénommé enveloppe cornée, et en 2c : des desmosomes modifiés, avec une ligne dense extracellulaire très épaisse, dénommés cornéodesmosomes. |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




