| Issue |
Med Sci (Paris)
Volume 20, Number 12, Décembre 2004
|
|
|---|---|---|
| Page(s) | 1063 - 1066 | |
| Section | Nouvelles | |
| DOI | https://doi.org/10.1051/medsci/200420121063 | |
| Published online | 15 December 2004 | |
Comprendre les neurones glutamatergiques chez les mammifères : un ménage à trois
Understanding glutamatergic neurons in mammalians: « un ménage à trois »
Department of Molecular Neurobiology, Max-Planck-Institut für experimentele Medizin, Hermann-Rein-Strasse 3, 37075 Göttingen, Allemagne
Les neurones communiquent entre eux en libérant dans la fente synaptique des neurotransmetteurs préalablement accumulés dans les vésicules synaptiques de leurs terminaisons. Ces transmetteurs chimiques vont alors agir sur leurs récepteurs situés sur les membranes pré- et postsynaptiques. Selon la nature des récepteurs activés, le signal transmis peut être une excitation (dépolarisation), une inhibition (hyperpolarisation) ou une modulation (cascade de seconds messagers) du neurone cible.
En 1952, P. Fatt et B. Katz ont montré que la libération de neurotransmetteurs se fait par « paquets », ou quantums [1], chaque quantum représentant le contenu d’une vésicule synaptique. Pour réaliser la libération quantique, la terminaison met en jeu un système de recyclage, d’une part, des molécules de neurotransmetteurs [2] et, d’autre part, de la membrane vésiculaire [3]. La coordination spatiale et temporelle de cette machinerie est cruciale pour assurer un bon rapport signal/bruit, en particulier lors de stimulations répétées.
Acide aminé endogène, le glutamate est un métabolite ubiquitaire du vivant. Dans le cerveau, c’est également le principal neurotransmetteur excitateur utilisé par au moins 30 % des neurones. La neurotransmission par le glutamate (ou glutamatergique) est ainsi la force motrice dans tous les circuits fonctionnels du système nerveux central (régulations autonomes, boucles sensori-motrices, fonctions cognitives). Par conséquent, nombre de maladies neurologiques et psychiatriques font intervenir la transmission glutamatergique. L’absence de marqueurs protéiques spécifiques a cependant longtemps freiné l’étude des neurones glutamatergiques [4].
Les trois transporteurs vésiculaires du glutamate
Récemment, trois sous-types de transporteurs vésiculaires du glutamate (VGLUT1, 2 et 3), de séquences très conservées (plus de 70 % d’identité), ont été isolés et caractérisés (Figure 1) [5–7]. En remplissant les vésicules synaptiques, ces protéines réalisent une fonction clé pour la sécrétion de glutamate. Elles sont également les premiers marqueurs protéiques spécifiques des cellules glutamatergiques [5–10]. Les VGLUT sont enchassés dans la membrane des vésicules synaptiques par dix domaines transmembranaires (Figure 1B).
 |
Figure 1. Les transporteurs vésiculaires du glutamate. VGLUT1, VGLUT2 et VGLUT3 sont des protéines de 560 à 589 acides aminés présentant un très fort degré d’identité (A), notamment dans leur partie centrale qui comprend 10 domaines transmembranaires (B). Les parties amino- et carboxyterminales, très divergentes, sont probablement cytoplasmiques. Les trois gènes présentent des profils d’expression très complémentaires dans le cerveau adulte (hybridation in situ des ARN messagers) (C). |
Les trois VGLUT ont des propriétés biophysiques et pharmacologiques de transport vésiculaire extrêmement proches [5–10]. De plus, des expériences de transfection de cellules ou de neurones non glutamatergiques ont permis d’établir sans ambiguïté que l’expression de VGLUT1 ou de VGLUT2 suffisait pour induire une libération de glutamate [5, 7, 8]. Bien que probable, l’implication directe de VGLUT3 dans la libération de glutamate reste encore à démontrer [7, 10]. En revanche, leur répartition dans le cerveau est très complémentaire (Figure 1C). VGLUT1 est exprimé principalement dans les régions les plus corticales du cerveau, qui sont le siège des fonctions cognitives et d’apprentissage moteur, alors que VGLUT2 est localisé dans les neurones glutamatergiques sous-corticaux, qui sont principalement impliqués dans les circuits sensorimoteurs et de régulation autonome de l’organisme. Chez l’adulte, VGLUT1 et VGLUT2 délimitent donc deux territoires qui couvrent l’ensemble des neurones glutamatergiques historiquements décrits [4]. Au cours du développement, VGLUT2 est présent très précocement et couvre en partie le territoire de VGLUT1, alors que ce dernier ne l’occupe qu’au bout de trois semaines de vie postnatale [11]. VGLUT3 (que nous avons identifié à l’Inserm U. 513) présente une expression restreinte à quelques sous-populations de neurones classiquement considérés comme cholinergiques, sérotonergiques ou même GABAergiques. VGLUT3 semble donc définir un système glutamatergique de type modulateur tout à fait inattendu [10].
Si les trois VGLUT sont localisés dans des populations distinctes de neurones, leurs propriétés de remplissage des vésicules synaptiques sont peu différentes et les raisons fonctionnelles de cette diversité restent à déterminer [7].
Rôles respectifs des VGLUT : résultats de l’invalidation du gène codant pour VGLUT1
Le gène codant pour VGLUT1 a récemment été invalidé (VGLUT1−/−) dans les laboratoires de R. Edwards (UCSF, San Fransisco, USA) et de N. Brose (Max-Planck-Institut für Experimentele Medizin, Göttingen, Allemagne) [12, 13]. Chez les animaux VGLUT1−/−, nous avons montré que l’absence de VGLUT1 au cours des trois premières semaines de vie postnatale est en partie compensée par la présence ubiquitaire plus précoce de VGLUT2, les animaux VGLUT1−/− ne mourant qu’après 21 jours de vie post-natale, date à laquelle le système VGLUT1 est censé être parfaitement fonctionnel [11]. Cependant, en appliquant des conditions d’élevage adaptées, l’équipe de R. Edwards a pu maintenir en vie un grand nombre de souris VGLUT1−/− bien au-delà de cette limite [12]. À partir du début de la troisième semaine, ces souris présentent un retard global de croissance, un aspect émacié, sont aveugles et semblent présenter des troubles neurologiques moteurs.
La mutation entraîne un effondrement de la capacité du cerveau à accumuler le glutamate dans les vésicules synaptiques. Il ne reste que 20 % du transport vésiculaire de glutamate dans le cerveau antérieur des souris VGLUT1−/−. Pourtant, VGLUT1 ne paraît pas absolument essentiel au maintien des fonctions vitales de l’organisme. VGLUT2 assurerait donc probablement la majeure partie de la transmission glutamatergique dans les centres nerveux de régulation autonome de l’organisme [7, 9].
Le cerveau des animaux VGLUT1−/− ne semble pas être affecté sur le plan morphologique et la mise en place des systèmes 2 et 3 (voir Figure 1C) n’est pas perturbée par l’absence de VGLUT1 [12, 13]. Sur le plan ultrastructural, ni le nombre, ni la taille des synapses ne sont modifiés, mais une diminution importante du nombre de vésicules synaptiques à la terminaison et l’apparition de structures membranaires tubulovésiculaires atypiques sont observées (Figure 2) [12]. Une telle observation n’a jamais été faite dans les cas d’invalidation des gènes codant pour les transporteurs vésiculaires d’amines. Elle implique une interaction directe de VGLUT1 avec la machinerie de recyclage ou de biogenèse des vésicules (Figure 2) [12].
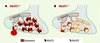 |
Figure 2. Modèle simplifié de terminaison nerveuse glutamatergique chez la souris. A. Pendant les trois premières semaines postnatales, la majorité des synapses glutamatergiques des neurones hippocampiques expriment VGLUT1 et, de façon moindre, VGLUT2. Elles présentent un nombre élevé de vésicules synaptiques chargées en glutamate. B. L’invalidation du gène codant pour VGLUT1 (VGLUT−/−) induit une diminution de la quantité de glutamate dans les vésicules (diminution du quantum libérable) (1). Certaines vésicules sont vides, mais peuvent tout de même être exocytées et le nombre de vésicules est considérablement diminué (2). Enfin, des structures tubulovésiculaires apparaissent dans la terminaison, pouvant résulter d’une altération des mécanismes de biogenèse ou de recyclage des vésicules synaptiques (3). |
VGLUT et contenu en glutamate des vésicules synaptiques
Les activités électrophysiologiques des neurones dépourvus de VGLUT1 ont été étudiées à partir de tranches d’hippocampe et de cervelet [12] ou de cultures unicellulaires de neurones hippocampiques [13]. Comme attendu, une partie des neurones est totalement silencieuse [13], mais une majorité présente une activité synaptique résiduelle [12, 13], vraisemblablement attribuable à l’expression ubiquitaire de VGLUT2 [11]. Cette activité résiduelle présente une forte diminution de l’amplitude du signal, de la fréquence de libération, mais aussi de la taille des quantums. La diminution de l’amplitude correspond à une diminution globale du stock de glutamate libérable, alors que la baisse de fréquence de libération s’explique par l’exocytose de vésicules vides. En effet, le cycle des vésicules synaptiques dans la membrane plasmique, mis en évidence en imagerie dynamique, est normal y compris dans les neurones totalement silencieux [3, 13]. Cette observation, combinée à la diminution du nombre de vésicules [12], suggère que les terminaisons VGLUT1−/− ont un déficit de biogenèse plutôt que de recyclage des vésicules (Figure 2). Il faut noter qu’aucun système de « contrôle qualité » ne semble empêcher les vésicules synaptiques vides de fusionner avec la membrane plasmique [13].
La diminution de la taille des quantums pourrait être expliquée par la diminution du nombre de transporteurs présents sur la vésicule (Figure 2). En effet, des expériences de surexpression de VGLUT1 dans les neurones en culture ont permis de montrer que la taille des quantums peut même être supérieure à la valeur de base [13]. Ces données confirment que les transporteurs vésiculaires de glutamate travaillent en compétition avec une fuite non spécifique du glutamate vers le cytoplasme. Le point d’équilibre entre le chargement et la fuite de glutamate déterminerait la taille du quantum.
La modification de la taille du quantum libérable est l’un des nombreux mécanismes possibles de la plasticité synaptique [1]. La plasticité synaptique correspond à la modulation de la force et de l’efficacité d’une synapse en fonction de son histoire. La régulation de l’expression et/ou de l’adressage vésiculaire des VGLUT pourrait donc conduire à une modification de l’efficacité des synapses glutamatergiques. L’interaction originale de VGLUT1 avec la machinerie de trafic membranaire est également en mesure d’altérer les propriétés de libération du glutamate. D’ailleurs, R.T. Fremeau et al. ont observé sur tranche d’hippocampe que les synapses VGLUT1 et VGLUT2 positives présentaient des formes différentes de plasticité synaptiques [12], une observation qui n’a pas été confirmée par notre groupe [13]. Ces questions sur les relations entre transport vésiculaire de glutamate et plasticité synaptique devront faire l’objet de nouvelles recherches afin d’être résolues.
Conclusions
L’invalidation du gène codant pour VGLUT1 confirme que la survie d’un mammifère est possible malgré une très forte altération des systèmes cognitifs. Elle pointe également le rôle du système VGLUT2 qui semble contrôler notamment l’excitation de l’ensemble des boucles de régulations vitales pour l’organisme, dès les stades précoces du développement embryonnaire. Elle nous renseigne également sur le rôle intriguant et original de VGLUT1 dans le trafic membranaire à la terminaison. Enfin, ces animaux VGLUT1−/− pourraient servir de modèle d’étude de certains phénotypes neurologiques ou psychiatriques au cours desquels une diminution de l’activité excitatrice est suspectée. À n’en pas douter, l’invalidation de VGLUT2 et VGLUT3 seront les prochaines grandes étapes dans la compréhension des systèmes de transmission glutamatergique chez les mammifères.
Références
- Burgoyne RD, Barclay JW. Splitting the quantum: Regulation of quantal release during vesicle fusion. Trends Neurosci 2002; 25: 176–8. [Google Scholar]
- Masson J, Sagne C, Hamon M, et al. Neurotransmitter transporters in the central nervous system. Pharmacol Rev 1999; 51 : 439–64. [Google Scholar]
- Galli T, Martinez-Arca S, Paumet F. Mécanisme de la fusion membranaire. Med Sci (Paris) 2002; 8 : 1113–9. [Google Scholar]
- Ottersen OP, Hjelle OP, Osen KK, et al. Amino acid transmitters in the rat nervous system. In: Paxinos G, ed. London : Academic Press-Elsevier, 1995: 1017–37. [Google Scholar]
- Takamori S, Rhee JS, Rosenmund C, et al. Identification of a vesicular glutamate transporter that defines a glutamatergic phenotype in neurons. Nature 2000; 407 : 189–94. [Google Scholar]
- Bellocchio EE, Reimer RJ, Fremeau RT, et al. Uptake of glutamate into synaptic vesicles by an inorganic phosphate transporter. Science 2000; 289 : 957–60. [Google Scholar]
- Fremeau RT, Voglmaier S, Seal RP, et al. VGLUTs define subsets of excitatory neurons and suggest novel roles for glutamate. Trends Neurosci 2004; 27 : 98–103. [Google Scholar]
- Takamori S, Rhee JS, Rosenmund C, et al. Identification of differentiation-associated brain-specific phosphate transporter as a second vesicular glutamate transporter (VGLUT2). J Neurosci 2001; 21 : RC182. [Google Scholar]
- Herzog E, Bellenchi GC, Gras C, et al. The existence of a second vesicular glutamate transporter specifies subpopulations of glutamatergic neurons. J Neurosci 2001; 21 : RC181. [Google Scholar]
- Gras C, Herzog E, Bellenchi GC, et al. A third vesicular glutamate transporter expressed by cholinergic and serotoninergic neurons. J Neurosci 2002; 22 : 5442–51. [Google Scholar]
- Miyazaki T, Fukaya M, Shimizu H, et al. Subtype switching of vesicular glutamate transporters at parallel fibre-Purkinje cell synapses in developing mouse cerebellum. Eur J Neurosci 2003; 17 : 2563–72. [Google Scholar]
- Fremeau RT, Kam K, Qureshi T, et al. Vesicular glutamate transporters 1 and 2 target to functionally distinct synaptic release sites. Science 2004; 304 : 1815–9. [Google Scholar]
- Wojcik SM, Rhee JS, Herzog E, et al. An essential role for vesicular glutamate transporter 1 (VGLUT1) in postnatal development and control of quantal size. Proc Natl Acad Sci USA 2004; 101 : 7158–63. [Google Scholar]
© 2004 médecine/sciences - Inserm / SRMS
Liste des figures
 |
Figure 1. Les transporteurs vésiculaires du glutamate. VGLUT1, VGLUT2 et VGLUT3 sont des protéines de 560 à 589 acides aminés présentant un très fort degré d’identité (A), notamment dans leur partie centrale qui comprend 10 domaines transmembranaires (B). Les parties amino- et carboxyterminales, très divergentes, sont probablement cytoplasmiques. Les trois gènes présentent des profils d’expression très complémentaires dans le cerveau adulte (hybridation in situ des ARN messagers) (C). |
| Dans le texte | |
 |
Figure 2. Modèle simplifié de terminaison nerveuse glutamatergique chez la souris. A. Pendant les trois premières semaines postnatales, la majorité des synapses glutamatergiques des neurones hippocampiques expriment VGLUT1 et, de façon moindre, VGLUT2. Elles présentent un nombre élevé de vésicules synaptiques chargées en glutamate. B. L’invalidation du gène codant pour VGLUT1 (VGLUT−/−) induit une diminution de la quantité de glutamate dans les vésicules (diminution du quantum libérable) (1). Certaines vésicules sont vides, mais peuvent tout de même être exocytées et le nombre de vésicules est considérablement diminué (2). Enfin, des structures tubulovésiculaires apparaissent dans la terminaison, pouvant résulter d’une altération des mécanismes de biogenèse ou de recyclage des vésicules synaptiques (3). |
| Dans le texte | |
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




