Figure 2.
Télécharger l'image originale
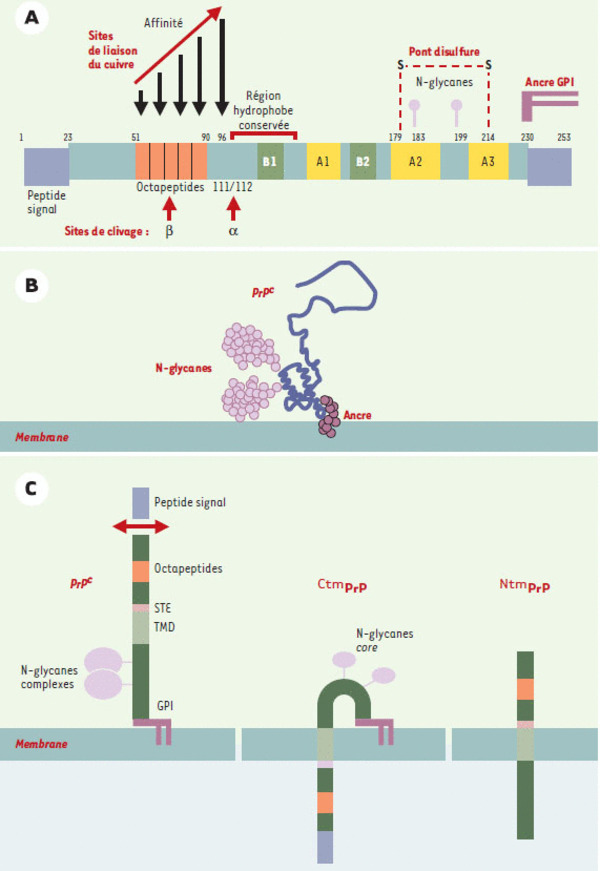
Structure de la PrPc. A. Structure primaire de la protéine prion chez l’homme. La PrPC humaine possède un peptide signal (résidus 1-22) qui est clivé après l’entrée de la molécule dans le réticulum endoplasmique (RE). Par suite du clivage d’une séquence hydrophobe dans la partie C-terminale, une ancre glycosyl-phosphatidylinositol (GPI) sialylée est attachée au niveau du résidu 230. Un pont disulfure relie les deux cys-téines 179 et 214. La PrPC peut être non-, mono- ou di-glyco-sylée au niveau des deux asparagines 183 et 199. Au cours du trafic intracellulaire, 1 à 5 % des molécules sont clivées entre les résidus 111 et 112 (α) dans une région α hydrophobe très conservée (crochet, résidus 111 à 134). Un deuxième site de clivage (β) semble exister dans une région répétée de 5 octapep-tides (résidus 51 à 90). Cette région qui contient notamment des résidus histidine est capable de lier entre 4 et 6 atomes de cuivre avec une affinité croissante. L’étude en RMN de la protéine recombinante a montré que la moitié N-terminale de la molécule (résidus 23 à 120) était non structurée, alors que deux petits feuillet β (B1 et B2, résidus 128-131 et 161-164) et trois hélices α (A1, A2 et A3, résidus 144-156, 172-193 et 200-227) sont retrouvésdans la région C-terminale. B. Structure de la PrPC à la surface cellulaire. La chaîne polypeptidique de PrPC est ancrée à la membrane plasmique par son ancre GPI (violet foncé). Elle possède deux N-glycanes (violet clair) attachés dans la région C-terminale globulaire de la molécule. C. Formes topologiques de la PrPC. La maturation normale de la PrPC conduit à une protéine privé de son peptide signal N-terminal, ancrée à la surface membranaire par son ancre GPI. Les sites de glycosylation peuvent être occupés par des N-glycanes complexes. Mais la PrPc possède aussi deux séquences qui participent à la production de formes transmembranaires de la protéine: une séquence STE pour stop transfer effector (rose) et une région hydrophobe ou TMD pour trans membrane domain (vert clair). La CtmPrP a son extrémité C-terminale située dans la lumière du RE. Outre le domaine transmembranaire, elle est ancrée par une ancre GPI. Son peptide signal N-terminal n’est pas clivé et ses glycanes ne sont pas matures. La forme NtmPrP, quant à elle, a une orientation inverse et ses sites de glycosylation ne sont donc pas utilisés. Cette forme a été décrite principalement in vitro.
Current usage metrics show cumulative count of Article Views (full-text article views including HTML views, PDF and ePub downloads, according to the available data) and Abstracts Views on Vision4Press platform.
Data correspond to usage on the plateform after 2015. The current usage metrics is available 48-96 hours after online publication and is updated daily on week days.
Initial download of the metrics may take a while.




